莲藕腐败病致病菌的鉴定与防治
2022-11-28唐光美杨馨语张小乐李弘星李蕾郭嘉航官会林黄晶心
唐光美,杨馨语,张小乐,李弘星,李蕾,郭嘉航,官会林,黄晶心**
(1.云南师范大学 高原特色中药材种植土壤质量演变退化与修复云南省野外科学观测研究站,云南 昆明 650500;2.云南师范大学 云南省农村能源工程重点实验室,云南 昆明 650500;3.云南开放大学 公共基础教学部,云南 昆明 650500)
莲藕是中国的传统农作物,分布极广,南北各地均有种植,以长江流域、珠江三角洲、洞庭湖、太湖等地为主产区.除水田外,低洼田、池塘和湖荡也可种植.云南种植莲藕历史悠久,主要分布在安宁、呈贡、澄江、玉溪、江川、文山、丘北等地[1-2].莲藕腐败病又称莲藕枯萎病、莲瘟,是莲藕种植区发病普遍、危害严重的病害之一.腐败病发生时可导致莲藕减产20%~60%,甚至绝收,严重影响莲藕的产量和品质[3].据报道莲藕腐败病由多种真菌引起,主要有尖镰孢菌莲专化型(Fusarium oxysporumSchl.f.sp.nelumbicola)[4]、喙腐霉(Pythium rostratum)、刺腐霉(Pythium spinosum)[5]、旋柄腐霉(Phytopythium helicoides)[6]、串珠镰刀菌(Fusarium moniliforme)、腐皮镰刀(Fusarium poae)和接骨木镰刀菌(Fusarium sambucinum)[7]等.目前,莲藕腐败病的防治方法主要为化学防治.阴筱等[6]研究发现代森锰锌对莲藕腐败病致病菌旋柄腐霉具有较好的抑制作用.梁志怀等[8]研究结果发现硫磺多菌灵和恶霉灵对莲藕腐败病致病菌尖孢镰刀菌防治效果较好.虽然李文峰等[9]开发了莲藕病虫害智能诊治系统,但不同区域莲藕腐败病防治效果存在差异,限制了当前研究成果的推广与应用.
本研究的发病莲藕取自云南省安宁市,该地莲藕栽培历史悠久,莲藕及其产品的售卖为当地农户的主要经济来源.据当地农户反映,莲藕发病于每年的6—10月,3~7 d 中便会使水田30%~50%的莲藕发病,严重影响了莲藕的品质和产量.据观察,发病莲藕表面有黑色斑点,斑点及周围有黑水流出,切开莲藕后发现通气组织中有明显白色菌丝.当地农户通过换种、藕田翻耕、晾晒土壤、随机喷洒药剂等方式防治,但效果并不理想.为了解决当地莲藕腐败问题,减轻病害对当地莲藕产业的影响,本研究采集了云南省安宁市的腐败莲藕,通过形态学和分子生物学方法鉴定莲藕腐败病病原微生物,并用6 种农药进行抑菌实验,筛选防治效果较好的药剂,确定药剂的最佳施用浓度,为当地莲藕病害的防治提供科学指引.
1 材料与方法
1.1 实验材料于2018 年10月,采集云南省安宁市的发病莲藕,洗净后存放于自封袋,立即带回实验室进行病原菌分离、纯化.
1.2 方法
1.2.1 病原菌的分离、纯化 用组织分离法和直接挑取法分离、纯化发病莲藕的病原菌.使用灭菌手术刀切取莲藕发病组织与健康组织交界处的样品,为1~2 cm,用70%乙醇浸泡20~30 s后,使用无菌水漂洗3次,然后将漂洗后的样品转接于PDA 培养基中,置于28 ℃恒温中培养7 d,待长出菌落后挑取、纯化3~5 次.将纯化好的菌株转接于PDA 斜面培养基上,28 ℃培养3 d,于4 ℃保藏备用.
1.2.2 病原菌的形态学鉴定 将分离得到的真菌接种于PDA 培养基平板上,28 ℃培养7 d.使用接种针挑取菌落边缘的菌丝于载玻片上,滴上1~2 滴无菌水,盖上盖玻片后使用显微镜进行观察、拍照.参照《真菌鉴定手册》[10],根据菌落特征、菌丝形状、孢子特征等对分离得到的真菌进行初步鉴定.
1.2.3 病原菌的分子生物学鉴定 通过分析真菌ITS 序列对其进行分子生物学鉴定.将纯化后的真菌接种于PDA 培养基上,28 ℃培养5 d,使用SK8255 kit (Sagan Corporation,Shanghai)试剂盒提取DNA 用于PCR 序列扩增.扩增ITS 序列所用引物 为ITS4 (5′-TCCTCCGCTTATTGATATGC-3′)和 ITS5(5 ′-GGAAGTAAAAGTCGTAACAAGG-3),具体PCR 扩增程序和方法按照参考文献[11]所述.扩增所得片段使用SanPrep 柱式DNA 凝胶回收试剂盒(上海生工,SK8131)进行回收,回收后的片段使用pMD®18-T Vector 试剂盒(Takara,D101A)构建克隆文库,送交上海生工进行测序.
使用Bio Edit (7.0.5.3)软件对测序结果进行整理.使用BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行序列搜索,并下载相关序列.通过Mega 软件(V7.0.26)进行比对,采用N-J 方法构建基于真菌ITS 序列的系统发育树,采用Bootstrap 方法对系统发育树进行评估.通过系统发育树确定真菌种属信息.
1.2.4 致病性测定 采用柯赫氏法则确定莲藕腐败病致病菌.具体步骤分3 步.①消毒,取健康莲藕,用自来水将其表面的泥土冲洗干净,75%酒精浸泡2 min,无菌水清洗3次,2%次氯酸钠溶液浸泡2 min,无菌水清洗3 次.②接种,用灭菌后的接种针等量挑取6 种真菌刺入莲藕,深度约0.5 mm,每块莲藕刺8 次.③培养及观察,将接上真菌的莲藕在室温下培养15 d,观察莲藕的发病情况,选择与田间腐败莲藕相似症状的莲藕组织,并从该组织上分离对应真菌,确认该菌为莲藕腐败病的致病菌.
1.2.5 化学防治药剂的筛选 通过查阅莲藕腐败病防治的相关文献,对比分析多菌灵、百菌清、腐霉·福美双、代森锰锌、唑醚·甲菌灵和噁霉灵6种药物的抑菌效果.具体方法为:致病菌培养5 d后,采用5 mm 打孔器,取菌落边缘新生菌丝于PDA 培养基平板中央,在平板垂直方向分别打4个孔放入无菌滤膜过滤后的农药,置于28 ℃培养5 d,观察菌落的生长情况,每种农药3 次重复.6 种农药的有效成分、剂型及生产厂家如表1 所示,农药的使用浓度按照厂家说明.根据公式:

表1 6 种农药的剂型和厂商建议的使用稀释倍数Tab.1 The dosage forms and manufacturer’s recommended dilution ratio of 6 pesticides
抑菌率(%)=(对照组菌落直径-处理组菌落直径)/对照组菌落直径×100%[12]计算抑菌率,并用平均值和标准误差作图.
1.2.6 莲藕腐败病化学防治药剂最佳施用浓度 为验证1.2.5 中筛选出的百菌清对莲藕致病菌的抑制效果,确定百菌清的最佳施用浓度.本研究在200 mL PDA 液体培养中添加无菌滤膜过滤后的百菌清.共设置5 个浓度处理,分别为稀释600、1 200、2 400、4 800、9 600倍,以不添加百菌清为对照(CK),每个处理重复3次,每重复接种等量的致病菌菌饼,在28 ℃,180 r/min 下培养84、96、108、120、132、144 h 取样,使用血球计数板计数培养液中致病菌的孢子.
2 结果
2.1 真菌的形态学鉴定本研究共分离、纯化得到6 种真菌,分别记录为L1、L2、L3、L4、L5、L6(图1).对培养了7 d 的菌落进行观察,发现L1 老化菌丝周围培养基呈红色,边缘及气生菌丝为白色,初步鉴定为镰刀菌属(Fusarium).L2 菌丝呈灰白色,菌丝呈棉絮状,初步鉴定为毛霉属(Mucor).L3菌丝生长缓慢,生长7 d 后菌落大小在4.5~7.0 cm,菌落中间为草绿色,周围呈墨绿色,初步鉴定为青霉属(Penicillium).L4 菌放射状生长,菌丝为纯白色,致密、平铺于PDA 培养基上,初步鉴定为地霉属(Galactomyces).L5 菌落呈斑块状生长,每个斑块规则不一,菌落呈灰色,初步鉴定为汉逊酵母属(Ogataea).L6 气生菌丝为白色,中间老化菌丝为红色、金黄色,初步鉴定为镰刀菌属(Fusarium).

图1 6 种真菌在PDA 培养基上的形态Fig.1 Morphology of six pathogenic fungi on PDA medium plate
显微镜下(图2),L1 菌株产生大量的大型孢子,孢子呈镰刀形或棒球状,有隔膜2~7个,顶端钝圆或略微收缩,菌丝中存在孢子座,上部附着生多个大型孢子.L2 菌株孢子呈球形,黑色或褐色,破裂的孢子囊释放出大量的短卵形胞囊孢子.L3 真菌分生孢子梗上有大量分生孢子,菌丝多分支,每个菌丝上均有明显的隔膜.L4 真菌菌丝末端存在明显的椭圆形孢子,成熟的孢子与菌丝断裂,菌丝上有隔膜,多数菌丝分枝二叉.L5 菌株在显微镜下未见明显的孢子,菌丝有分叉.L6 产生大量的大型分生孢子,孢子多有3 个横隔,菌丝中存在隔膜,孢子的大小存在明显差异.
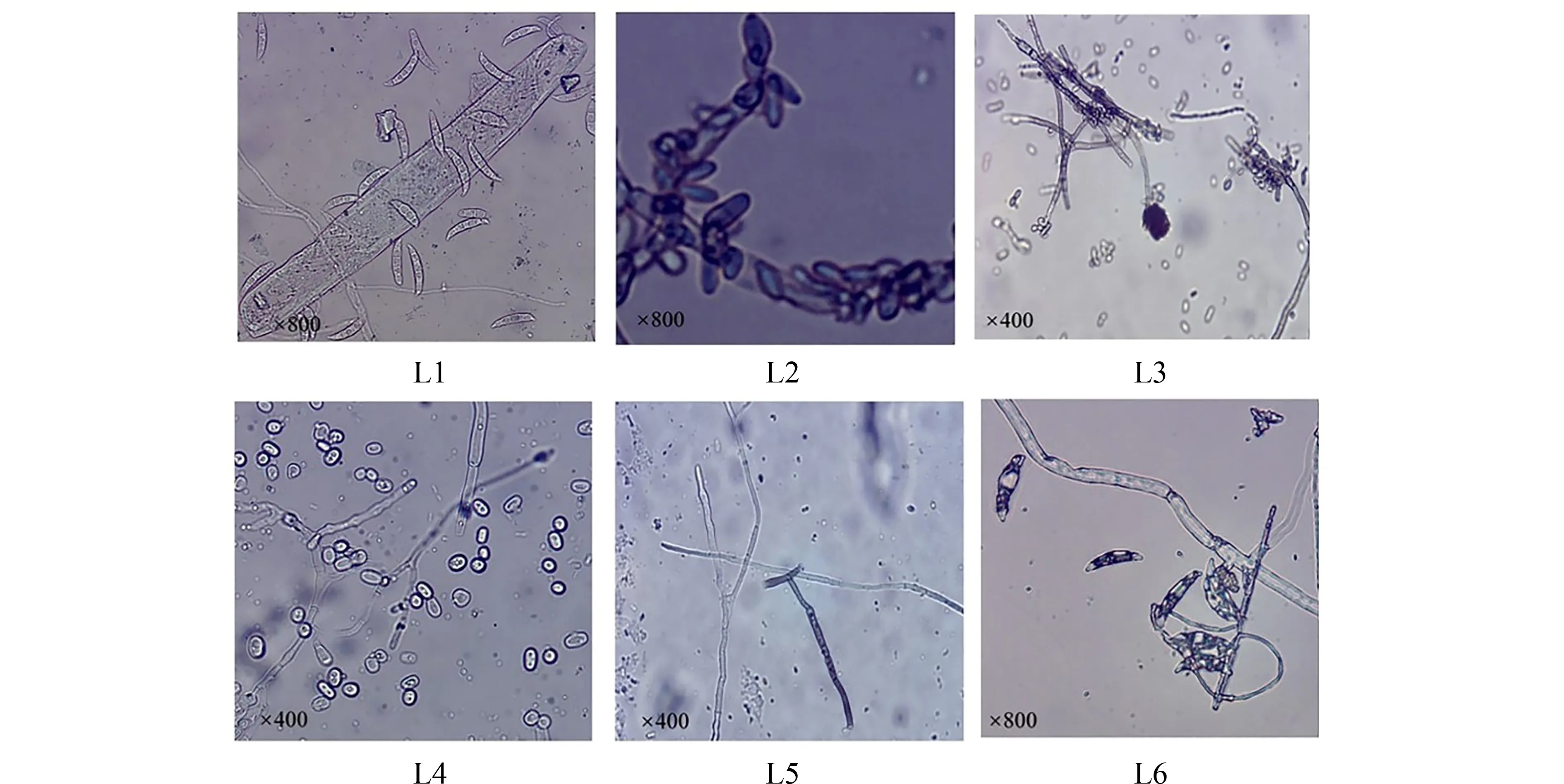
图2 6 种真菌分生孢子的形态Fig.2 The conidial morphologies of six pathogenic fungi
2.2 致病菌的分子鉴定对6 种真菌的ITS 片段进行比对、分析,采用邻位相连法(Neighbor-Joining法)构建系统发育树(图3).鉴定结果显示L1 菌株为禾谷镰刀菌(Fusarium graminearum),L2 菌株为卷枝毛霉(Mucor circinelloides),L3 菌株为团青霉(Penicillium commune),L4 菌株为白地霉(Galactomyces candidum),L5 菌株为汉逊酵母(Ogataea polymorpha),L6 菌株为三线镰刀菌(Fusarium tricinctum).

图3 基于ITS 序列构建的系统发育树Fig.3 Phylogenetic tree constructed based on the ITS sequences
2.3 致病菌的致病性测定回接莲藕7 d后,6 种真菌仅有L1 菌株能使莲藕染病(图4).L1 回接3 d 后莲藕表皮产生明显黑斑,5 d 后莲藕变黑、腐败,切开莲藕后通气组织孔道中有许多白色菌丝.上述症状与在安宁采集的发病莲藕症状完全相同,菌丝经分离纯化和L1 完全相同.由此,根据柯赫氏法则可认定L1 菌株为引发莲藕腐败病的致病菌.

图4 田间发病莲藕(a)和试验室回接发病莲藕(b)组织图片Fig.4 The tissue pictures of the diseased lotus root in the field(a) and the laboratory (b)
2.4 化学农药防治的筛选由图5 可知,6 种农药均能抑制禾谷镰刀菌生长,且不同农药抑制效果存在显著差异(P<0.05).百菌清的抑菌效果最好,抑菌率为56.49%,分别是代森锰锌、噁霉灵、唑醚·甲菌灵的1.88、2.1、2.22 倍.
2.5 百菌清的最佳施用浓度由图6 可知,不同浓度百菌清对禾谷镰刀菌的产孢抑制程度不同.稀释600 倍可完全抑制禾谷镰刀菌产孢,稀释1 200、2 400、4 800、9 600 倍分别在120、96、96、84 h 内抑制禾谷镰刀菌产孢.这说明百菌清对禾谷镰刀菌的产孢抑制效果随着稀释倍数的增加而降低,为完全抑制禾谷镰刀菌产孢,百菌清的施用浓度需达到600 倍稀释液浓度.
3 讨论
莲藕腐败病可由多种真菌引起,但发病症状大致相同,主要为莲藕地下茎逐渐变褐,通气组织中充满白色、絮状菌丝,地下茎后期呈褐色至紫黑色腐败[3-4,6],例如串珠镰孢菌、旋柄腐霉和尖孢镰刀菌均能引发莲藕腐败病.本研究发现引发云南省安宁市莲藕腐败病的病原微生物为禾谷镰刀菌.禾谷镰刀菌为丛梗孢目,瘤痤孢科,镰刀菌属微生物,可引发禾本科作物发病,例如玉米穗腐病[13]、小麦茎腐病[14]等.有研究表明禾谷镰刀菌还能引发十字花科植物拟南芥病变[15]、茄科植物烟草枯萎[16],豆科植物大豆腐败[17-18],是一种多宿主致病真菌.禾谷镰刀菌菌丝能在植物的输导组织、通气组织及植物表面快速繁殖、扩散,短时间内造成植物枯萎、腐败等[19-20].禾谷镰刀菌的分生孢子可通过土壤、空气、水等传播,短时间内造成作物大面积染病[21-22],目前关于禾谷镰刀菌引发莲藕腐败病的研究尚未见报道.本研究结果显示禾谷镰刀菌能够在短期内侵染莲藕,可能是因为该菌菌丝侵入莲藕的通气组织和输导组织,该菌分生孢子经水传播至其他区域,进而引发莲藕腐败,造成大面积的损失.
目前莲藕腐败病的防治方法主要为化学药剂防治和生物防治.大多数研究主要报道了浙江、湖北等地莲藕腐败病的防治[4,23-24],关于西南地区莲藕腐败病防治的报道还较少.据本研究区域调查反映,塘泥翻晒、喷洒硫酸铜、换种等方法均不能有效防治该地区莲藕腐败.本研究结果表明,6 种农药中百菌清的抑制效果最好(图5),且百菌清600倍稀释液可完全抑制禾谷镰刀菌产孢(图6).百菌清的主要成分四氯间苯二甲腈,它可与3-磷酸甘油醛脱氢酶中的半胱氨酸蛋白质相结合,从而破坏磷酸甘油醛脱氢酶活性[25],限制真菌细胞新陈代谢[18,26].研究表明百菌清对引发非洲菊枯萎病的尖孢镰刀菌[27]具有良好抑菌效果,同时还能抑制杨树溃疡病菌丝生长及生物量[28],对禾谷镰刀菌具有较好抑制效果[29-30],这些研究结果与我们研究结果相似.因此,百菌清相比于其他药剂能更好地抑制禾谷镰刀菌的生长和产孢,可用于安宁市莲藕腐败病的防控.
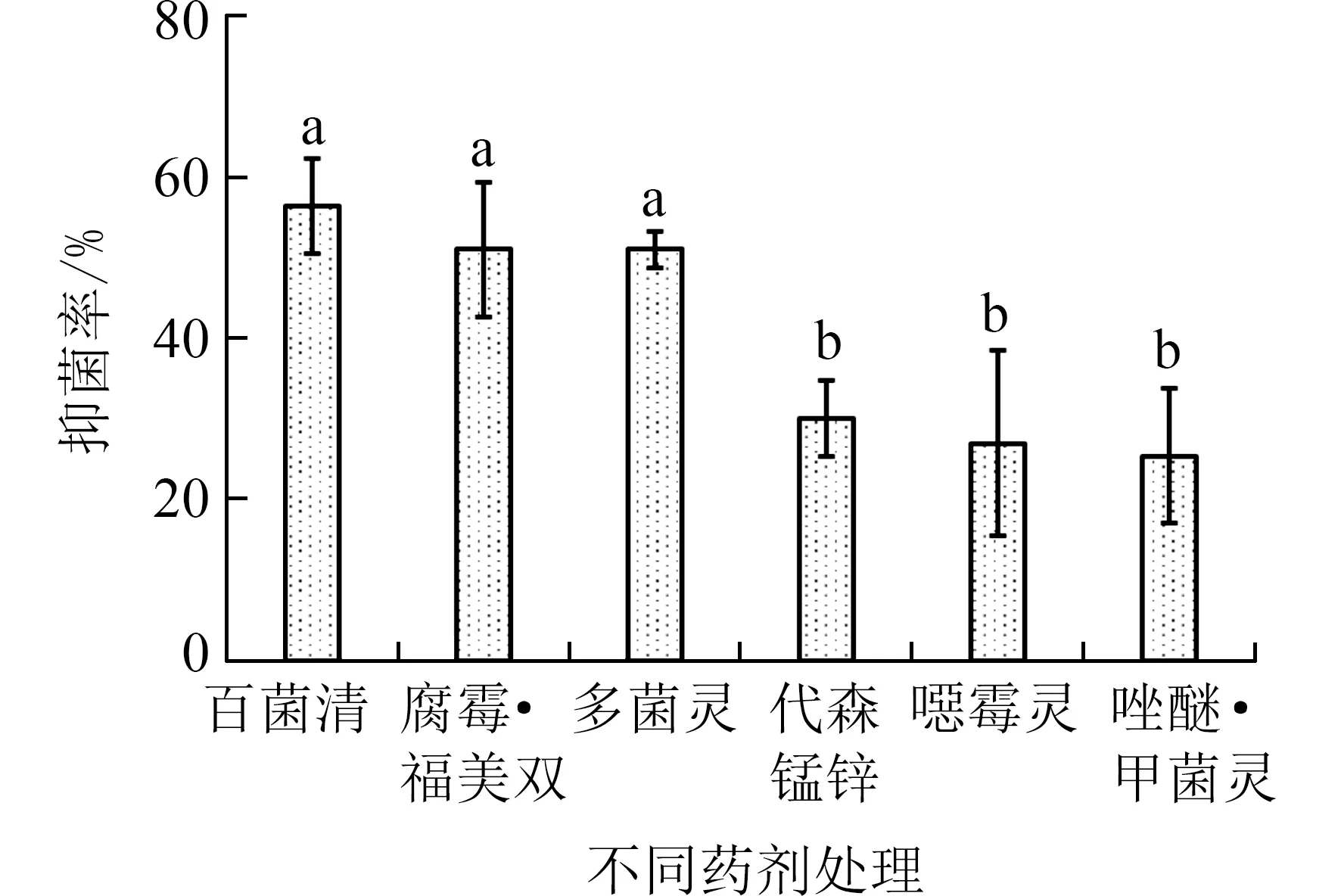
图5 6 种农药对禾谷镰刀菌的抑制效果Fig.5 Inhibitory effect of six pesticides on Fusarium graminearum

图6 不同浓度百菌清对禾谷镰刀菌产孢的抑制效果Fig.6 Inhibitory effect of different concentrations of chlorothalonil on sporulation of Fusarium graminearum
近年来,随着莲藕种植面积的逐渐增加,莲藕腐败病的发生日趋严重.莲藕腐败影响莲藕的品质和产量,甚至影响莲藕的观赏价值,对莲藕种植业造成巨大经济损失[4].本研究结果表明,安宁市莲藕腐败病主要是由禾谷镰刀菌引起,且百菌清600倍稀释液可有效控制禾谷镰刀菌产孢,但该结果推广应用于莲藕大田种植仍需进一步验证.本研究结果可为云南省莲藕地下茎腐败病的防治提供科学指导,为后续科学研究提供指引.
4 结论
(1)从安宁市腐败莲藕中分离得到6 种真菌,其中禾谷镰刀菌为引发莲藕腐败病的致病菌.
(2)在化学防治药剂筛选中,百菌清对禾谷镰刀菌的抑制效果最好,且稀释600 倍的百菌清可完全抑制禾谷镰刀菌产孢.
