鼎湖血桐的酚性成分研究
2022-11-28孙振宇陈源思张兴杰张芮菡李宏亮肖伟烈李晓莉
孙振宇,陈源思,张兴杰,张芮菡,李宏亮,肖伟烈,李晓莉
(云南大学 教育部自然资源药物化学重点实验室,云南省天然产物转化与应用重点实验室,云南大学 化学科学与工程学院/医学院,云南 昆明 650091)
据文献报道,血桐属植物很多具有药用价值,如抗肿瘤、抗炎等功效,富含异戊烯基黄酮、二苯乙烯衍生物、香豆素和甾体等多种结构类型化学成分[1-2].鼎湖血桐(Macaranga sampsonii)是大戟科(Euphorbiaceae)血桐属植物,国内主要分布在福建西部和南部、广东、广西中部和南部,海拔200~500(~800)m 的山地或山谷常绿阔叶林中[3].李晓花等[4]从采自广东的鼎湖血桐枝叶中得到了异戊烯基黄酮类化合物,Quynh等[5]从越南产的鼎湖血桐果实中分离得到了糖苷和香豆素等成分.本课题组在血桐属植物的研究方面积累了丰富的经验[6-10],在此基础上,我们对采自云南的鼎湖血桐枝叶的化学成分进行了系统研究,从中分离得到了13 个酚性成分.分别鉴定为:香叶木素(1)[11]、蜜橘素(2)[12]、川陈皮素 (3)[12]、5,4′-二羟基-3,6,7-三甲氧基黄酮 (4)[13]、猫眼草酚D (5)[14]、甘草苷元 (6)[15]、表儿茶素(7)[16]、儿茶素 (8)[16]、异甘草苷元 (9)[17]、根皮素 (10)[18]、根皮苷 (11)[18]、反式白藜芦醇-3-Oβ-D-吡喃葡萄糖苷(12)[19]、厚朴酚 (13)[20],均为首次在该植物中分离得到,化合物结构见图1.

图1 化合物的结构Fig.1 Structures of the compounds
我们对分离得到的所有化合物进行了抗肿瘤活性测试,其中化合物4 和13 对MCF-7 和HCT-116 肿瘤细胞株表现出一定的抑制活性.
1 仪器与材料
AV-400、AV-Ⅲ-600 HD 核磁共振仪(德国Bruker 公司);旋转蒸发仪(东京理化公司);薄层层析分析GF254型硅胶板、0.054~0.077 mm(200~300 目)柱色谱硅胶、0.172~0.216 mm(80~100 目)柱色谱硅胶(青岛海洋化工有限公司);75~150 μm MCI 填料(日本三菱化工公司);Sephadex LH-20(瑞士Pharmacia 公司);Agilent1260 分析型高效液相色谱、Zorbax SB-C18(φ9.4 mm×250 mm)半制备柱、Zorbax SB-C18(φ4.6 mm×250 mm)分析柱(美国Agilent 公司);色谱纯乙腈溶剂(CINC 公司);UPLC-IF-TOF 质谱仪(美国Agilent 公司);所用溶剂均为分析纯(昆明腾科科技有限公司).
鼎湖血桐于2013 年采自云南省红河州绿春县,标本保存于云南大学教育部自然资源药物化学重点实验室.
2 提取与分离
鼎湖血桐干燥枝叶 20 kg,粉碎后用80%甲醇/水溶液室温浸提3次,每次72 h,提取液浓缩后,用乙酸乙酯萃取3次,得到乙酸乙酯部分浸膏551 g.浸膏采用硅胶柱色谱,以氯仿-丙酮-甲醇(体积比100∶0∶0→0∶0∶100)的比例进行梯度洗脱,得到A、B 和C 等3 个馏分段.
对B 馏分段用MCI 填料进行反相划段的同时,除去叶绿素,以甲醇-水为洗脱剂,得到B1~B8 共计8 个组分.
组分B1 经LH-20 凝胶柱用甲醇洗脱,得到3个组分B1a、B1b 和B1c.B1a 经过0.172~0.216 mm硅胶柱色谱多次分离纯化,得到化合物4(15.0 mg)和5(2.2 mg).B1b 组分用MCI 反相填料,以甲醇-水为洗脱剂,析出2 个晶体,运用重结晶和半制备HPLC,获得化合物1(2.2 mg)和6(2.8 mg).B1c 段经过硅胶柱,反复富集,得到化合物2(2.1 mg)和3(5.0 mg).
B2 馏分段通过硅胶柱,运用不同的洗脱体系,反复纯化,分得化合物11(2.0 mg)和12(3.2 mg).
组分B6 经硅胶柱,用氯仿-甲醇(体积比50∶1→0∶1)洗脱,用TLC 检测,合并相同组分,得到B6a、B6b 和B6c 等3 个馏分段.B6a 段用LH-20 凝胶柱,以甲醇为溶剂洗脱,再通过0.054~0.077 mm 硅胶为填料的柱色谱,反复纯化富集,分到化合物7(3.0 mg)和8(2.3 mg).
B8 组分用0.054~0.077 mm 硅胶为填料,以氯仿-甲醇(体积比50∶1→0∶1)为洗脱剂进行梯度洗脱,合并相同组分,得到B8a 和B8b 两个部分.组分B8a 经过LH-20 凝胶柱和硅胶柱,运用不同的洗脱剂,多次纯化,分得化合物9(2.3 mg)、10(4.4 mg)和13(1.4 mg).
3 结构鉴定
化合物1:淡黄色晶体,C16H12O6.m.p.252~253 ℃;1H NMR (600 MHz,DMSO-d6)δ: 12.94 (s,1H,5-OH),10.86 (s,1H,7-OH),9.47 (s,1H,3′-OH),7.55 (dd,J=8.4,2.3 Hz,1H,H-6′),7.43 (d,J=2.2 Hz,1H,H-2′),7.09 (d,J=8.5 Hz,1H,H-5′),6.79~6.73 (s,1H,H-3),6.47 (d,J=2.2 Hz,1H,H-8),6.21 (d,J=2.3 Hz,1H,H-6),3.87 (s,3H,4′-OCH3);13C NMR (150 MHz,DMSO-d6)δ: 182.2 (s,C-4),164.64 (s,C-7),164.0 (s,C-2),162.0 (s,C-9),157.8(s,C-5),151.6 (s,C-4′),147.3 (s,C-3′),123.5 (s,C-1′),119.2 (d,C-6′),113.4 (d,C-2′),112.7 (d,C-5′),104.2 (s,C-10),104.0 (d,C-3),99.3 (d,C-6),94.4(d,C-8),56.2 (q,4′-OCH3).以上数据与文献[11]对比,鉴定为香叶木素.
化合物2:白色粉末,C20H20O7.m.p.153~154 ℃;1H NMR (400 MHz,Methanol-d4)δ: 7.99~7.91 (d,J=8.4 Hz,2H,H-2′/H-6′),7.12~7.06 (J=8.4 Hz,2H,H-3′/H-5′),6.65 (s,1H,H-3),4.10 (s,3H,5-OCH3),4.01 (s,3H,7-OCH3),3.92 (s,3H,6-OCH3),3.88 (overlap,6H 4′-OCH3/3′-OCH3);13C NMR (100 MHz,Methanol-d4)δ: 178.2 (s,C-4),162.9 (s,C-2),162.4 (s,C-4′),151.9 (s,C-9),147.9 (s,C-5),147.8(s,C-7),144.2 (s,C-6),138.3 (s,C-8),127.7 (d,C-2′/C-6′),123.1 (s,C-1′),114.3 (d,C-3′/C-5′),114.0(s,C-10),105.3 (d,C-3),61.2 (q,5-OCH3),61.2 (q,7-OCH3),60.8 (q,6-OCH3),60.8 (q,4′-OCH3),54.6(q,3′-OCH3).以上数据与文献[12]对比,鉴定为蜜橘素.
化合物3:白色粉末,C21H22O8.m.p.135~136 ℃;1H NMR (400 MHz,Methanol-d4)δ: 7.61 (d,J=8.4 Hz,1H,H-2′),7.49 (s,1H,H-6′),7.09 (d,J=8.4 Hz,1H,H-5′),6.66 (s,1H,H-3),4.10 (s,3H,5-OCH3),4.02 (s,3H,6-OCH3),3.96~3.77 (m,12H,7-OCH3,8-OCH3,3′-OCH3,4′-OCH3);13C NMR (100 MHz,Methanol-d4)δ: 178.1 (s,C-4),162.1 (s,C-2),152.5(s,C-4′),151.9 (s,C-7),149.4 (s,C-5′),148.0 (s,C-9),147.7 (s,C-5),144.2 (s,C-6),138.1 (s,C-8),123.3 (s,C-1′),119.7 (d,C-2′),113.9 (s,C-10),111.3 (d,C-3′),108.7 (d,C-6′),105.5 (d,C-3),61.2(q,5-OCH3),61.2 (q,6-OCH3),60.8 (q,7-OCH3),60.8 (q,8-OCH3),55.1 (q,3′-OCH3),55.1 (q,4′-OCH3).经过与文献[12]进行数据对比,确定化合物3 的结构为川陈皮素.
化合物4:黄色固体,C18H16O8.m.p.235~236 ℃;1H NMR (400 MHz,Acetone -d6)δ: 12.71 (s,1H,5-OH),7.73 (dd,J=2.0 Hz,1H,H-2′),7.60 (dd,J=8.1,2.1 Hz,1H,H-6′),7.01 (dd,J=8.1,2.1 Hz,1H,H-5′),6.74 (s,1H,H-8),3.97 (s,3H,7-OCH3),3.87 (s,3H,3-OCH3),3.80 (s,3H,6-OCH3);13C NMR (100 MHz,Acetone -d6)δ: 178.8 (s,C-4),159.1 (s,C-7),156.0 (s,C-2),152.6 (s,C-5),152.2 (s,C-9),148.2(s,C-4′),145.0 (s,C-3′),138.3 (d,C-3),132.2 (d,C-6),122.1 (s,C-1′),121.3 (d,C-6′),115.5 (d,C-5′),115.4 (d,C-2′),106.1 (s,C-10),90.7 (d,C-8),,59.7(q,7-OCH3),59.3 (q,3-OCH3),55.9 (q,6-OCH3).以上数据与文献[13]对比,鉴定为5,4′-二羟基-3,6,7-三甲氧基黄酮.
化合物5:淡黄色粉末,C18H16O7.m.p.214~215 ℃;1H NMR (400 MHz,Pyridine-d5)δ: 8.21 (dd,J=8.4,2.0 Hz,2H,H-2′/H-6′),7.30 (dd,J=8.4,2.0 Hz,1H,H-3′/H-5′),6.71 (s,1H,H-8),4.00 (s,3H,3-OCH3),3.97 (s,3H,6-OCH3),3.90 (s,3H,7-OCH3);13C NMR (100 MHz,Pyridine-d5)δ: 179.0 (s,C-4),161.7 (s,C-4′),159.2 (s,C-7),156.5 (s,C-9),153.0(s,C-5),152.4 (s,C-2),138.4 (d,C-3),148.2 (s,C-4′),145.0 (s,C-3′),132.6 (d,C-6),130.8 (d,C-2′/C-6′),121.4 (s,C-1′),115.5 (d,C-5′),116.3 (d,C-3′/C-5′),106.6 (s,C-10),91.1 (d,C-8),60.7 (q,3-OCH3),59.7 (q,6-OCH3),56.2 (q,7-OCH3).以上数据与文献[14]对比,与猫眼草酚D 的数据一致.
化合物6:黄色粉末,C15H12O4.m.p.181~182 ℃;1H NMR (400 MHz,Methanol-d4)δ: 7.75 (d,J=8.7 Hz,1H,H-5),7.38~7.30 (d,J=8.4 Hz,2H,H-2′/H-6′),6.88~6.81 (d,J=8.4 Hz,2H,H-3′/H-5′),6.52(dd,J=8.7,2.2 Hz,1H,H-6),6.37 (d,J=2.2 Hz,1H,H-8),5.38 (dd,J=13.1,2.9 Hz,1H,H-2),3.07 (dd,J=17.0,2.9 Hz,1H,H-3a),2.70 (dd,J=17.0,2.9 Hz,1H,H-3b);13C NMR (100 MHz,Methanol-d4)δ:192.2 (s,C-4),165.4 (s,C-7),164.2 (s,C-9),157.6(s,C-4′),129.9 (s,C-1′),128.5 (d,C-5),127.6 (d,C-2′/C-6′),114.9 (d,C-3′/C-5′),113.6 (s,C-1′),110.4(d,C-6),102.4 (d,C-8),79.6 (d,C-2),43.5 (t,C-3).以上数据与文献[15]对比,鉴定为甘草苷元.
化合物7:白色粉末,C15H14O6.m.p.235~236 ℃;1H NMR (600 MHz,Methanol-d4)δ: 6.97 (d,J=1.9 Hz,1H,H-2′),6.79 (dd,J=8.1,2.0 Hz,1H,H-6′),6.75 (d,J=8.1 Hz,1H,H-5′),5.94 (d,J=2.0 Hz,1H,H-8),5.91 (d,J=2.0 Hz,1H,H-8),4.81 (s,1H,H-2),4.17 (d,J=4.1 Hz,1H,H-3),2.86 (dd,J=16.7,4.6 Hz,1H,H-4a),2.73 (dd,J=16.8,3.0 Hz,1H,H-4b);13C NMR (150 MHz,Methanol-d4)δ: 156.6 (s,C-7),156.3 (s,C-5),156.0 (s,C-9),144.6 (s,C-4′),144.4(s,C-3′),130.9 (s,C-1′),118.0 (d,C-5′),114.5 (d,C-6′),114.0 (d,C-2′),98.7 (s,C-10),95.1 (d,C-6),94.5 (d,C-8),78.5 (d,C-2),66.1 (d,C-3),27.9 (t,C-4).以上数据与文献[16]对比基本相同,因此鉴定为表儿茶素.
化合物8:白色粉末,C15H14O6.m.p.213~214 ℃;1H NMR (400 MHz,Acetone-d6)δ: 8.34 (s,1H,5-OH),8.15 (s,1H,7-OH),8.01 (s,2H,3′-OH/4′-OH),6.91 (d,J=1.9 Hz,1H,H-2′),6.83-6.75 (dd,J=8.1,2.0 Hz,2H,H-6′/H-4a),6.04 (d,J=8.1 Hz,1H,H-5′),5.89 (d,J=2.3 Hz,1H,H-8),4.58 (d,J=7.7 Hz,1H,H-2),4.09 (d,J=4.8 Hz,1H,H-3),2.93 (dd,J=16.1,5.5 Hz,1H,H-10),2.55 (dd,J=16.1,8.4 Hz,1H,H-4b);13C NMR (100 MHz,Acetone-d6)δ: 156.8(s,C-5),156.3 (s,C-7),156.0 (s,C-9),144.8 (s,C-4′),144.8 (s,C-3′),131.2 (s,C-1′),119.2 (d,C-6′),114.8 (d,C-5′),114.4 (d,C-2′),99.7 (s,C-10),95.3(d,C-6),94.5 (d,C-8),81.8 (d,C-2),67.5 (d,C-3),27.9 (t,C-4).以上数据与文献[16]对比,数据与儿茶素基本相同,鉴定为儿茶素.
化合物9:黄色粉末,C15H12O4.m.p.197~198 ℃;1H NMR (600 MHz,Acetone-d6)δ: 13.53 (s,1H,4-OH),9.18 (s,2H,4′-OH/6′-OH),7.99 (d,J=8.9 Hz,1H,H-2′),7.71 (d,J=15.3 Hz,1H,H-β),7.62 (d,J=15.3 Hz,1H,H-α),7.62~7.59 (d,J=8.2 Hz,2H,H-2/H-6),6.83~6.78 (d,J=8.2 Hz,2H,H-3/H-5),6.34(dd,J=8.9,2.4 Hz,1H,H-3′),6.25 (d,J=2.4 Hz,1H,H-5′);13C NMR (150 MHz,Acetone-d6)δ: 192.0 (s,C=O),166.7 (s,C-4′),164.7 (s,C-2′),160.2 (s,C-4),144.3 (d,C-β),132.4 (d,C-6′),130.9 (d,C-2/C-6),126.7 (s,C-1),117.4 (d,C-α),115.9 (d,C-3/C-5),113.6 (s,C-1′),107.8 (d,C-5′),102.9 (d,C-3′).以上数据与文献[17]中异甘草苷元对比基本一致,鉴定为异甘草苷元.
化合物10:黄色粉末,C15H14O5.m.p.262~263℃;1H NMR (600 MHz,Methanol-d4)δ: 7.09~7.02(d,J=8.2 Hz,2H,H-2/H-6),6.75~6.69 (d,J=8.2 Hz,2H,H-3/H-5),5.83 (d,J=2.1 Hz,2H,H-3′/H-5′),3.31~3.25 (t,J=7.9 Hz,2H,H-β),2.85 (t,J=7.9 Hz,2H,H-α);13C NMR (150 MHz,Methanol-d4)δ: 205.1(s,C=O),164.7 (s,C-2′),164.4 (s,C-4′/C-6′),155.0(s,C-4),132.7 (s,C-1),128.9 (d,C-2/C-6),114.7(d,C-3/C-5),104.0 (s,C-1′),94.4 d,C-3′/C-5′,45.9(t,C-α),30.1 (t,C-β).以上数据经过与文献[18]对比,鉴定为根皮素.
化合物11:白色粉末,C21H24O10.m.p.107~108 ℃;1H NMR (400 MHz,Methanol-d4)δ: 7.12~7.05 (d,J=7.6 Hz,2H,H-3′/H-5′),6.75~6.68 (d,J=7.6 Hz,2H,H-2′/H-6′),6.20 (d,J=2.2 Hz,1H,H-5),5.98 (d,J=2.2 Hz,1H,H-3),5.06 (d,J=7.1 Hz,1H,H-1′),3.93 (dd,J=12.1,2.0 Hz,1H,H-αa),3.74(dd,J=12.1,5.3 Hz,1H,H-αb),3.55~3.30 (m,6H,H-2′/H-3′/H-4′/H-5′/H-6′),2.90 (t,J=7.6 Hz,2H,H-β);13C NMR (100 MHz,MeOD)δ:205.2 (s,C=O),166.1 (s,C-2),164.5 (s,C-4),160.9 (s,C-6),154.9(s,C-4′),132.5 (s,C-1′),129.0 (d,C-2′/C-6′),114.7(d,C-3′/C-5′),105.4 (s,C-1),100.7 (d,C-1′),97.0(d,C-3),94.1 (d,C-5),77.1 (d,C-3′),77.0 (d,C-5′),73.3 (d,C-2′),69.7 (d,C-4′),61.0 (t,C-6′),45.6 (t,C-α),29.4 (t,C-β).以上数据与文献[18]对比,鉴定为根皮苷.
化合物12:白色粉末,C22H26O6.m.p.223~224 ℃;1H NMR (400 MHz,Methanol-d4)δ: 7.38 (d,J=8.6 Hz,2H,H-2/H-6′),7.04 (d,J=16.3 Hz,1H,Hβ),6.87 (d,J=16.3 Hz,1H,H-α),6.83~6.77 (m,3H,H-3′/H-5′/H-2),6.64 (t,J=1.8 Hz,1H,H-6),6.48 (t,J=2.2 Hz,1H,H-4),3.95 (dd,J=12.0,2.1 Hz,1H,H-1′),3.78~3.71 (m,1H,H-6′a),3.54~3.31 (m,5H,H-2′/H-3′/H-4′/H-5′/H-6′b);13C NMR (100 MHz,Methanol-d4)δ: 159.05 (s,C-3),158.2 (s,C-5),157.0 (s,C-4′),140.0 (s,C-1),128.9 (s,C-1′),128.6(d,C-8),127.5 (d,C-2′/C-6′),125.3 (d,C-7),115.1(d,C-3′/C-5′),107.0 (d,C-6),105.7 (d,C-4),102.7(d,C-2),101.0 (d,C-1′),76.8 (d,C-5′),76.6 (d,C-3′),73.6 (d,C-2′),70.1 (d,C-4′),61.2 (t,C-6′).以上数据与文献[19]对比,鉴定为反式白藜芦醇-3-O-β-D-吡喃葡萄糖苷.
化合物13:白色粉末,C18H18O2.m.p.102~103℃;1H NMR (400 MHz,Methanol-d4)δ: 7.11~6.95(d,J=8.4 Hz,4H,H-4/H-4′/H-6/H-6′),6.89 (t,J=8.4 Hz,2H,H-3/H-3′),6.07~5.87 (m,2H,H-8/H-8′),5.10~4.77 (m,6H,H-9/H-9′/H-7a/H-7′b),3.34 (m,2H,H-7b/H-7′b);13C NMR (100 MHz,Methanol-d4)δ: 151.9 (s,C-2/C-2′),138.0 (d,C-8/C-8′),131.8 (s,C-5/C-5′),131.3 (d,C-6/C-6′),128.4 (d,C-4/C-4′),126.3 (s,C-1/C-1′),116.0 (d,C-3/C-3′),114.2 (t,C-9/C-9′),39.1 (t,C-7/C-7′).以上数据与文献[20]对比,鉴定为厚朴酚.
4 抗肿瘤活性测试
4.1 细胞培养
4.1.1 细胞复苏 ①快速从液氮罐中把冻存管取出,立即转入37 ℃水浴锅中;②用纸擦干冻存管表面的水滴并用酒精消毒后移至超净工作台中;③用无菌吸管将细胞悬液移至15 mL 离心管内,1 500 r/min 离心5 min,取出离心管,弃上层冻存液;④ 加入1 mL 培养基轻轻重悬细胞,将细胞悬液转移至100 mm 细胞培养皿中,再加入9 mL 完全培养基;⑤ 按十字交叉法将细胞摇晃均匀,培养皿上标记细胞类型、操作者、时间,放入37 ℃、5% CO2培养箱进行培养;⑥细胞培养24 h 以后,在倒置显微镜下观察细胞形态,若悬浮细胞较多的话可以进行细胞换液,用巴氏管吸取PBS 缓冲液清洗细胞,更换新鲜培养基继续培养.
4.1.2 细胞传代 ①待细胞生长至覆盖培养皿底部80%~90%,即可传代;②提前把传代用到的完全培养基、PBS 缓冲液、胰酶放入水浴锅预热5 min,用纸擦干瓶子表面的水滴并用酒精消毒后移至超净工作台中,待用;③取原代细胞入超净工作台,吸掉原培养基,用巴氏管吸取4 mL PBS 缓冲液清洗细胞,吸掉PBS 缓冲液;④加入2 mL 胰蛋白酶消化细胞,消化2 min后,用移液枪吹打细胞,当全部细胞被吹吸下来以后,再用枪头吹打底部细胞数次(防止细胞聚集)使细胞悬浮,加入4 mL 的完全培养基终止消化(V(胰酶)∶V(培养基)=1∶2),用枪吹匀;⑤ 取用新的培养皿标注上细胞名称、日期、姓名,用枪吸取1mL 细胞悬液于新培养皿,加入9 mL 新鲜完全培养基(1∶6 传代)或用枪吸取2 mL 细胞悬液于新培养皿,加入8 mL 新鲜完全培养基(1∶3 传代)或用枪吸取3 mL 细胞悬液于新培养皿,加入7 mL 新鲜完全培养基传代,一般至少传2 皿备用,按十字交叉法轻轻将细胞摇晃均匀,放入培养箱中,常规方法进行培养.
4.1.3 细胞冻存 ①把用胰酶消化过的细胞用巴氏管吸进15 mL 离心管中,1 500 r/min 离心5 min使细胞沉淀;②弃上清液后,加入适量的细胞冻存液悬浮细胞,用巴氏管将细胞吹匀,分装至灭菌的2 mL 冻存管中,于冻存管壁标注细胞种类、冻存日期;③置于–80 ℃冰箱冻存过夜后,再移至液氮罐中长期保存.
4.2 细胞活力测定
(1)4 mL PBS 缓冲液清洗细胞,2 mL 胰酶消化,4 mL 完全培养基中止,滴加10 μL 在计数板上计数,MCF-7 和HCT-116 细胞以5×103个/孔的浓度接种在96 孔板中,放置培养箱中培养24 h;
(2)按细胞加药的方法配置各种浓度的化合物4 和13 及阳性对照物顺铂(cisplatin)(0,4,8,16,32,64 μmol/L),处理细胞 24 h.根据制造商的说明书使用CCK-8 试剂盒评估细胞活力.将CCK-8 溶液(10 μL)加入每个孔中并在37 ℃下在黑暗中温育1.5 h.在酶标仪上以450 nm 吸光度读取光密度(OD).
4.3 结论我们对分离得到的13 个化合物,进行了抗肿瘤活性筛选.实验结果显示,化合物4 和13对MCF-7 和HCT-116 细胞株,显示了一定的抑制活性.见表1.
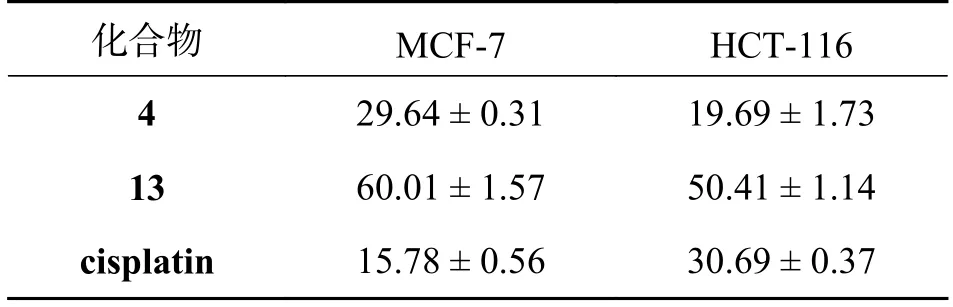
表1 化合物的IC50 (μmol/L)
5 讨论
本实验从云南产鼎湖血桐的枝叶中分离鉴定了13 个酚性成分,均为首次在该植物中分离得到,没有得到该属植物中报道较多的异戊烯基取代的黄酮类结构,说明不同产地和不同采集部位的植物,在化学成分方面也会存在差异,可以为该属植物的化学分类学研究提供一定的理论支持.通过抗肿瘤活性筛选,化合物4 和13 显示了一定的抗肿瘤活性,丰富了该属植物的药理活性研究内容.
