不同晶面暴露的WO3 纳米材料的制备及光催化性能
2022-11-28杜意恩牛宪军霍震苗玉茹
杜意恩,牛宪军,霍震,苗玉茹
(晋中学院 化学化工系,山西 晋中 030619)
随着经济的迅速发展和人口的快速增长,日益严重的环境污染和持续枯竭的化石燃料成为世界各国政府面临的紧迫问题.因此,开发无污染的环境修复技术和寻找可替代的绿色能源是解决这些问题的关键[1].半导体光催化剂由于在光催化氧化有机污染物、分解水和气体传感等方面的潜在应用价值受到世界各国的关注.TiO2、ZnO、α-Fe2O3、BiVO4和WO3都是广泛应用的光催化剂,其中,WO3是一种具有典型5d0电子结构的n 型窄带隙(2.4~2.8 eV)半导体氧化物,具有无毒、理化性质稳定、光敏性良好、电子传递性能优良、光催化活性高等优点,在光催化剂、气体传感器以及光致变色器件等领域具有潜在的应用[2-3].近年来,为提高WO3的光催化性能,研究者做出了巨大努力,如制备成大孔/介孔结构[4]、晶体表面修饰[5]、进行金属和非金属掺杂[6]等.目前,制备形貌、晶面可控的WO3材料成为研究的热点[7-8].对于单斜WO3,其平均表面能由低到高的顺序为{200}晶面(1.43 J/m2)<{020}晶 面(1.54 J/m2)<{002}晶 面(1.56 J/m2)[9].D'Arienzo等[10]指出单斜晶系WO3(020)/(002)晶面的共暴露可以为氨氧化提供特殊的反应位点,从而有利于提高其传感性能.Li等[11]发现,正交晶系WO3·nH2O {020}晶面的暴露程度与光催化活性的测定结果有很好的相关性.Jia等[12]指出,暴露{002}晶面的六方晶系WO3样品比暴露{200}晶面的六方晶系WO3样品对丙酮具有更好的敏感性和选择性.Han 等[13]在酒石酸的辅助下,通过简单的水热路线合成了共暴露{001}/{100/{010}晶面的三斜晶系WO3纳米颗粒,研究发现,{010}晶面对正丁胺有更好的气体传感性能.Zhang等[14]以H2WO4为钨源,以三乙胺为结构导向剂,采用水热法制备了暴露{100}晶面的m-WO3晶体,研究发现,该晶体能够显著增强光解水和光催化氧化2-丙醇的活性.Qiu等[15]以Na2WO4·2H2O 为原料,H2C2O4为结构导向剂,采用结合H2-还原路线化学浴沉积法制备了具有特定氧空位的分层WO3微花,研究发现,该WO3微花在可见光照射下对罗丹明B 和甲基橙具有显著的光催化活性.郭晨鹏等[16]以Na2WO4·2H2O 为原料,H2C2O4为结构导向剂,通过水热法制备了暴露{002}晶面的WO3纳米片薄膜,研究发现,H2C2O4用量对所合成的WO3纳米片薄膜的晶体取向、形貌尺寸和光电催化性能具有重要的影响.如上所述,WO3的很多性质强烈依赖于其暴露晶面.同时,暴露晶面也与其所归属的晶系有着密切的关系.然而,WO3的光催化活性与晶体的暴露晶面和晶系依赖性尚未得到很好的研究.因此,合成具有特定暴露晶面和晶系的WO3晶体十分必要.
本文采用水热法制备了不同形貌、不同晶面共暴露的六方晶系WO3·0.33H2O 和单斜WO3纳米材料,对其晶体结构、形貌、光学性质、光生电子-空穴的迁移和重组速率等性能进行表征,通过降解对硝基苯酚溶液评价了其光催化性能.
1 实验部分
1.1 试剂与仪器试剂:二水合钨酸钠(上海麦克林生化科技有限公司)、盐酸、对硝基苯酚(天津市大茂化学试剂厂)、硼氢化钠(天津希恩斯生化科技有限公司)、乙酸、过氧化氢(天津市凯通化学试剂有限公司)、氢氟酸(天津市北辰方正试剂厂)、氟化铵(天津市博迪化工有限公司)、WO3(上海试剂二厂,标记为CM-WO3).所有试剂均为分析纯.
仪器:电子天平(FB224型,上海舜宇恒平科学仪器有限公司)、电热恒温鼓风干燥箱(HGZE–Ⅱ/H–101–1型,上海跃进医疗器械有限公司)、磁力加热搅拌器(HJ–4型,金坛市城西峥嵘实验仪器厂)、箱式高温烧结炉(KSL–1400X–A1型,合肥科晶材料技术有限公司)、超声波清洗器(SB–3200DTDN型,宁波新艺生物科技股份有限公司)、紫外可见分光光度计(TU–1901型,北京普析通用仪器有限责任公司)、高速台式离心机(SC–3616型,湘仪离心机仪器有限公司)、紫外线UV 固化灯(A–250型,上海铭耀玻璃五金工具厂)、循环水真空泵(SHZ–D(Ⅲ)型,河南巩义市予华仪器有限责任公司)、X 射线粉末衍射仪(XRD,XRD–6100型,日本岛津株式会社)、场发射扫描电子显微镜(FESEM,REGULUS–8100型,日本日立高新技术株式会社)、透射电子显微镜(TEM,JEM–2100F型,日本JEOL 株式会社)、荧光光谱仪(PL,HORIBA FlUOROMAX–4型,美国HORIBA 科学仪器事业部(Jobin Yvon 光谱技术)堀场)、电化学阻抗谱分析仪(EIS,CHI660E,上海辰华仪器有限公司).
1.2 制备过程根据化学反应Na2WO4·2H2O+2HCl=H2WO4·H2O+2NaCl+H2O,通过质子交换法制备钨酸.量取167 mL 12.0 mol/L 的浓盐酸(35%~37%),配制成2.0 L 1.0 mol/L 稀盐酸溶液,放入3.0 L 大烧杯中,向其中加入20.60 g 二水合钨酸钠(Na2WO4·2H2O),放入搅拌子,杯口包一层保鲜膜,置于磁力加热搅拌器上搅拌24 h,然后取出搅拌子,静置24 h,倒掉上层澄清液.重新配制2.0 L1.0 mol/L 稀盐酸加入到该烧杯中.重复上述步骤3 次.将静置后的溶液抽滤,室温干燥后得到黄绿色钨酸固体粉末.分别准确称量2.0 g 黄绿色钨酸粉末加入4 个标号分别为1#、2#、3#、4#的反应釜中,向其中各加入50 mL水,然后依次加入5 mL 氢氟酸、5 mL乙酸、5 mL 双氧水、1.0 g 氟化铵,搅拌2 h,密封,放入电热恒温鼓风干燥箱中于180 ℃下加热反应24 h.待其完全冷却后,进行抽滤、干燥,得到不同颜色的WO3.其中1#反应釜得到淡墨绿色固体粉末(标记为HF-WO3),2#反应釜得到淡黄色固体粉末(标记为HAc-WO3),3#反应釜得到黄白色固体粉末(标记为H2O2-WO3),4#反应釜得到淡黄色固体粉末(标记为NH4F-WO3).
1.3 光催化性能测试分别称量0.020 8 g 对硝基苯酚(C6H5NO3)和0.007 2 g 硼氢化钠(NaBH4)倒于1 个烧杯中,加水搅拌使其完全溶解,将溶液转移到容积为2.0 L 的容量瓶中,然后洗涤烧杯和玻璃棒,洗液一并倒入容量瓶,加入去离子水至容量瓶刻度线,定容,反复振荡至溶液均匀后,静置备用.称量0.150 0 g HF-WO3样品于烧杯中,向其中加入150 mL 标准溶液,放置于磁力搅拌器上搅拌30 min,用胶头滴管从烧杯中取出3 mL 悬浮液加入离心管,然后将烧杯放入紫外线光照箱中,进行光催化实验,每隔15 min 取3 mL 上层悬浮液,离心分离,得到的溶液记作HF-WO3组;用HAc-WO3、H2O2-WO3、NH4F-WO3和CM-WO3样品依次重复以上步骤,分别记作HAc-WO3组、H2O2-WO3组、NH4F-WO3组和CM-WO3组.光照前后对硝基苯酚溶液的浓度通过使用UV-1901 型分光光度计测定其在波长为400 nm 左右的吸光度确定.降解速率由光催化实验前后对硝基苯酚溶液的浓度变化确定:

式中,co是搅拌结束光照开始前对硝基苯酚溶液浓度,ct是光照一段时间后对硝基苯酚溶液浓度.
2 结果与讨论
2.1 XRD表征Na2WO4·2H2O 原料及质子交换后的H2WO4·H2O 前驱体的X 射线衍射图谱如图1所示.从图1(a)中可以看出,在2θ为12.92º、16.96º、25.86º、27.76º、29.24º、32.64º、39.12º、41.49º、48.96º、52.12º和54.86º处的衍射峰与标准卡47-0064 的特征衍射峰一致,分别对应于Na2WO4·2H2O(正交晶系,Pbca空间群,a=0.105 92 nm、b=0.138 58 nm、c=0.847 90 nm、β=90º)的(020)、(200)、(040)、(231)、(141)、(241)、(060)、(161)、(423)、(362)和(181)晶面.其中,从图1(b)中可以看出,质子交换后衍射峰的强度显著减小,这是由于质子交换后结晶度减小造成的,在2θ为12.92º、23.78º、24.22º、25.90º、27.12º、27.48º、34.02º和39.28º处的衍射峰与标准卡18-1420 的特征衍射峰一致,分别对应于H2WO4·H2O(单斜晶系,P2/m空间群,a=0.750 nm、b=0.693 nm、c=0.370 nm、β=90º)的(010)、(200)、(001)、(020)、(101)、(011)、(-201)和(030)晶面,而在2θ=16.96º的特征衍射峰消失了[与图1(a)对比],这是由于Na+被H+置换后晶系发生变化所致.由图1 可以看出,H2WO4·H2O (010)、(020)和(030)晶面的晶面间距(0.685、0.344 和0.229 nm)与Na2WO4·2H2O (020)、(040)和(060)晶面的晶面间距(0.685、0.344 和0.230 nm)几乎完全相同,表明质子交换后没有破坏化合物的层状结构.

图1 (a) Na2WO4·2H2O 和(b) H2WO4·H2O 的X 射线衍射图谱Fig.1 XRD patterns of (a) Na2WO4·2H2O and (b)H2WO4·H2O samples
图2 是在不同形貌控制剂存在时合成的WO3样品和商业化的WO3样品的XRD 图谱.图2(a)是H2O2-WO3样品的XRD 图谱,在2θ为14.10°、22.92°、24.44°、26.96°、28.30°、33.74°、36.70°、44.60°、55.04°、55.72°、57.74°和58.52°处的特征峰,分别对应于六方晶系WO3·0.33H2O 的(100)、(001)、(110)、(101)、(200)、(111)、(201)、(211)、(220)、(221)、(311)和(400)晶面(PDF No.35-1001),而在2θ为23.18°、23.70°、24.44°、26.68°、28.88°、33.32°、34.24°、35.73°、41.98°、44.84°、47.34°、48.43°、50.04°和56.01°处的衍射峰分别对应于单斜晶系WO3样品的(002)、(020)、(200)、(120)、(112)、(022)、(202)、(122)、(222)、(123)、(004)、(040)、(140)和(420)晶面(PDF No.43-1035),除此之外,在2θ为38.30°处还观察到1 个明显的衍射峰,对应于单斜晶系WO2的(131)晶面(PDF No.32-1393).如图2(b)所示,HAc-WO3样品与图2(a)中H2O2-WO3样品的XRD 图谱相似,但对应于WO3·0.33H2O (100)、(200)、(201)和(211)晶面的衍射峰的强度明显减弱,表明颗粒尺寸减小.综上分析,当以H2O2和HAc 为控制剂时,所制备的WO3是六方晶系WO3·0.33H2O、单斜晶系WO3以及少量单斜晶系WO2的混合晶体.从图2(c),(d)可以看出,当以HF 和NH4F 为控制剂时,制备的是单斜晶系WO3(含微量的WO2),表明控制剂对合成的WO3晶系具有重要的影响.图2(e)是商业化的WO3样品,为纯的单斜晶系WO3.

图2 样品的XRD 图谱Fig.2 XRD patterns of samples
2.2 FESEM 和TEM 分析原料Na2WO4·2H2O、前驱体H2WO4·H2O 以及添加不同形貌控制剂所合成的WO3样品的FESEM 图像如图3 所示.从图3(a)中可以看出Na2WO4·2H2O 是由长短不均一的棒状晶体(长:0.61~3.07 μm,宽:0.41~0.91 μm)、方块状晶体(长:1.00~1.64 μm,宽:0.63~1.11 μm)以及其他一些不规则的颗粒组成的.经过质子交换后生成的钨酸形貌发生了变化[图3(b)],除了少数的方块状晶体外,还有很多不规则的大颗粒和纳米颗粒,这是由于质子交换过程中晶体结构发生了变化.
在添加了不同形貌控制剂后生成的4 种WO3样品中,HF-WO3样品呈现棒状(长:0.29~0.55 μm,宽:0.08~0.18 μm)、方块状(长:0.46~0.89 μm,宽:0.20~0.50 μm)以及一些不规则的块状结构[图3(c)];HAc-WO3样品主要是由方板状晶体(长:0.32~0.56 μm,宽:0.07~0.18 μm,厚:21.79~41.26 nm)、方块状晶体(长:0.34~0.70 μm,宽:0.22~0.36 μm)以及很多小的纳米颗粒组成[图3(d)];添加过氧化氢溶液生成的H2O2-WO3样品的形貌主要是由长短不一的方棒状晶体(长:0.40~1.61 μm,宽:0.07~0.40 μm)和方块状晶体(长:0.18~1.67 μm,宽:0.12~1.01 μm)组成[图3(e)];添加氟化铵生成的NH4F-WO3样品形貌主要是由方板状晶体(长:0.36~0.91 μm,宽:0.14~0.52 μm,厚:33.62~68.26 nm)组成.

图3 样品的扫描电镜图像Fig.3 FESEM images of samples
利用能谱仪测定的H2WO4和不同WO3样品的能谱分析如表1 所示.从表1 中可以看出,质子交换制备的H2WO4中,除含有W 和O 两种元素外,还含有少量的Na(0.554%)元素,说明通过3 次质子交换后,Na2WO4中的Na+并未被完全置换出来.所合成的HF-WO3、HAc-WO3、NH4F-WO3样品中,除有W、O、Na 三种元素外,还含有少量分别来自形貌控制剂HF 的F 元素(0.168%)、CH3COOH的C 元素(0.742%)以及NH4F 的N 元素(0.397%)和F 元素(0.086%).而H2O2-WO3样品中,由于形貌控制剂是H2O2,因此,除了W、O、Na 三种元素外,没有其他元素存在.上述分析表明,在水热反应过程中,形貌控制的种类对合成WO3样品的元素含量具有一定影响.

表1 利用能谱仪测定的H2WO4 和各种WO3 样品中各元素的原子分数Tab.1 The atomic fraction of each element in H2WO4 and different WO3 samples was determined by energy dispersive analysis spectrometer %
应用TEM 图像进一步分析了所制备的WO3的微观结构.TEM 图像显示了与FESEM 图像相似的形貌,如图4 所示.从图4(a)可以看出,在方块状晶体的上表面观察到晶面间距值分别为0.260 nm和0.380 nm 的两组晶格条纹,二者之间的夹角为46°,与热力学稳定的单斜晶系WO3(202)晶面和(002)晶面以及二者之间的夹角吻合得较好.从图4(b)可以看出,在方块状晶体的上表面观察到晶面间距值分别为0.260 nm 和0.360 nm 的两组晶格条纹,对应于单斜晶系WO3的(202)晶面和(200)晶面,且二者之间的夹角为43°,与理论值相符.上述分析表明,当以HF 为形貌控制剂时所制备的方块状HFWO3晶体的上下表面暴露的主要是{020}晶面.从图4(c),(d)可以看出,当以HAc 为形貌控制剂,在制备的方板状晶体的上表面可以观察到晶面间距分别为0.362 nm 和0.362 nm(或0.364 nm 和0.364 nm)的两组晶格条纹,对应于六方晶系WO3·0.33H2O的(110)晶面和(-110)晶面,且二者之间的夹角为90°,与理论值符合,由于两组晶格条纹分别平行于方板状晶体的侧面,因此,方板状HAc-WO3晶体的四个侧面和上下表面暴露的晶面分别是{110}晶面和{002}晶面.从图4(e),(f)可以看出,当以H2O2为形貌控制剂,所制备的长方体晶体的暴露晶面与HAc 为形貌控制剂制备的长方体晶体的暴露晶面相似,即共暴露{110}晶面和{002}晶面.图4(g)~(i)是以NH4F 为形貌控制剂时所制备的WO3样品的TEM 图像.从图4(g)可以看出,所制备的NH4FWO3样品的形貌也主要是方板状.从图4(h),(i)中可以看出,在方板状晶体的上表面观察到晶面间距为0.360 nm 和0.380 nm 的两组晶格条纹,分别对应于单斜晶系WO3样品的(200)晶面和(002)晶面,且二者之间的夹角为90°,表明其上表面暴露的是{020}晶面.由于上述两组晶格条纹分别平行于方板状晶体的侧面,因此,方板状NH4F-WO3晶体的四个侧面和上下表面暴露的晶面分别是{200}、{002}和{020}晶面.

图4 样品的TEM 图像Fig.4 TEM images of samples

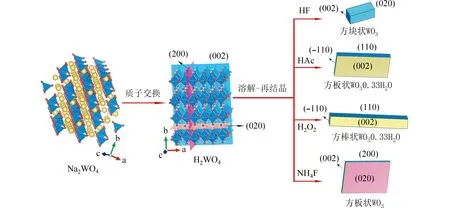
图5 从钨酸钠到WO3 的转变反应机理Fig.5 Transformation reaction mechanism from sodiumtungstate to WO3 nanocrystals.

首先,层状H2WO4沿着(200)、(020)和(002)晶面分裂,形成 [WO6]6-八面体单体.然后,生成的[WO6]6-八面体单体沿着不同的晶面发生再结晶反应,形成不同形貌的晶体.在HF 存在条件下,[WO6]6-八面体单体主要沿着 [020]和[002]方向生长,形成共暴露{020}/{002}晶面的方块状WO3晶体.在HAc 和H2O2存在下,[WO6]6-八面体单体主要沿着[110]和[-110]方向生长,形成共暴露{110}/{002}晶面的方板状和方棒状WO3·0.33H2O晶体,晶体的形貌不同是由[WO6]6-八面体在不同方向生长的快慢不同造成的.在NH4F 存在下,[WO6]6-八面体单体主要沿着[002]和[200]方向生长,形成共暴露{200}/{002}/{020}晶面的方板状WO3晶体.
2.4 光致发光光谱分析半导体的光致发光强度与光催化剂中载流子(电子和空穴)的复合率有关,一般来说,光致发光强度越高说明载流子的复合率越高,光致发光强度越低说明载流子的复合率越低[17-18].图6 为制备的HF-WO3、HAc-WO3、H2O2-WO3和NH4F-WO3样品在370 nm 激发下的光致发光光谱,可以看出,所有样品的光致发光光谱曲线基本一样,且WO3样品的稳态荧光光谱在447、468、481、491 nm 和556 nm 处有强烈的发射峰,与文献[19]报道的结果一致.在447 nm 处的第1 个发射峰归因于WO3带-带光致发光过程中的发射,而其他的发射峰归因于迁移到WO3表面的载流子的强烈重组.从图6 中还可以看出,不同形貌控制剂并不影响WO3光谱的峰位,但明显影响光致发光光谱峰的相对强弱.可以看出,光致发光光谱强度增加的顺序为HAc-WO3>HF-WO3>H2O2-WO3>NH4F-WO3.NH4F-WO3的光致发光强度最低,表明{200}/{002}/{020}晶面共存有利于抑制光生电子-光生空穴的复合,从而有利于光催化性能的提高.
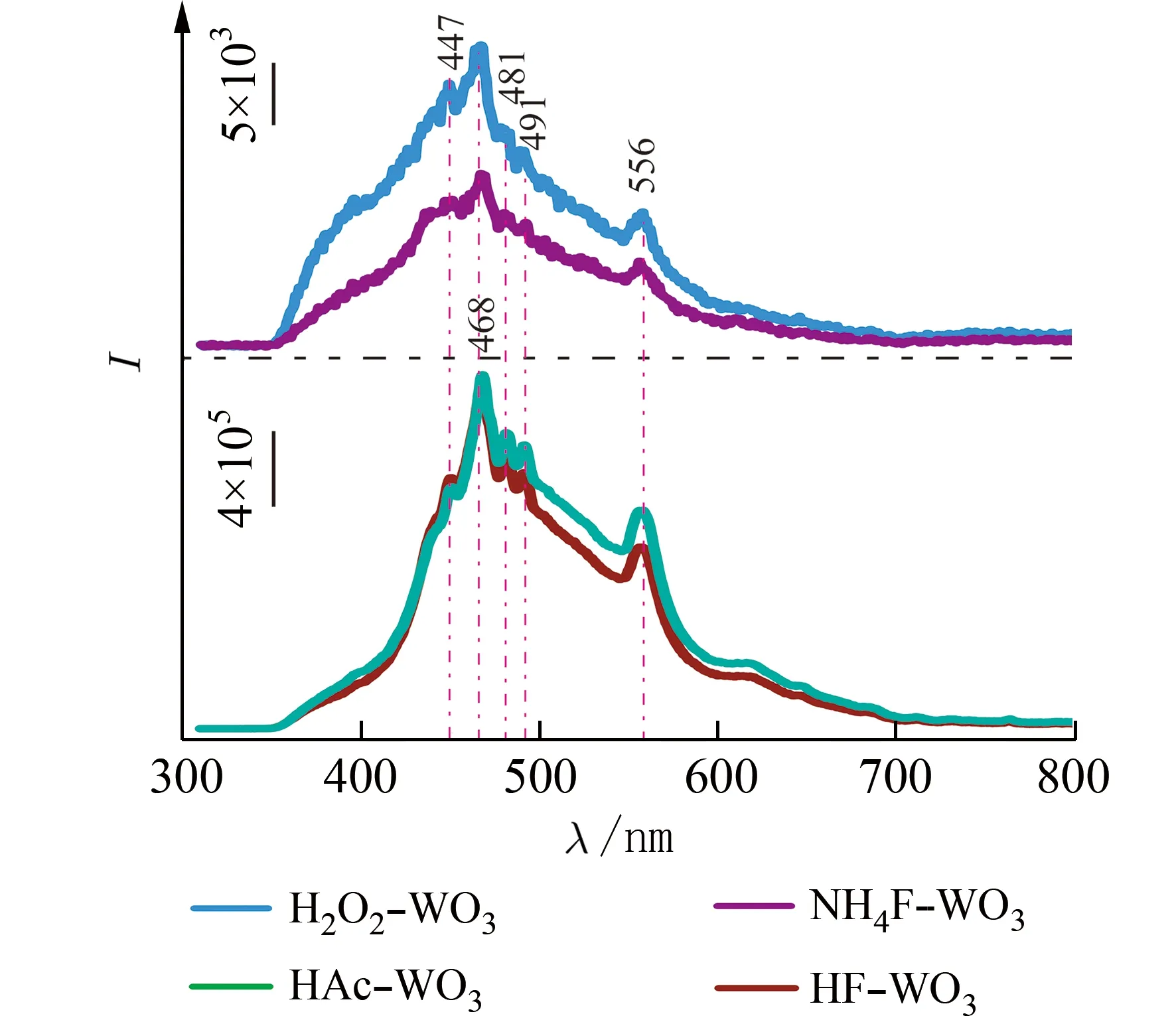
图6 HF-WO3、HAc-WO3、H2O2-WO3 和NH4F-WO3样品的光致发光光谱图Fig.6 Photoluminescence spectra of HF-WO3,HAc-WO3,H2O2-WO3 and NH4F-WO3 samples
2.5 电化学阻抗分析图7 是在0.1 Hz~0.1 MHz频率范围内,交流振幅为0.01 V 时得到的不同WO3样品的Nyquist 谱图.从图7 中可以看出,NH4F-WO3样品的阻抗环半径明显低于HF-WO3、HAc-WO3和H2O2-WO3,意味着NH4F-WO3样品的电荷迁移电阻最小,表明在紫外光照射的条件下NH4F-WO3有更优异的光电响应和电荷转移速率,并能有效抑制光生载流子的复合,从而有利于促进光催化反应[20].与NH4F-WO3相比,HF-WO3、HAc-WO3和H2O2-WO3)的Nyquist 谱图呈现相似的变化趋势,并且在高频率下没有呈现半圆形,表明其电子–空穴分离效率较低.

图7 HF-WO3、HAc-WO3、H2O2-WO3 和NH4F-WO3样品的Nyquist 谱图Fig.7 Nyquist spectra of HF-WO3,HAc-WO3,H2O2-WO3 and NH4F-WO3 samples
2.6 光催化性能分析通过测定紫外线照射下对硝基苯酚溶液(λmax=400 nm)的降解情况,比较了HF-WO3、HAc-WO3、H2O2-WO3、NH4F-TiO2和CM-WO3样品的光催化性能.图8(a)为在紫外光照射下对硝基苯酚溶液(特征吸收波长400 nm)的降解率随时间的变化曲线图.从图8(a)中可以看出,在光照射120 min时,对硝基苯酚溶液降解率增加的顺序为空白 (4.9%)<CM-WO3(36.6%)<HF-WO3(60.0%)<H2O2-WO3(60.9%)<HAc-WO3(62.8%)<NH4F-WO3(68.9%).即NH4F-WO3在光催化降解对硝基苯酚溶液时显示了最高的光催化活性,其降解效率分别是HAc-WO3、H2O2-WO3、HF-WO3、CM-WO3和空白样品的1.10、1.13、1.15、1.88 倍和14.06倍,降解的对硝基苯酚最终矿化为CO2和H2O[21].为了比较不同WO3样品上对硝基苯酚溶液降解的反应动力学,假定对硝基苯酚溶液的降解遵循Langmuir-Hinshelwood 一级动力学模型[22]:ln(c0/ct)=kt,其中k为表观一级速率常数,t为光辐射时间,根据此模型进行的线性模拟如图8(b)所示.由直线斜率可求得空白、CM-WO3、HF-WO3、H2O2-WO3、HAc-WO3和NH4F-WO3对对硝基苯酚溶液的降解速率常数分别为0.000 4、0.004 8、0.007 8、0.007 8、0.007 5 min-1和0.0111 min-1.显然,NH4F-WO3的降解速率常数最大,其降解速率常数分别是HAc-WO3、H2O2-WO3、HF-WO3、CMWO3和空白样品的1.48、1.42、1.42、2.31 倍和27.75倍.NH4F-WO3显示最高的光催化活性归因于{200}/{002}/{020}晶面共暴露的方板状结构在紫外线照射下能够抑制载流子的复合.此外,较低的光致发光强度和较小的阻抗环半径可以加速电解液与半导体界面处的电荷转移,抑制电子和空穴的复合,从而提高光催化活性[23].综上所述,所制备的WO3样品光催化活性增加的顺序为HF-WO3<H2O2-WO3<HAc-WO3<NH4F-WO3.

图8 HF-WO3、HAc-WO3、H2O2-WO3、NH4F-WO3、CM-WO3 和空白样品降解对硝基苯酚溶液的曲线图和动力学拟合曲线图Fig.8 Photocatalytic degradation and Kinetic fitting curves of degradation of p-nitrophenol aqueous solution by the samples of HF-WO3,HAc-WO3,H2O2-WO3,NH4F-WO3,CM-WO3 and blank,respectively
3 结论
本论文以Na2WO4·2H2O 为钨源,加入盐酸,进行质子交换,抽滤、干燥后得到层状H2WO4·H2O.然后以H2WO4·H2O 为前驱体,采用水热合成法,通过添加不同的形貌控制剂HF、HAc、H2O2和NH4F,合成了共暴露{020}/{002}晶面的方块状HF-WO3晶体、共暴露{110}/{002}晶面的方板状HAc-WO3·0.33H2O 和方棒状H2O2-WO3·0.33H2O晶体以及共暴露{200}/{002}/{020}晶面的方板状NH4FWO3晶体.研究结果表明,在紫外光照射120 min时,NH4F-WO3对对硝基苯酚溶液的降解效率最高(68.9%),分别是HAc-WO3、H2O2-WO3、HF-WO3、CM-WO3和空白样品的1.10、1.13、1.15、1.88 倍和14.06 倍.在光催化过程中,NH4F-WO3显示出最高的光催化活性,归因于其{200}/{002}/{020}晶面的共暴露、最低的光致发光强度、最快的电荷转移速率和最小的载流子复合率的协同作用.
