温阳振衰颗粒对肾间质纤维化模型大鼠细胞焦亡及肾间质纤维化的影响
2022-11-28袁轶峰蔡虎志王敏李琰欧阳过陈新宇
袁轶峰,蔡虎志,王敏,李琰,欧阳过,陈新宇
湖南中医药大学第一附属医院,湖南 长沙 410007
慢性肾脏病(chronic kidney disease,CKD)是各种原因引起慢性肾脏结构和功能障碍的临床综合征,日益成为世界范围内公认的公共卫生问题。慢性肾功能衰竭(chronic renal failure,CRF)是CKD进展至后期的共同结局,具有高患病率、高致残率特点[1]。目前尚缺乏有效延缓CRF进展的措施,导致CRF患者预后不良。肾脏纤维化是导致肾脏结构和功能受损的重要途径[2-4],抑制肾脏纤维化是延缓CRF进展的有效措施[5-6]。NOD 样受体蛋白3(NLRP3)/半胱氨酸蛋白酶-1(Caspase-1)通路介导的细胞焦亡在多种疾病中发挥重要作用[7-8]。温阳振衰颗粒由陈新宇教授根据多年临床经验拟定,课题组前期研究发现,温阳振衰颗粒可改善慢性肾功能衰竭患者肾纤维化[9]。本实验基于NLRP3/Caspase-1通路观察温阳振衰颗粒对肾间质纤维化大鼠细胞焦亡及肾脏纤维化的影响,进一步明确其治疗肾脏纤维化的作用机制。
1 材料与方法
1.1 动物
健康雄性SD大鼠50只,体质量(220±20)g,购于湖南斯莱克景达实验动物有限公司,动物许可证号SCXK(湘)2019-0004。饲养于湖南中医药大学第一附属医院动物房,温度22~26 ℃,湿度50%~60%,光暗周期12 h。自由摄食饮水。
1.2 药物
温阳振衰颗粒(制附片、干姜、茯苓、红参、麦冬、五味子、甘草以10∶10∶15∶6∶15∶10∶10比例配伍),由湖南中医药大学第一附属医院提供,8 g/袋,以生理盐水溶解,配制成浓度为0.072 g/mL溶液。
1.3 主要试剂与仪器
PBS(上海Wellbio,货号WB00001),NLRP3抑制剂MCC950(美国AbMole,货号M04359),苏木素(上海Wellbio,货号WB03008B),伊红(上海Wellbio,货号WB03008A),DAB试剂盒(北京中杉金桥,货号ZLI-9018),二步法试剂盒(北京中杉金桥,货号PV-9000),肌酐试剂盒(南京建成生物工程研究所,货号C011-2-1),尿素氮试剂盒(南京建成生物工程研究所,货号C013-2-1),Tris(德国Sigma,货号V900483),RIPA 裂解液(上海碧云天,货号P0013B),蛋白酶抑制剂(北京金泰宏达,货号583794),磷酸酶抑制剂(北京普利莱,货号P1260),显影液(上海佳信,货号BW-61),定影液(上海佳信,货号BW-62),Super ECL Plus超敏发光液(美国Advansta,货号K-12045-D50),反转录试剂盒(北京康为世纪,货号CW2569),Trizol(美国Thermo,货号15596026),Ultra SYBR Mixture(北京康为世纪,货号CW2601),FAM-YVAD-FMK(英国Abcam,货号ab219935),Caspase-1、白细胞介素(IL)-18、β-actin、转化生长因子(TGF)-β1、α-平滑肌肌动蛋白(α-SMA)、Ⅰ型胶原蛋白(Col-Ⅰ)抗体(美国Proteintech,货号分别为22915-1-AP、10663-1-AP、60008-1-Ig、21898-1-AP、55135-1-AP、66761-1-Ig),IL-1β 抗 体 ( 美 国 Invitrogen, 货 号 PA5-88078),NLRP3抗体(英国Abcam,货号ab214185),HRP-标记山羊抗小鼠IgG(美国Proteintech,货号SA00001-1),HRP 标记山羊抗兔IgG(美国Proteintech,货号SA00001-2)。YD-315切片机,浙江金华益迪试验器材;BMJ-A包埋机,常州中威电子仪器;BA210T显微镜,厦门Motic;H1650R台式冷冻离心机,湖南湘仪;DYY-6C电泳仪,北京六一;DYCZ-40D转膜仪,北京六一;BioPrep-24 生物样品均质仪,杭州奥盛;Chemiscope6100 化学发光成像系统,广州勤翔;Quant Studio1荧光定量RCP仪,美国Thermo。
1.4 分组、造模及给药
50只大鼠适应性饲养1周后按体质量分层,随机分为空白组、假手术组、模型组、抑制剂组和温阳振衰颗粒组,每组10只。参考文献[10]建立肾间质纤维化大鼠模型:腹腔注射10%水合氯醛(0.3 mL/100 g)麻醉大鼠,左中腹部切约1 cm纵向切口,钝性分离皮下组织及肌层,暴露左侧肾脏,游离左侧输尿管,穿线结扎并剪断左侧输尿管,逐层缝合切口。空白组不予处理,假手术组只暴露肾脏,游离左侧输尿管,不做结扎,其余操作相同。
各组分别于造模后次日给药,给药剂量参考人与大鼠体表面积折算,抑制剂组予1 mg/mL MCC950生理盐水溶液[20 mg/(kg·d)]腹腔注射,温阳振衰颗粒组予温阳振衰颗粒溶液1.44 g/(kg·d)灌胃,每日2次,模型组、假手术组灌胃等量生理盐水,连续14 d。
1.5 指标检测
1.5.1 血肌酐、血尿素氮含量
末次给药后禁食8 h,水合氯醛麻醉大鼠,腹主动脉取血3 mL,3 000 r/min离心15 min,收集血清,试剂盒检测血肌酐(SCr)、血尿素氮(BUN)含量。
1.5.2 肾组织病理观察
取血后摘取左肾,取部分肾组织置于10%中性福尔马林溶液中固定48 h,常规石蜡包埋,切片,HE和Masson染色观察组织病理变化及胶原纤维分布情况。
1.5.3 免疫组化检测
肾组织石蜡切片脱蜡、抗原修复后,滴加TGF-β1一抗(1∶200)、α-SMA一抗(1∶400)、Col-Ⅰ一抗(1∶200),4 ℃孵育过夜,滴加二抗,室温孵育1 h,DAB显色,苏木素复染,盐酸乙醇分化,脱水,透明,封片。光镜下观察,阳性染色为黄色至棕褐色,每张切片选取3个阳性表达区域拍照,采用Image Pro Plus 6.0软件计算阳性表达的平均光密度。
1.5.4 Western blot检测
取适量肾组织,加入RIPA 裂解液提取总蛋白,BCA法测定蛋白浓度,SDS-聚丙烯酰胺凝胶电泳,湿转法将蛋白转移至PVDF膜,将膜浸入5%脱脂奶粉-PBST溶液,室温封闭60 min,4 ℃过夜。加入NLRP3一抗(1∶1 000)、Caspase-1一抗(1∶1 000)、IL-18一抗(1∶2 000)、IL-1β 一抗(1∶2 000)、β-actin 一抗(1∶2 000),4 ℃孵育过夜,加入HRP标记山羊抗小鼠IgG(1∶6 000)、HRP标记山羊抗兔IgG(1∶6 000),室温孵育1 h,ECL化学发光法显影,凝胶成像仪测定蛋白灰度值,以目的蛋白灰度值与内参蛋白灰度值比值计算蛋白相对表达量。
1.5.5 RT-PCR检测
取少量肾组织,加入Trizol 充分研磨,提取总RNA,紫外分光光度计测定RNA浓度。以RNA为模板,反转录合成cDNA,SYBR法进行RT-qPCR实验。使用Primer Express 5.0 软件设计引物(见表1),以β-actin为内参,2-ΔΔCt法计算mRNA相对表达量。

表1 各基因PCR引物序列
1.5.6 细胞焦亡检测
肾组织石蜡切片经脱蜡、抗原修复后,滴加FAMYVAD-FMK(1∶50)荧光染料(绿色)、碘化丙啶(红色),37 ℃恒温箱孵育1 h,洗涤液冲洗3 min×3次;加入DAPI(蓝色),37 ℃染核10 min,PBS冲洗5 min×3次,缓冲甘油封片,荧光显微镜下观察细胞焦亡情况,蓝色为活细胞,焦亡细胞可见绿色+红色荧光,计算细胞焦亡率。细胞焦亡率(%)=阳性细胞数÷总细胞数×100%。
1.6 统计学方法
采用SPSS19.0和DPS14.1统计软件进行分析。计量资料用表示,多组间比较用方差分析,Levene检验方差齐性,方差齐用LSD 法,方差不齐用Tamhane"s T2法。P<0.05表示差异有统计学意义。
2 结果
2.1 造模情况
空白组及假手术组大鼠肾脏无肿胀,肾脏颜色有光泽,输尿管无扩张;模型组大鼠左侧肾脏肿大、颜色偏浅,左侧输尿管结扎处至肾脏扩张明显,左肾明显大于右肾,肾实质变薄;抑制剂组和温阳振衰颗粒组大鼠左侧肾脏肿胀程度较模型组减轻,左侧输尿管结扎处以上扩张。
2.2 温阳振衰颗粒对模型大鼠血肌酐、血尿素氮含量的影响
与假手术组比较,模型组大鼠SCr、BUN含量显著增加(P<0.01);与模型组比较,抑制剂组和温阳振衰颗粒组大鼠SCr、BUN 含量显著减少(P<0.01)。见表2。
表2 各组大鼠SCr、BUN含量比较()
表2 各组大鼠SCr、BUN含量比较()
注:与假手术组比较,△△P<0.01;与模型组比较,**P<0.01
BUN/(mmol/L)8.85±2.70 8.70±2.24 18.46±2.69△△14.82±1.79**14.28±2.23**组别空白组假手术组模型组抑制剂组温阳振衰颗粒组只数10 10 10 10 10 SCr/(μmol/L)31.88±4.91 29.48±5.10 61.57±6.38△△46.22±7.33**45.44±8.45**
2.3 温阳振衰颗粒对模型大鼠肾组织病理变化的影响
HE及Masson染色显示,空白组和假手术组大鼠肾小球、肾小管结构完整,无明显病理改变;模型组大鼠可见肾小管扩张,炎性细胞浸润,间质纤维化明显,肾小球形态破坏,结构不完整,大量炎性细胞浸润;抑制剂组和温阳振衰颗粒组大鼠肾小管、肾小球损伤程度较模型组减轻,肾间质纤维化减少。见图1、图2。
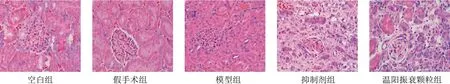
图1 各组大鼠肾组织形态(HE染色,×400)
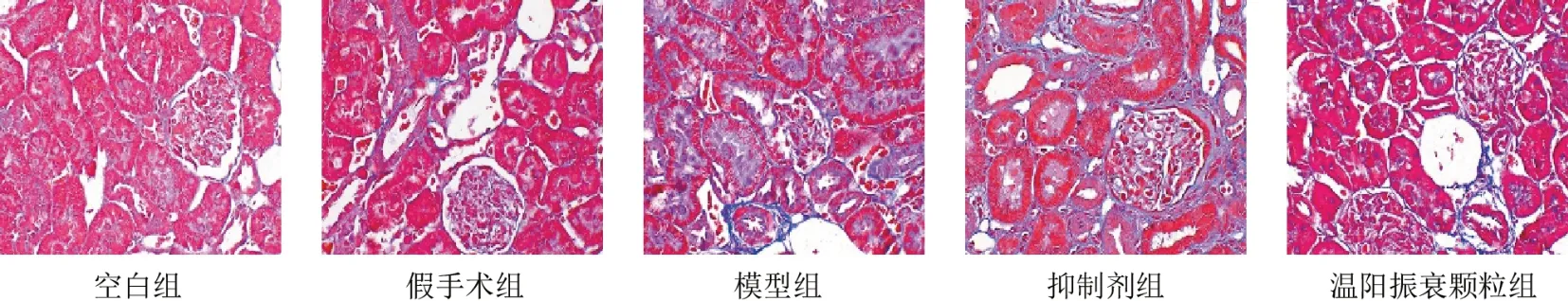
图2 各组大鼠肾组织形态(Masson染色,×400)
2.4 温阳振衰颗粒对模型大鼠肾组织转化生子因子-β1、α-平滑肌肌动蛋白、Ⅰ型胶原蛋白表达的影响
阳性染色主要表达于远端肾小管上皮细胞。与假手术组比较,模型组大鼠肾组织TGF-β1、α-SMA、Col-Ⅰ表达显著升高(P<0.01);与模型组比较,抑制剂组和温阳振衰颗粒组大鼠肾组织TGF-β1、α-SMA、Col-Ⅰ表达显著降低(P<0.01)。见图3~图5、表3。
表3 各组大鼠肾组织TGF-β1、α-SMA、Col-Ⅰ蛋白表达比较(,平均光密度,×10-3)
表3 各组大鼠肾组织TGF-β1、α-SMA、Col-Ⅰ蛋白表达比较(,平均光密度,×10-3)
注:与假手术组比较,△△P<0.01;与模型组比较,**P<0.01
组别空白组假手术组模型组抑制剂组温阳振衰颗粒组Col-Ⅰ2.1±0.5 1.5±0.6 34.0±9.0△△18.6±5.0**15.6±7.1**只数10 10 10 10 10 TGF-β1 0.6±0.4 0.9±1.2 14.6±5.9△△5.6±3.1**4.3±1.7**α-SMA 0.4±0.2 0.6±0.4 14.1±4.3△△5.9±2.7**4.3±1.1**

图3 各组大鼠肾组织TGF-β1阳性表达(免疫组化染色,×400)
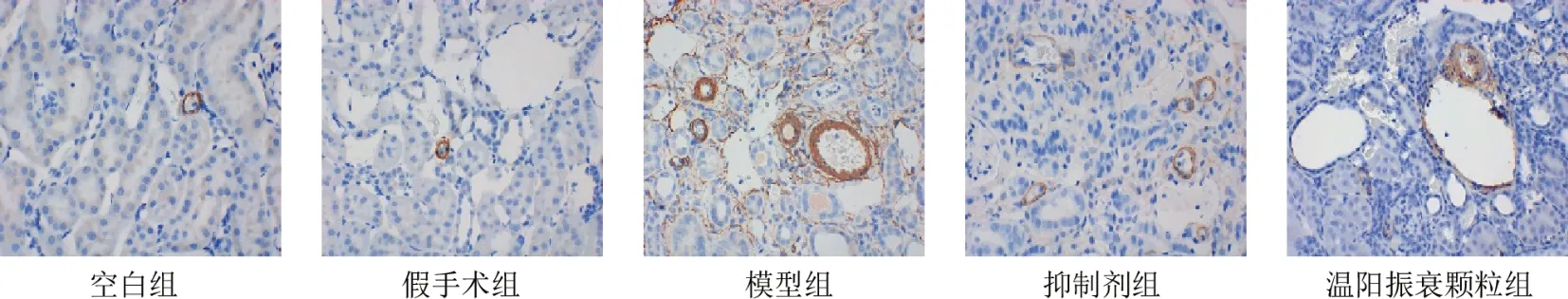
图4 各组大鼠肾组织α-SMA阳性表达(免疫组化染色,×400)

图5 各组大鼠肾组织Col-Ⅰ阳性表达(免疫组化染色,×400)
2.5 温阳振衰颗粒对模型大鼠肾组织NOD样受体蛋白3、半胱氨酸蛋白酶-1、白细胞介素-18、白细胞介素-1β蛋白表达的影响
与假手术组比较,模型组大鼠肾组织NLRP3、Caspase-1、IL-18、IL-1β 蛋白表 达显著升高 (P<0.01);与模型组比较,抑制剂组和温阳振衰颗粒组大鼠肾组织NLRP3、Caspase-1、IL-18、IL-1β蛋白表达显著降低(P<0.01)。见图6、表4。
表4 各组大鼠肾组织NLRP3、Caspase-1、IL-18、IL-1β蛋白表达比较(,相对表达量)
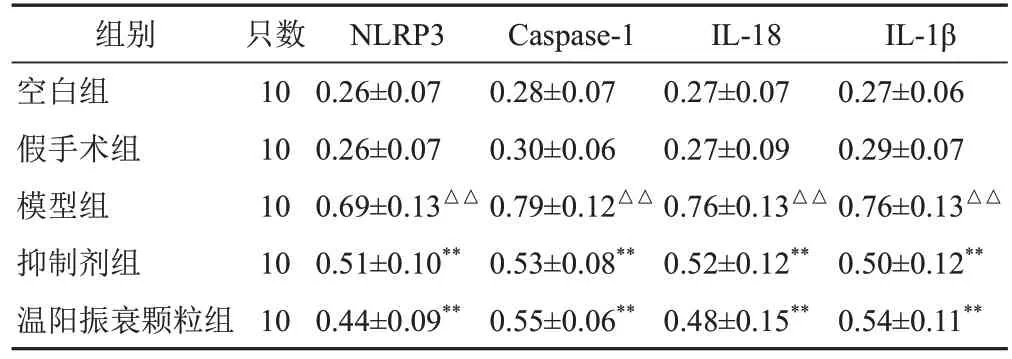
表4 各组大鼠肾组织NLRP3、Caspase-1、IL-18、IL-1β蛋白表达比较(,相对表达量)
注:与假手术组比较,△△P<0.01;与模型组比较,**P<0.01
组别空白组假手术组模型组抑制剂组温阳振衰颗粒组IL-1β 0.27±0.06 0.29±0.07 0.76±0.13△△0.50±0.12**0.54±0.11**只数10 10 10 10 10 NLRP3 0.26±0.07 0.26±0.07 0.69±0.13△△0.51±0.10**0.44±0.09**Caspase-1 0.28±0.07 0.30±0.06 0.79±0.12△△0.53±0.08**0.55±0.06**IL-18 0.27±0.07 0.27±0.09 0.76±0.13△△0.52±0.12**0.48±0.15**
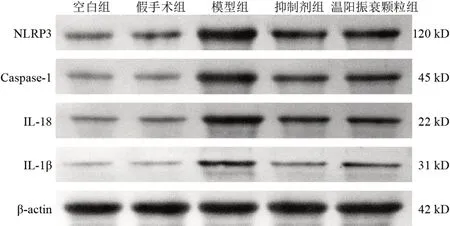
图6 各组大鼠肾组织NLRP3、Caspase-1、IL-18、IL-1β蛋白免疫印迹
2.6 温阳振衰颗粒对模型大鼠肾组织NOD样受体蛋白3、半胱氨酸蛋白酶-1、白细胞介素-18、白细胞介素-1β mRNA表达的影响
与假手术组比较,模型组大鼠肾组织NLRP3、Caspase-1、IL-18、IL-1β mRNA 表达显著升高(P<0.01);与模型组比较,抑制剂组和温阳振衰颗粒组大鼠肾组织NLRP3、Caspase-1、IL-18、IL-1β mRNA表达显著降低(P<0.01)。见表5。
表5 各组大鼠肾组织NLRP3、Caspase-1、IL-18、IL-1β mRNA表达比较()
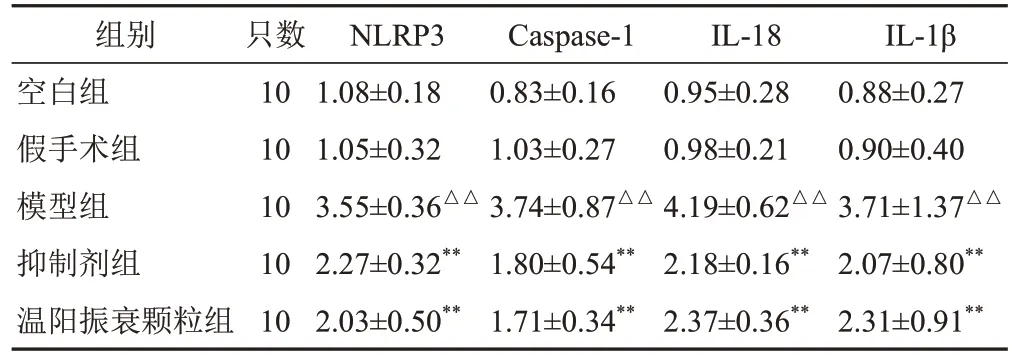
表5 各组大鼠肾组织NLRP3、Caspase-1、IL-18、IL-1β mRNA表达比较()
注:与假手术组比较,△△P<0.01;与模型组比较,**P<0.01
组别空白组假手术组模型组抑制剂组温阳振衰颗粒组IL-1β 0.88±0.27 0.90±0.40 3.71±1.37△△2.07±0.80**2.31±0.91**只数10 10 10 10 10 NLRP3 1.08±0.18 1.05±0.32 3.55±0.36△△2.27±0.32**2.03±0.50**Caspase-1 0.83±0.16 1.03±0.27 3.74±0.87△△1.80±0.54**1.71±0.34**IL-18 0.95±0.28 0.98±0.21 4.19±0.62△△2.18±0.16**2.37±0.36**
2.7 温阳振衰颗粒对模型大鼠肾组织细胞焦亡的影响
与假手术组比较,模型组大鼠肾组织细胞焦亡率显著增加(P<0.01);与模型组比较,抑制剂组和温阳振衰颗粒组大鼠肾组织细胞焦亡率显著减少(P<0.01)。见表6、图7。
表6 各组大鼠肾组织细胞焦亡率比较(,%)
表6 各组大鼠肾组织细胞焦亡率比较(,%)
注:与假手术组比较,△△P<0.01;与模型组比较,**P<0.01
细胞焦亡率组别 只数0.90±0.49 0.76±0.40 12.54±3.81△△2.82±0.71**2.78±0.99**空白组假手术组模型组抑制剂组温阳振衰颗粒组10 10 10 10 10
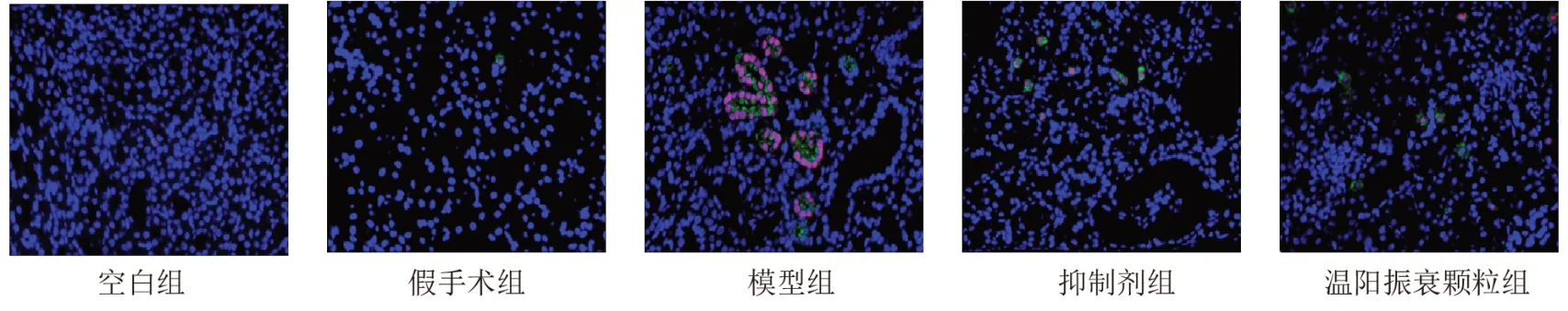
图7 各组大鼠肾组织细胞焦亡阳性表达(免疫荧光染色,×400)
3 讨论
CKD属中医学“水肿”“癃闭”“关格”等范畴,其基本病机为本虚标实,以肾元虚衰为本,兼具水湿、痰浊、瘀血等标实之证。《素问•阴阳应象大论篇》有“阳化气,阴成形”,肾元亏虚则水液不运,饮溢于肌表则发为“水肿”,湿邪浊毒壅滞于下焦则发为“癃闭”,水谷不下则变为“关格”,皆由阳气亏虚所致。肾为先天之本,为“五脏阴阳之本”,故肾阳为一身阳气之根本。CRF病位在肾,涉及肺、脾、肝等脏腑,阳气亏虚在疾病的发展过程中起主导作用。温阳振衰颗粒由制附片、红参、干姜、茯苓、五味子、麦冬、甘草组成。制附片温通阳、暖命门、温坎水、破阴凝,红参大补元气、复脉固脱,二者合而为君;干姜大热无毒,守而不走,茯苓健脾渗湿,可补后天脾土,二者相伍则土得火生而中气可复,火得土覆而火可久存,为臣药;另以麦冬养阴生津,五味子五味皆备而酸独胜,以五味子之酸敛固涩固护阳气、敛火归元,使阳气不外泄,为佐药;甘草味甘性平,一可减附子之毒,二则调和诸药,为使药。诸药合用,共奏温阳益气、固阳化阴之功。
肾脏纤维化是各种CKD的共同病理结局,其中炎性细胞浸润引发的免疫反应在肾纤维化过程中发挥关键作用[11]。近年研究表明,多种肾脏炎症反应可激活NLRP3炎性小体[12-13],通过IL-1等促炎性细胞因子触发先天性免疫防御,以响应如感染、代谢失调等危险信号。同时,NLRP3/Caspase-1炎症通路介导的细胞焦亡在肾脏疾病中也发挥着重要作用[14-15]。细胞焦亡不同于细胞凋亡、坏死、胀亡和自噬,表现为细胞膜破裂并释放促炎性细胞内容物,是对刺激因素的一种过度应答反应。当机体受到内源性或外源性信号刺激时,模式识别受体通过识别病原相关分子模式和损伤相关分子模式导致炎性小体多蛋白复合物组装及Caspase-1前体活化,活化的Caspase-1一方面诱导焦亡发生,另一方面剪切细胞因子pro-IL-1β和pro-IL-18 使其成熟和分泌IL-1β和IL-18,IL-1β和IL-18释放到胞外以介导炎症级联反应[16-17]。
在肾脏非免疫性实质细胞中,小管上皮细胞可通过激活NLRP3炎性小体表达和释放IL-18,由此触发小管上皮细胞炎性反应和焦亡[17]。本研究结果也表明,模型组大鼠肾组织NLRP3、Caspase-1表达升高,炎症因子IL-18、IL-1β表达升高,细胞焦亡率增加,纤维化相关指标TGF-β1、α-SMA、Col-Ⅰ蛋白表达升高,肾间质纤维化明显。使用NLRP3 抑制剂MCC950 干预后,大鼠肾组织NLRP3、Caspase-1表达降低,炎症因子及纤维化相关指标表达降低,细胞焦亡率减少,肾间质纤维化有所改善,与温阳振衰颗粒组结果一致。表明NLRP3/Caspase-1炎症通路介导的细胞焦亡在肾间质纤维化过程中起重要作用,温阳振衰颗粒可能通过干预NLRP3/Caspase-1通路介导细胞焦亡,进而抑制肾脏纤维化,改善肾功能。
