基于网络药理学、分子对接和实验验证探讨固本解毒方治疗肺癌作用机制
2022-11-28朱冬菊朴炳奎杨晨白建琦秦腾腾朱宏伟张平
朱冬菊,朴炳奎,杨晨,白建琦,秦腾腾,朱宏伟,张平
1.中国中医科学院望京医院,北京 100102;2.中国中医科学院广安门医院,北京 100053
统计数据显示,肺癌发病率和病死率居全球恶性肿瘤首位,2020年新发220万例,死亡约180万例[1-2],43%的非小细胞肺癌(non-small-cell lung carcinoma,NSCLC)患者确诊时已是晚期[3]。原发灶NSCLC细胞易扩散至淋巴结、对侧肺和远处器官(如骨、脑和肝),这些器官对最初的抗肿瘤治疗反应低,治疗后复发频率高,患者生存率低,预后恶劣[4]。
中医药在治疗肺癌方面具有独特优势。固本解毒方为中国中医科学院广安门医院朴炳奎教授治疗肺癌的经验方,长期临床实践表明其疗效确切,但其作用机制尚未阐明[5-6]。因此,本研究采用网络药理学方法,结合分子对接和实验验证,探讨固本解毒方治疗肺癌的有效活性成分和作用靶点,为相关研究奠定基础。
1 资料与方法
1.1 固本解毒方活性成分筛选
通过TCMSP(https://old.tcmsp-e.com/tcmsp.php)和本草组鉴(HERB,http://herb.ac.cn/)搜索固本解毒方药物北沙参、续断、骨碎补、牛膝、黄芪、补骨脂、当归、太子参、半枝莲、土茯苓、白花蛇舌草、桔梗、甘草成分,以口服生物利用度(OB)≥30%和类药性(DL)≥0.18[7]为条件筛选,获得固本解毒方活性成分。
1.2 固本解毒方药物靶点筛选
利用PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)[8]下载药物活性成分的2D结构,上传至SwissTargetPrediction数 据 库 (http://www.swisstargetprediction.ch/)[9]预测潜在靶点,去除重复靶点,输入UniProt数据库(https://www.uniprot.org/)[10],对靶点进行标准化。
1.3 疾病靶点筛选
以“Lung cancer”为关键词,检索GEO数据库(https://www.ncbi.nlm.nih.gov/geo/),选取GSE136043数据集,以Padj<0.05且log2<-1或log2>1为条件筛选肺癌差异表达基因。同时,检索GeneCards(https://www.genecards.org/)[11]、OMIM(https://omim.org/)[12]、Malacards(https://www.malacards.org/)数据库,得到肺癌疾病相关靶点,合并去重,输入UniProt数据库,对靶点进行标准化。
1.4 蛋白相互作用网络构建及核心靶点分析
使用Venny2.1.0数据库(https://bioinfogp.cnb.csic.es/tools/venny/index.html)将固本解毒方药物靶点与肺癌疾病靶点取交集,交集靶点上传至STRING数据库(https://string-db.org/)[13]构建蛋白相互作用(protein-protein interaction,PPI)网络,物种设置为“Homo sapiens”,可信度>0.9,隐藏孤立蛋白,得到PPI网络,将PPI网络TSV文件导入Cytoscape3.8.0软件进行可视化,并利用CytoNCA插件进行拓扑分析,根据度中心度(DC)、中介中心性(BC)、接近中心性(CC),以大于2倍中位数筛选网络中的核心靶点[14]。
1.5 GO和KEGG通路富集分析
利用DAVID6.8数据库(https://david.ncifcrf.gov/)[15]对靶基因进行GO和KEGG通路富集分析,GO分析包括生物过程(biological process,BP)、细胞组 分 (cellular component,CC) 和 分 子 功 能(molecular function,MF)。
1.6 分子对接
从RSCB PDB 数据库(http://www.rcsb.org/)[16]和ZINC数据库(http://zinc.docking.org/)[17]下载受体的晶体结构和配体的化学结构,用AutoDock Vina[18]软件进行分子对接,评价固本解毒方主要活性成分与关键靶点的结合强度与活性。结合能<0时配体与受体结合的构象稳定,能量越低其结合的可能性越大,结合能≤-5.0 kcal/mol时成分与靶点具有良好的亲和力,结合能≤-7.0 kcal/mol时具有很好的亲和力[19]。选择最低结合能模型通过PyMOL2.4.0软件进行可视化分析。
1.7 实验验证
1.7.1 细胞和动物
人肺腺癌A549 细胞,美国克利夫兰州立大学Aimin Zhou实验室提供。SPF级雄性SD大鼠24只,体质量200~250 g,购自中国食品药品检定研究院,动物生产许可证号SCXK(京)2017-0005,饲养于北京隆安实验动物养殖中心,温度21~25 ℃,相对湿度40%~60%,自由摄食饮水。实验均经北京隆安实验动物养殖中心伦理委员会批准(BJLA2020-08)。
1.7.2 药物、试剂和仪器
固本解毒方(北沙参20 g,桔梗9 g,黄芪30 g,当归10 g,续断10 g,骨碎补10 g,牛膝10 g,补骨脂10 g,太子参15 g,半枝莲20 g、土茯苓20 g,白花蛇舌草15 g,甘草6 g)饮片,购自中国中医科学院望京医院中药房,经王景红主任药师鉴定符合2020 年版《中华人民共和国药典》规定。RPMI1640培养基,中国北京索莱宝科技有限公司,批号31800;0.25%胰蛋白酶、胎牛血清,Hyclone 公司,批号分别为SH30042.01、SH30070.03;M5 HiPer MTT/细胞毒性和细胞增殖检测试剂盒,中国北京聚合美生物科技有限公司,批号MF837-01;BCA蛋白浓度测定试剂盒、蛋白预染Marker,中国北京康为世纪生物科技股份有限公司,批号分别为CW0014S、CW2841S;Goat Anti-rabbit IgG/HRP,中国北京索莱宝科技有限公司,批号SE134;PVDF膜,德国Merck Millipore公司;蛋白激酶B(Akt)、p-Akt、糖原合成酶激酶(GSK)-3β、p-GSK-3β抗体,美国Cell Signaling Technology公司,货号分别为4691T、4060T、12456T、9323T;B淋巴细胞瘤-2基因相关X蛋白(Bax),美国Santa Cruz公司,货号sc-7480;B淋巴细胞瘤-2基因(Bcl-2),英国Abcam公司,货号ab182858。Nis-Elements D 2.30软件(Nikon),680 型酶标仪(美国Bio-Rad 公司),DYY-7C型电泳仪、DYCZ-40型电转仪、DYY-6C型电泳仪电源(北京六一仪器厂)。
1.7.3 含药血清制备及细胞分组
根据人与动物体表面积换算比值[20]计算大鼠每日用药剂量为原药材20 g/kg,常规水煎浓缩至含原药材1.25 g/mL,于4 ℃冰箱保存备用。大鼠随机分为给药组和空白组,给药组给予固本解毒方灌胃,空白组给予等量生理盐水,每日2次,连续5 d。末次灌胃后1 h,腹腔注射10%水合氯醛麻醉,腹主动脉取血,静置2 h,3 500 r/min 离心10 min,分离血清,56 ℃水浴灭活30 min,使用0.22 μm微孔滤膜过滤除菌,分装后置于-20 ℃冰箱保存备用。
A549 细胞用含10% 胎牛血清、1% 双抗的RPMI1640培养基,置于37 ℃、5%CO2培养箱中培养,取对数生长期细胞进行实验。根据不同剂量固本解毒方含药血清对细胞存活率的影响,将后续实验分为正常血清组(10%空白血清)及固本解毒方高、中、低剂量组(10%、5%、2.5%含药血清)。
1.7.4 MTT实验检测细胞存活率
收集生长良好的A549细胞,调整细胞悬液浓度为1×105个/mL,每孔 100 μL,接种于 96 孔板。置于37 ℃、5%CO2培养箱中培养24 h。用正常血清(正常组)和固本解毒方含药血清(实验组)处理细胞,继续培养24 h。吸去上清,加入90 μL新鲜培养液,再加入MTT溶液10 μL,继续培养4 h。吸弃上清液,每孔加入Formazan溶解液110 μL,置于摇床上,低速振荡10 min,使结晶物充分溶解。在酶标仪波长490 nm处测量各孔吸光度(OD值)。
1.7.5 Wetern blot检测蛋白表达
将对数生长期的A549细胞接种于6孔培养板中,分别加入正常血清和10%、5%、2.5%固本解毒方含药血清,置于37 ℃、5%CO2培养箱中培养24 h后提取总蛋白,BCA蛋白定量法测定蛋白浓度,SDS-聚丙烯酰胺凝胶电泳,PVDF转膜,5%脱脂牛奶封闭2 h,加入Bax、Bcl2、Akt、p-Akt、GSK-3β、p-GSK-3β 一抗(均以1∶1 000稀释),4 ℃孵育过夜,TBST冲洗3次,每次5 min,加入二抗,室温摇床孵育2 h,TBST冲洗3次,每次5 min,显影,凝胶成像系统扫描各条带灰度值,用Image J软件进行处理,计算目的蛋白相对表达量。
1.7.6 统计学方法
采用GraphPad Prism 6.0软件进行分析。实验数据以表示,多组间比较采用One-way ANOVA分析,多组间两两比较采用Dunnett-t法。P<0.05表示差异有统计学意义。
2 结果
2.1 固本解毒方活性成分
筛选得到固本解毒方活性成分237种,其中北沙参8种、续断8种、骨碎补18种、牛膝20种、黄芪20种、当归2种、太子参8种、半枝莲25种、土茯苓14种、白花蛇舌草7种、桔梗7种、甘草92种、补骨脂8种,主要活性成分有kaempferol(山柰酚)、beta-sitosterol(β-谷甾醇)、quercetin(槲皮素)、stigmasterol(豆甾醇)、sitosterol(谷甾醇)、eriodictyol(圣草酚)、luteolin(木犀草素)、wogonin(汉黄芩素)、baicalein(黄芩素)、baicalin(黄芩苷)等。
2.2 固本解毒方药物靶点和肺癌疾病靶点
固本解毒方237种活性成分不重复作用靶点共有889个。GEO数据库GSE136043数据集中肺癌差异表达基因火山图见图1。筛选到1 821个差异表达基因,合并GeneCards、OMIM、Malacards数据库,共收集到不重复的疾病靶点20 442个。
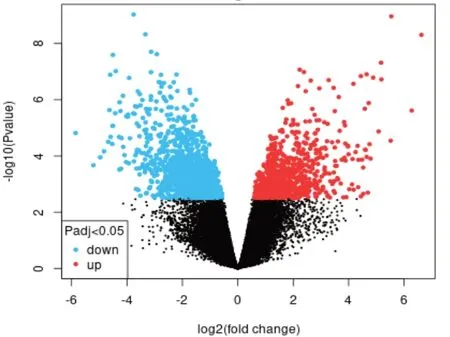
图1 GSE136043数据集肺癌差异表达基因火山图
2.3 蛋白相互作用网络及核心靶点
固本解毒方与肺癌交集靶点880个。交集靶点PPI网络见图2。使用cytoNCA 插件计算DC、BC、CC,以大于2 倍中位数(DC≥79,BC≥2 208.1,CC≥0.5)筛选得到核心靶点AKT1、EGFR、TNF、IL6、STAT3、PIK3CA、mTOR等,见图3。
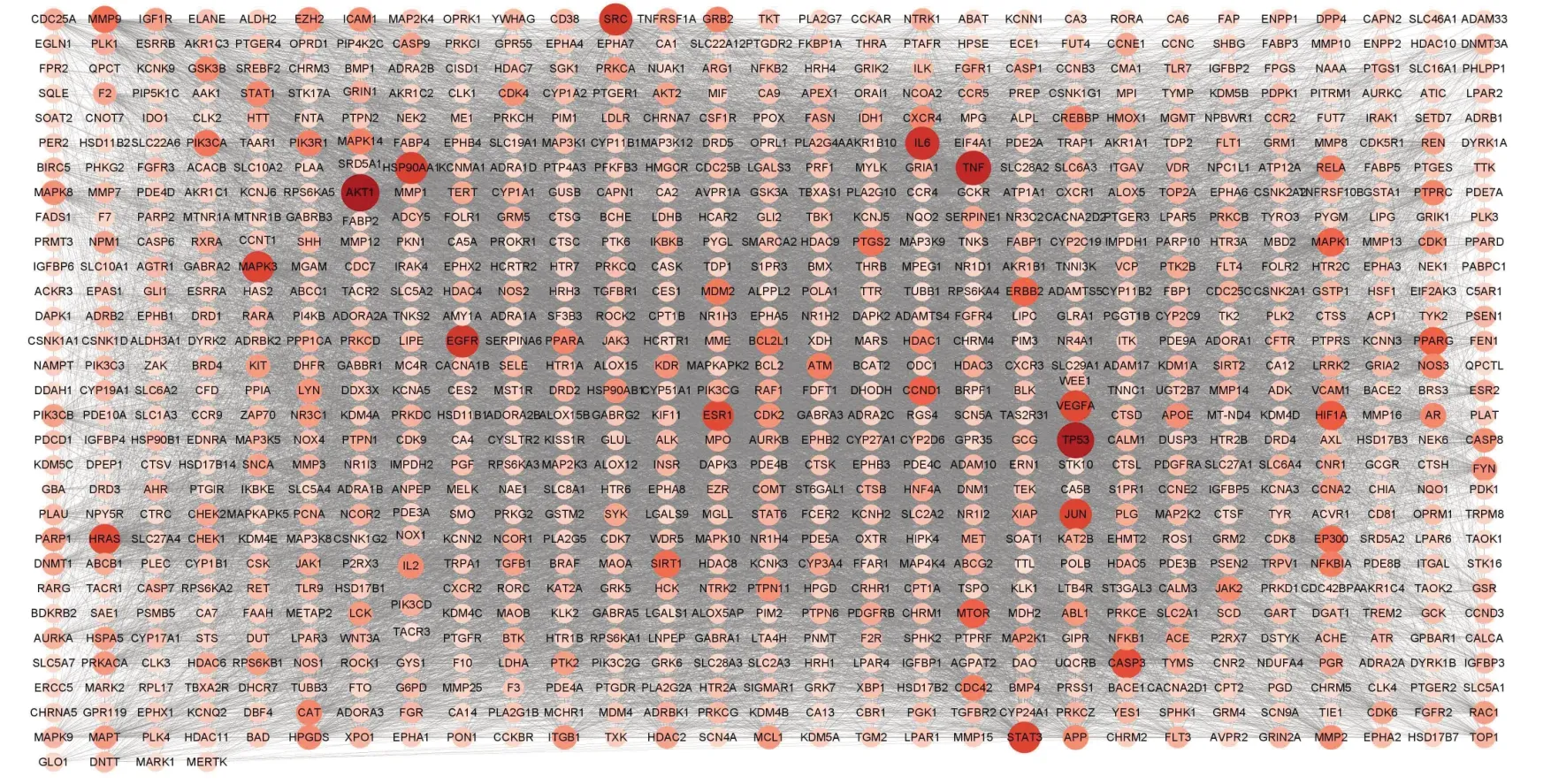
图2 固本解毒方治疗肺癌靶点PPI网络
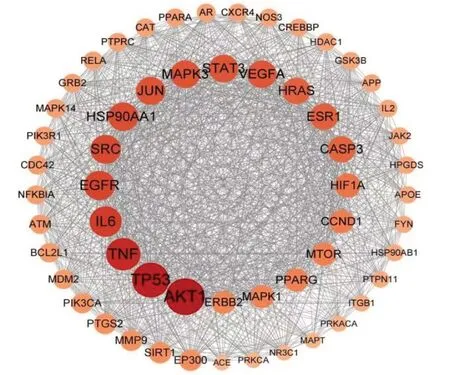
图3 固本解毒方治疗肺癌核心靶点
2.4 核心靶点GO和KEGG通路富集分析
固本解毒方治疗肺癌GO富集分析结果见图4。其中,BP主要富集在肽基丝氨酸/酪氨酸磷酸化和增殖、凋亡、炎症反应,CC主要富集在质膜细胞质侧的外部成分,MF主要富集在蛋白丝氨酸/苏氨酸/酪氨酸酶活性、ATP结合盒等。KEGG通路富集分析结果见图5。神经活性配体-受体相互作用、癌症相关通路、PI3KAkt 信号通路、钙离子信号通路、HIF-1 信号通路、VEGF信号通路、MAPK信号通路、凋亡相关通路显著性较好,提示固本解毒方可能通过这些信号通路抑制肺癌。尤其是PI3K-Akt信号通路显著性好,富集的靶点多,见图6。
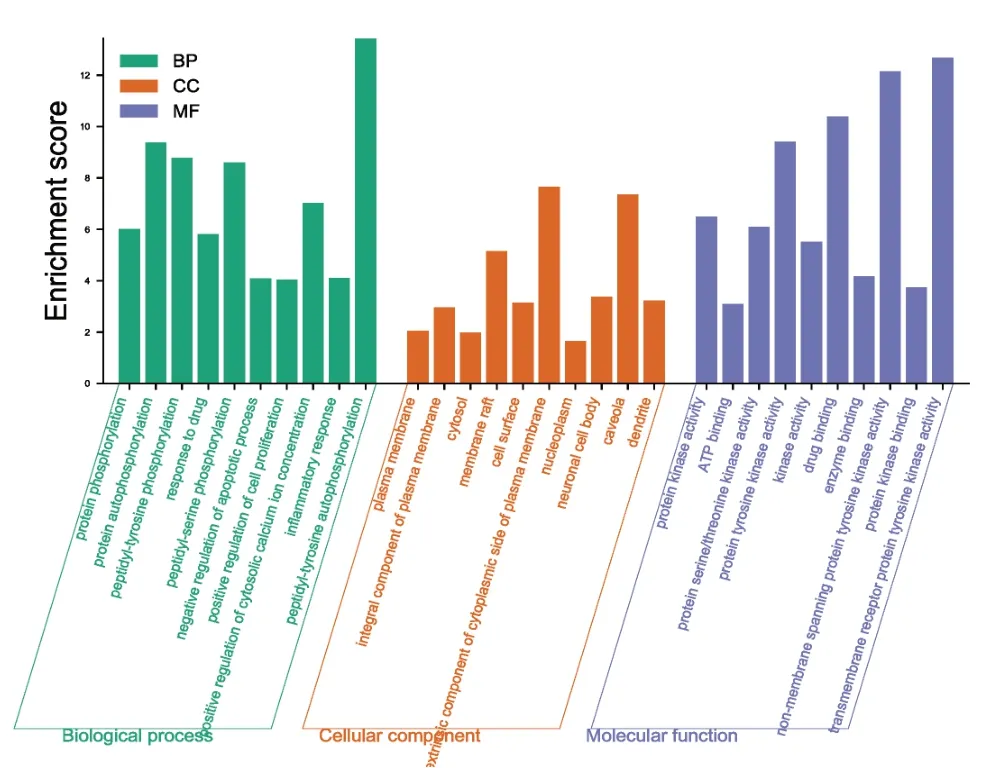
图4 固本解毒方治疗肺癌关键靶点GO富集分析
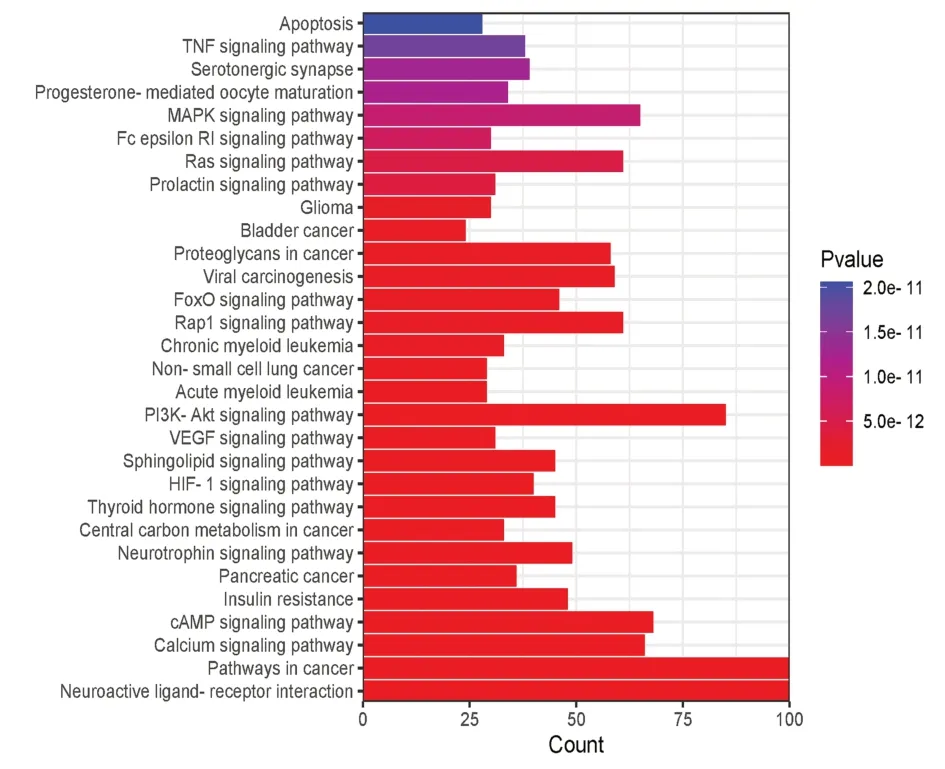
图5 固本解毒方治疗肺癌核心靶点KEGG通路富集分析
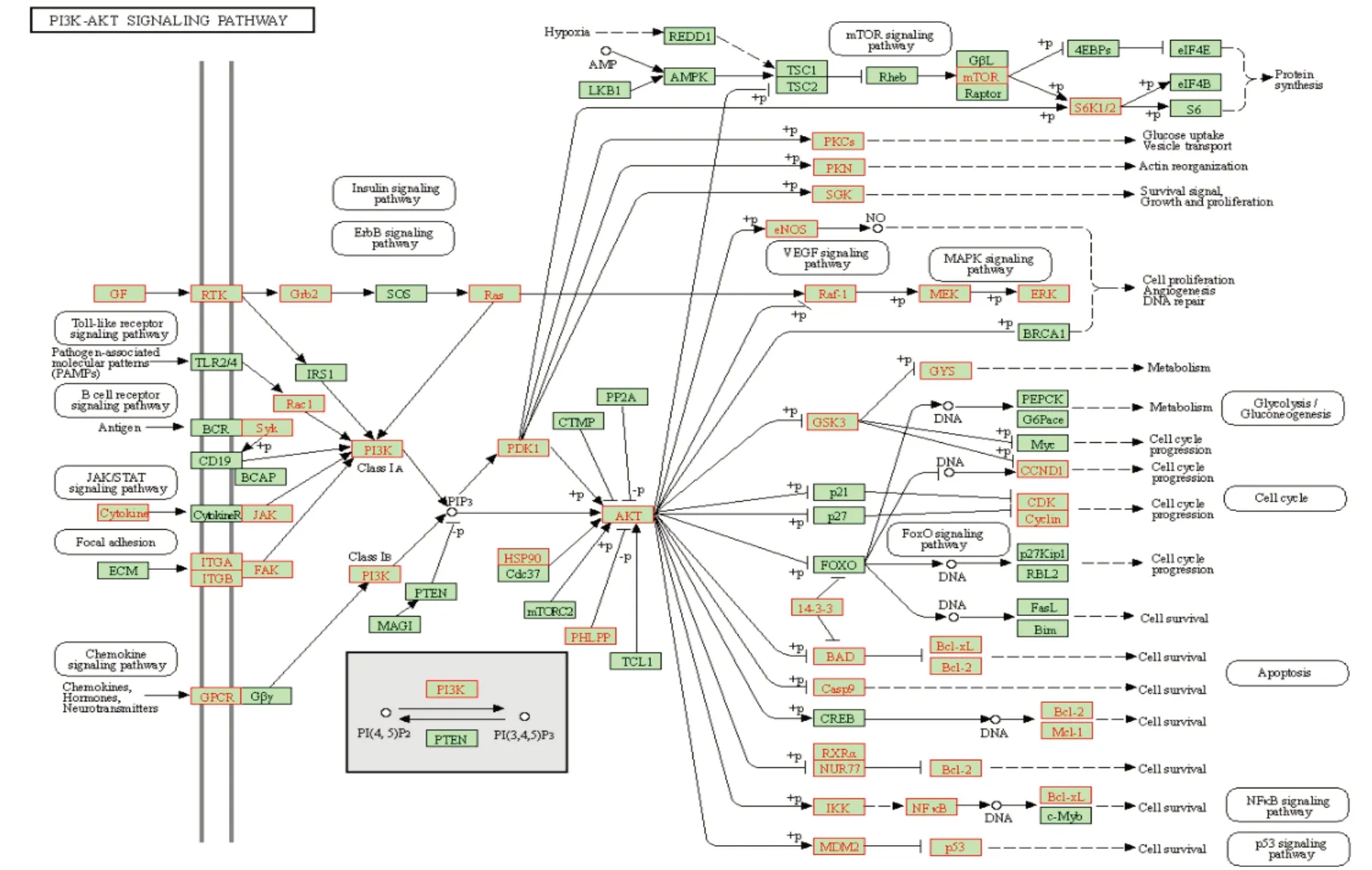
图6 固本解毒方治疗肺癌PI3K-Akt信号通路
2.5 分子对接结果
将固本解毒方主要活性成分与关键靶点进行分子对接,结合能见表1。固本解毒方主要活性成分与关键靶点均有较好的对接效果,其中多个成分与AKT1、PIK3CA的结合能均较低,提示药物可能通过AKT1、PIK3CA发挥作用。
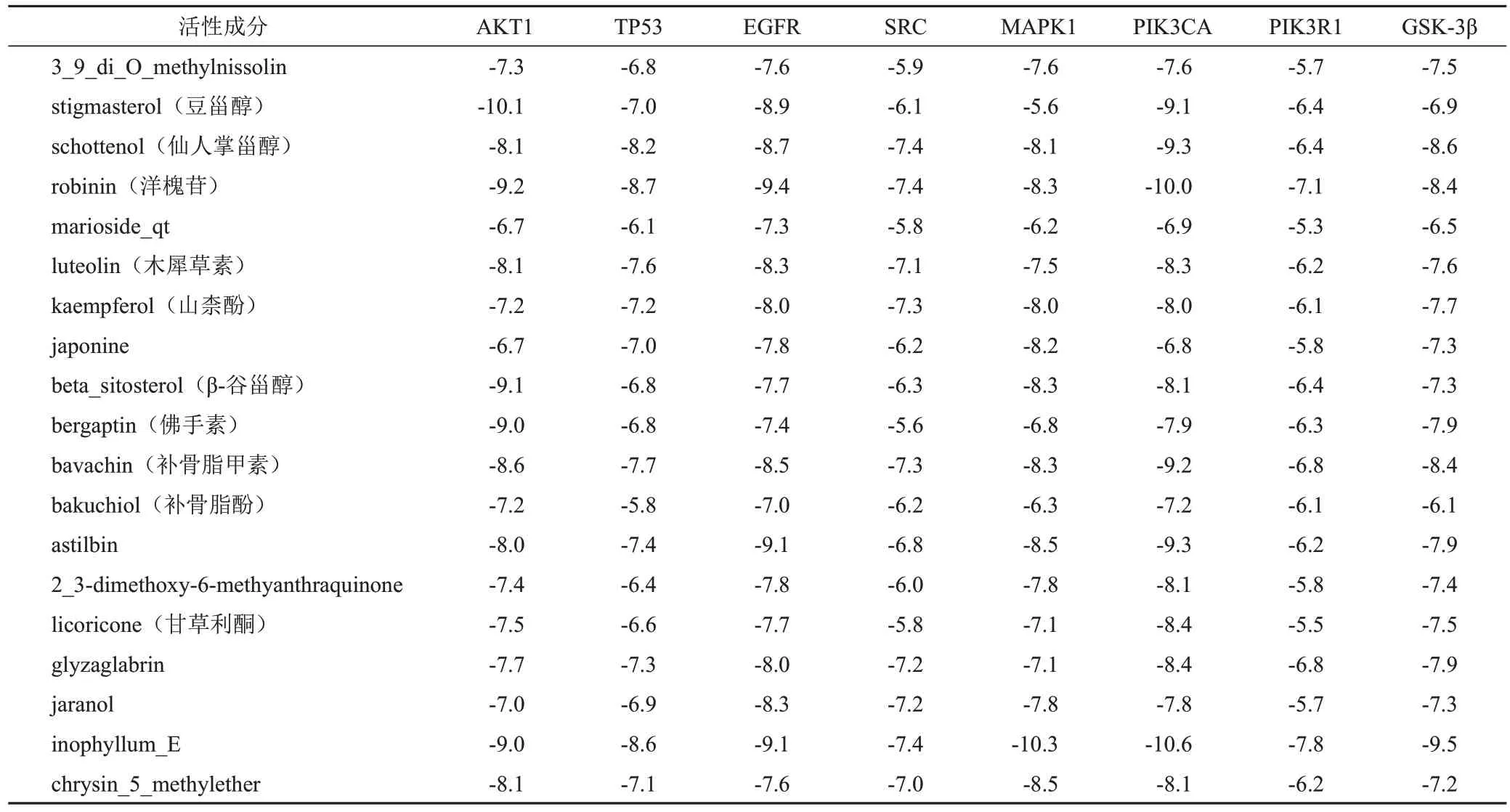
表1 固本解毒方治疗肺癌主要活性成分与关键靶点结合能(kcal/mol)
进一步挑选结合能低的最优构象进行可视化,结果见图7。stigmasterol(豆甾醇)与AKT1 活性位点TYR-175 等形成氢键作用力,Inophyllum_E 与PIK3CA 的活性位点ARG-662 等形成氢键作用力,Inophyllum_E 与 GSK3β 的 活 性 位 点 PRO-136、VAL-135、TYR-134等形成氢键作用力。
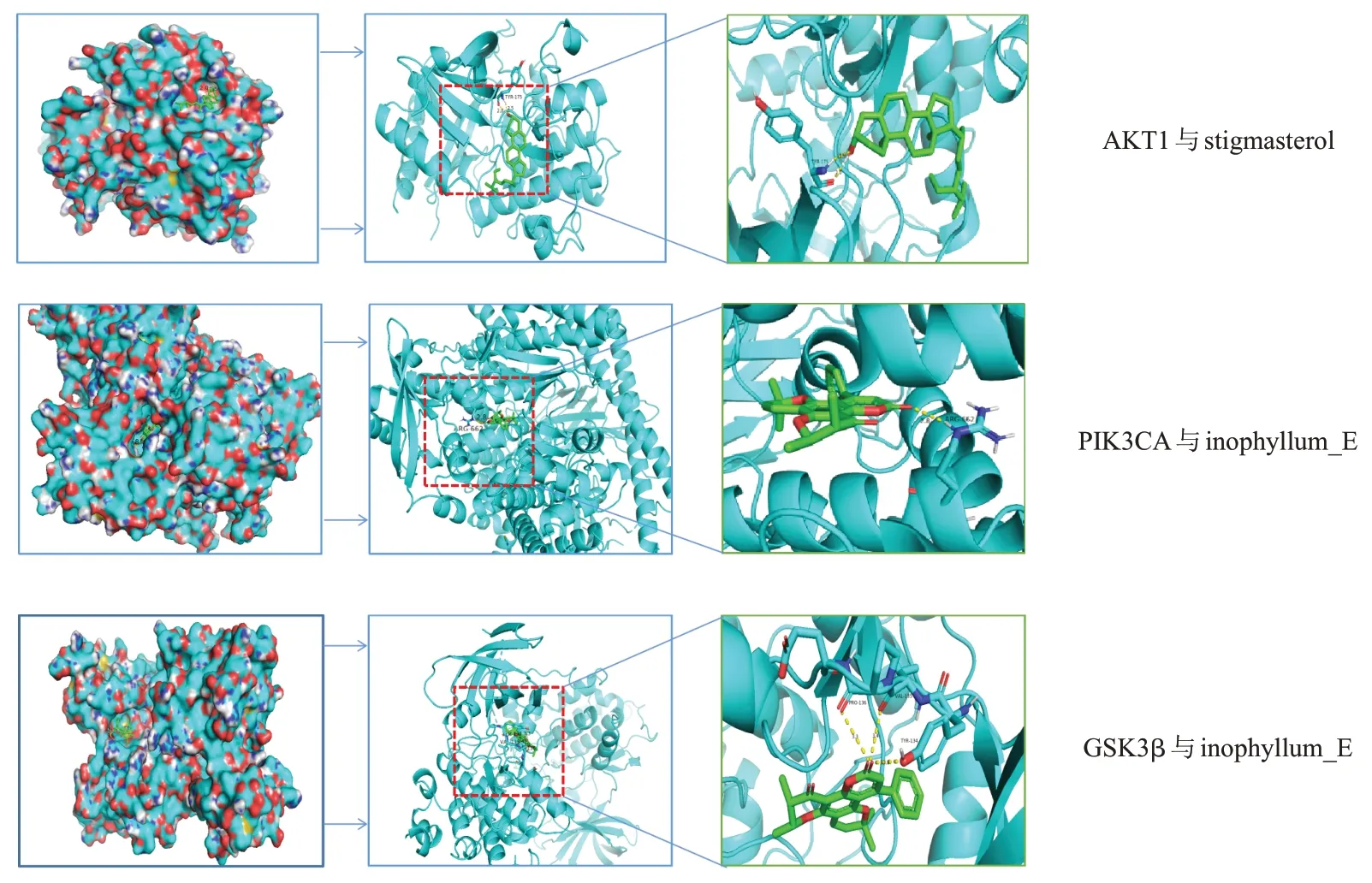
图7 固本解毒方治疗肺癌主要靶点与活性成分分子对接示意
主要活性成分与关键靶点分子对接结果表明,AKT1、PIK3CA、GSK3β可能是固本解毒方的关键作用靶点。
2.6 固本解毒方对A549细胞存活率的影响
与正常组比较,不同剂量(2.5%、5%、10%、20%、40%)固本解毒方含药血清处理A549细胞24 h,A549细胞存活率受到抑制,并呈一定的剂量依赖性,结果见图8。为排除固本解毒方含药血清毒性对细胞的影响,选择10%、5%、2.5%含药血清作为高、中、低剂量进行后续实验。
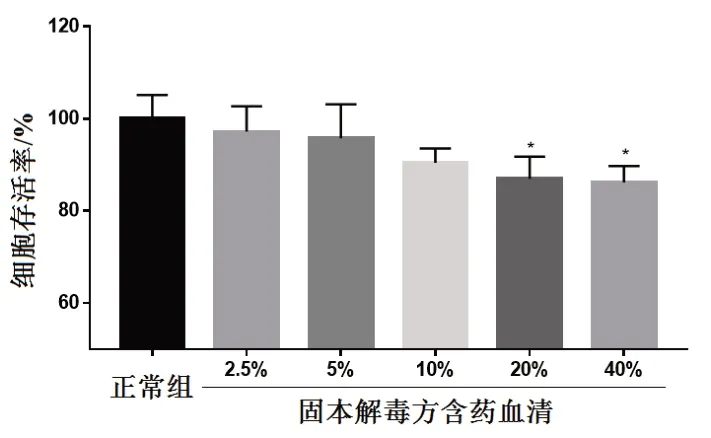
图8 固本解毒方对A549细胞存活率的影响
2.7 固本解毒方对肺癌A549 细胞凋亡相关蛋白Bax、Bcl2表达的影响
结合GO 和KEGG 通路富集分析结果,采用Western blot检测固本解毒方对A549细胞凋亡相关蛋白Bax、Bcl2的影响,结果见图9。与正常血清组比较,固本解毒方组A549细胞Bax蛋白表达显著上调,Bcl-2蛋白表达显著下调,差异均有统计学意义(P<0.01,P<0.001)。

图9 各组A549细胞Bax、Bcl2蛋白表达免疫印迹
2.8 固本解毒方对肺癌A549 细胞PI3K-Akt 通路蛋白表达的影响
采用Western blot 检测进一步验证固本解毒方对A549 细胞 PI3K-Akt 信号通路 Akt、p-Akt、GSK-3β、p-GSK-3β 蛋白表达的影响,结果见图10。与正常血清组比较,固本解毒方组A549 细胞p-Akt/Akt、p-GSK-3β/GSK-3β 表达明显下调(P<0.05,P<0.01,P<0.001)。表明固本解毒方通过调控PI3K-Akt信号通路治疗肺癌。

图10 各组A549细胞p-Akt、p-GSK-3β蛋白表达免疫印迹
3 讨论
网络药理学是以系统生物学为基础,对药理学和生物信息学进行结合的产物[21]。与以往的单成分、单靶点思维不同,网络药理学认为,药物在体内的过程是一个复杂的作用网络,即多成分-多靶点-多途径作用过程,药物通过多靶点间的相互作用产生增效减毒效果,符合中医整体观念,更适用于对具有复杂特性的中药复方进行分析[22-23]。
本研究筛选得到固本解毒方活性成分237 种,kaempferol(山柰酚)、beta-sitosterol(β-谷甾醇)、quercetin(槲皮素)、baicalin(黄芩苷)等为主要活性成分。现代药理学研究表明,方中诸药通过抑制肿瘤细胞本身的增殖和调控肿瘤免疫抑制微环境(tumor immunosuppressive microenvironment,TIM)的稳态来抑制肿瘤的生长和复发[24-26]。山柰酚能抑制A549细胞生长,可能与下调UBF的磷酸化水平影响rDNA的转录有关[27]。β-谷甾醇引起G2/M期细胞周期阻滞,诱导A549细胞凋亡[28]。槲皮素是一种可以预防肺癌等多种肿瘤的抗氧化类黄酮化合物,研究表明,其可能通过Stat3/Mcl-1途径介导肺癌PC9/GR细胞凋亡[29]。黄芩苷通过诱导肿瘤相关巨噬细胞复极化为M1样巨噬细胞,并促进肿瘤中促炎细胞因子的产生,从而抑制肝细胞癌模型小鼠肿瘤生长[30]。
本研究显示,固本解毒方治疗肺癌的核心靶点有AKT1、 PIK3CA、 EGFR、 TNF、 IL6、 STAT3、mTOR,主要通过PI3K-Akt信号通路,富集在蛋白酪氨酸激酶活性、增殖、凋亡、炎症反应等过程。这些靶点及通路在中医药调节TIM方面发挥重要作用。有研究显示,肺瘤平膏及其有效组分桔梗皂苷D通过调节PI3K-AKT-mTOR通路改善TDCs脂质异常堆积和抗原呈递功能,增强机体的抗肿瘤免疫功能,进而发挥抑瘤效应[31-33]。Yim 等[34]发现,桔梗苷通过AMPK/mTOR/AKT信号介导的自噬诱导人肺癌A549细胞的死亡。Li等[35]研究表明,中药配方通过抑制STAT3信号通路,抑制免疫抑制细胞因子的激活和免疫逃逸以增强免疫反应,显著抑制黑色素瘤小鼠的肿瘤生长。Bcl-2家族包含促凋亡蛋白及抗凋亡蛋白两大类,Bax主要通过升高线粒体膜通透性和促进细胞色素C的释放而起到诱导细胞凋亡作用,而Bcl-2主要通过减少线粒体细胞色素C 的释放而发挥抗细胞凋亡作用[36-38]。Aghvami等[39]研究表明,苦参碱在急性淋巴细胞白血病B淋巴细胞中上调促凋亡蛋白Bax,同时下调抗凋亡蛋白Bcl-2。髓源性抑制细胞通过激活TGF-β、EGF和HGF信号通路,诱导上皮间质转化,促进肿瘤转移[40]。基于血清药理学方法,Chen等[41]发现扶正抑瘤汤含药血清通过促进体内IL-2和TNF-α的产生,显着抑制肝癌细胞的增殖和诱导细胞凋亡,该结果与其以往动物实验和临床试验结果一致,表明血清药理学是评价扶正固本中药抗肿瘤作用的一种合理可行的方法。本研究分子对接结果表明,固本解毒方主要活性成分与AKT1、PIK3CA、GSK3β均有很好的结合力。体外实验结果表明,固本解毒方含药血清可显著降低Bcl2、p-Akt/Akt、p-GSK3β/GSK3β表达水平。
综上所述,本研究基于网络药理学和分子对接方法,分析固本解毒方治疗肺癌的作用机制,并利用体外细胞实验进行了初步验证,PI3K-Akt信号通路可能是固本解毒方抗肺癌的关键通路,可为后续实验研究提供思路。
