中国乳腺癌相关心脏病诊疗共识(2022年版)
2022-11-27邵志敏中华医学会肿瘤学分会肿瘤支持康复治疗学组中国乳腺癌相关心脏病诊疗共识编写委员会
沈 赞,邵志敏,中华医学会肿瘤学分会肿瘤支持康复治疗学组,中国乳腺癌相关心脏病诊疗共识编写委员会
1.上海交通大学附属第六人民医院肿瘤内科,上海 200233;2.复旦大学附属肿瘤医院乳腺外科,上海 200032
乳腺癌和心血管疾病是现代社会的两大“杀手”,严重威胁着中国女性的健康。尽管乳腺癌和心血管疾病在相关危险因素预防和治疗方面存在一些共同点[1],但目前这两个学科之间的关联共性尚未引起临床医师足够的重视。乳腺癌相关心脏病学涵盖两类亚群:①乳腺癌治疗引起的相关心血管疾病(cardio-vascular disease,CVD);② 乳腺癌患者合并的心血管疾病。因此,综合评估相关风险,对于那些已存在心血管系统疾病或心血管疾病风险的乳腺癌患者,具有十分重要的临床意义[2-3]。
本共识旨在指导临床医师对乳腺癌患者进行相关抗肿瘤治疗(化疗、靶向治疗、手术、内分泌治疗、免疫治疗及放疗)的前提下,将心脏保护作为一个整体进行评估和监测,根据监测的结果决定后续干预手段,并决定是否及何时由心脏科医师进行专业会诊,避免因对乳腺癌相关心脏毒性认识不够,导致治疗不及时而产生不可挽回的后果[4]。本临床共识声明中使用的方法旨在让临床医师能早期识别抗肿瘤治疗相关心脏毒性/并发症,及时发现患有心脏合并症风险的乳腺癌患者,进而指导个体化的诊疗,实施有效的管理(图1)。
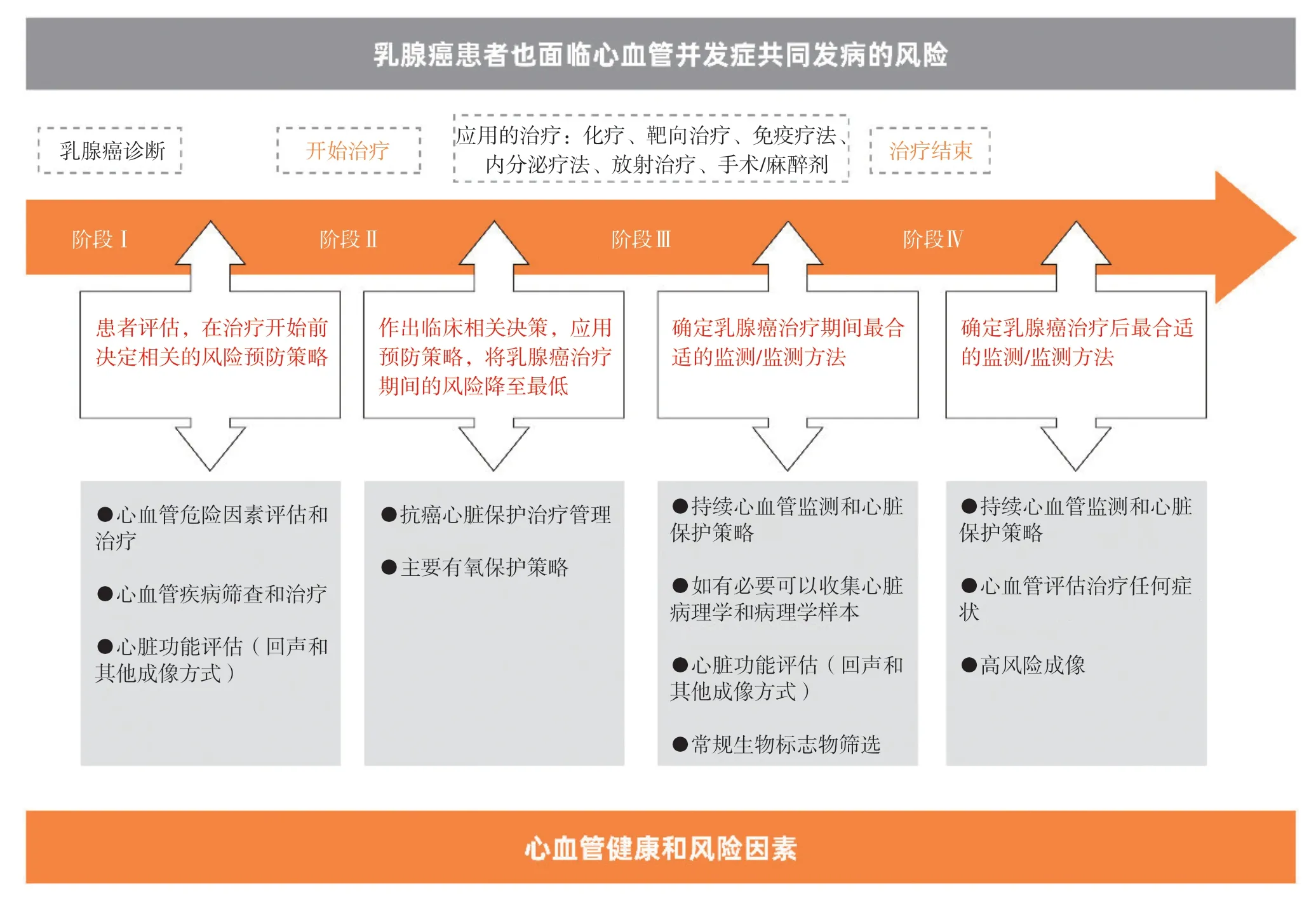
图1 乳腺癌诊疗相关心血管毒性全程管理流程Fig.1 The process of managing cardiovascular toxicity associated with breast cancer treatment
本共识意见以国内外相关询证医学证据为基石,经专家组成员通过共识形成会议法及投票所产生。
1 中国心血管病和乳腺癌疾病流行病学现状
心血管病已成为严重影响中国居民健康的疾病之一[5],据估计中国心血管病现患人数约3.3亿,农村和城市心血管疾病分别占死因的46.74%和44.26%,而乳腺癌更是严重威胁中国女性的健康,根据预测,2022年中国新发乳腺癌为429105例,占中国新发癌症病例数8.9%,新发乳腺癌死亡病例数约43780例,占中国新发癌症死亡病例数7.2%[6]。此外,心血管病和乳腺癌也给国民经济带来了巨大的负担,《中国心血管健康与疾病报告2021》指出,中国心血管病住院总费用逐年增长,尤其是2004年后呈现快速上升趋势,高于同期GDP增速[5]。乳腺癌方面,目前中国尚缺少全国层面的乳腺癌经济负担研究,但基于个体和地区层面的系统性综述研究均提示1996—2015年,乳腺癌经济负担呈上升趋势[7-8]。
随着乳腺癌诊疗水平的提高,患者的生存期明显延长,同主要发达国家类似,中国乳腺癌患者的生存预后较前已有了明显的改善[9],但是国内乳腺癌患者的治疗后康复水平仍不令人满意[10]。因治疗或患者自身代谢因素变化(年龄、激素水平等)引起的伴随性疾病日益明显;其中,心血管疾病是主要的伴随性疾病之一[11-12]。研究[7]显示,随着生存时间的延长,乳腺癌患者中因乳腺癌导致的死亡持续下降,尤其在诊断后生存时间超过10年的乳腺癌患者中,非癌症原因导致的死亡比例超过60%,其中心血管疾病是最常见的非癌症死亡原因。另一项研究[13]则发现,老年乳腺癌患者中,随访至确诊后7年其死于心血管疾病的风险明显高于无乳腺癌病史的妇女。因此,提高对乳腺癌相关心脏病的认知,及时发现相关危险因素并进行相应的治疗,有助于进一步提高乳腺癌患者长期生存率,改善生活质量。
2 乳腺癌治疗与心脏毒性及全程管理
2.1 化疗与心脏毒性
蒽环类药物作为乳腺癌化疗的基石药物之一,其心脏毒性主要表现为心功能不全、心力衰竭、心律失常和心包疾病,尤其是左心功能不全。常表现为:①左心室射血分数(left ventricular ejection fraction,LVEF)降低的心肌病,表现为整体功能降低或室间隔运动减弱;② 充血性心力衰竭(congestive heart failure,CHF);③CHF相关的体征,如第三心音奔马律、心动过速,或两者都有;④ LVEF较基线降低至少10%,伴或不伴有症状或体征。此外,其他毒性还包括冠状动脉受损、心脏瓣膜损伤、心律失常(主要是QT间期延长)、高血压、血栓形成、外周血管疾病和脑卒中、肺动脉高压等。蒽环类药物致心脏毒性通常表现为进行性加重和不可逆性,按照心脏毒性出现的时间,可分为急性、慢性和迟发性心脏毒性3类。急性:给药后数小时或数日内发生,临床表现为室上性心律失常、短暂性心功能异常、心电图(electrocardiogram,ECG)改变,常常为可逆性损伤。慢性:多在化疗后1年内发生,临床表现为心功能降低、心力衰竭。为不可逆的损伤。迟发性:治疗后数年发生(平均7年),临床表现为心力衰竭、心肌病、心律失常,病程不可逆转[14-17]。
其他常见化疗药物的心脏毒性见表1[18-41]。总体而言,化疗药物引起的心肌损伤症状多样,需要临床医师结合患者情况综合判断。

表1 乳腺癌常规化疗药物及心脏毒性防治管理(强烈推荐)Fig.1 Routine chemotherapy drugs for breast cancer and prevention and management of cardiac toxicity (highly recommended)
2.2 靶向治疗与心脏毒性(表2)
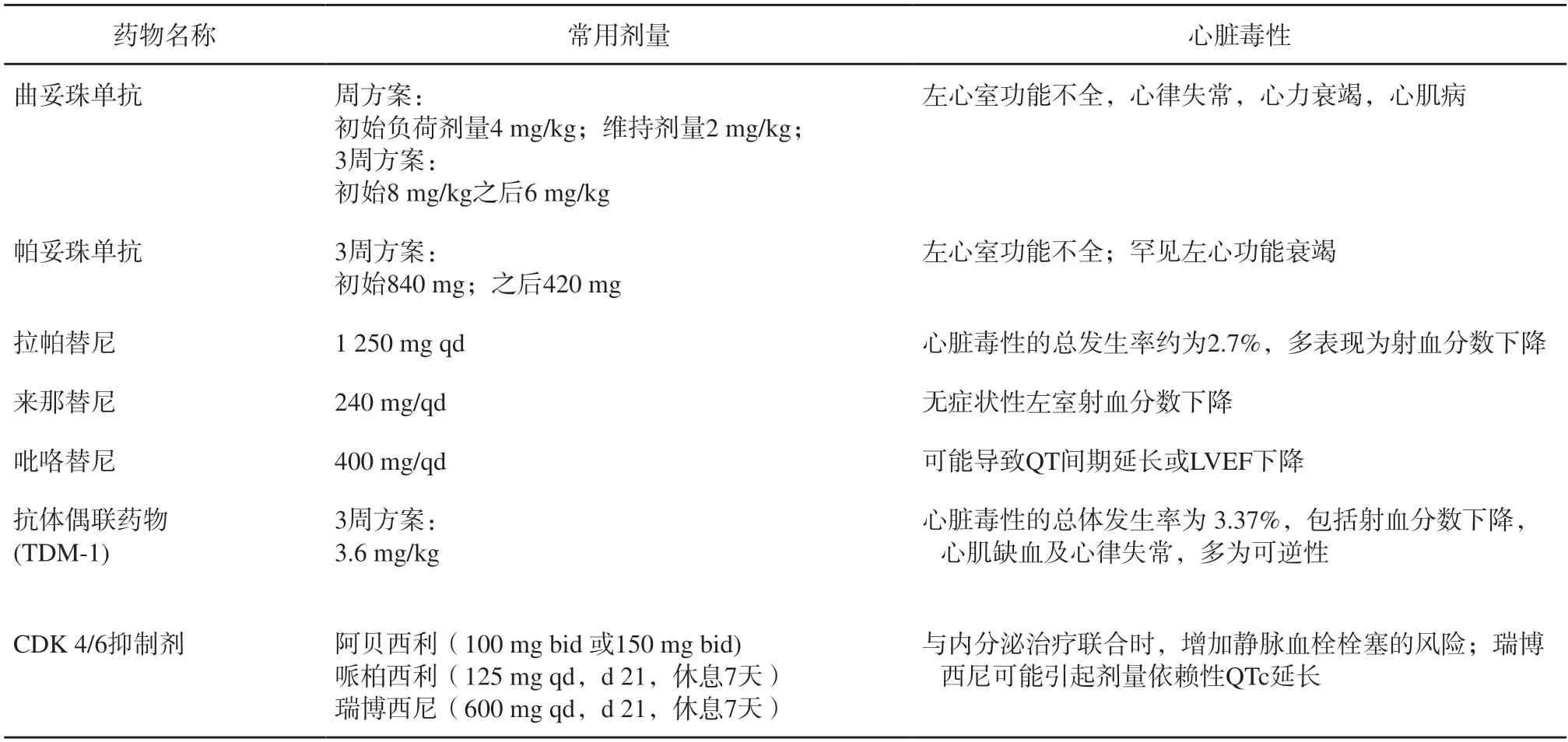
表2 乳腺癌靶向治疗及心脏毒性(强烈推荐)Fig.2 Targeted treatment and cardiotoxicity of breast cancer (highly recommended)
2.2.1 曲妥珠单抗
绝大多数情况下,这种损害是可逆的,多数患者在发现损害后中断曲妥珠单抗治疗,其LVEF在1~ 3个月内得到恢复,但也有一部分证据表明曲妥珠单抗的心脏毒性可能在治疗结束后持续多年(30个月以上),因此,这些不良反应并不像最初所说的那样总是可逆的[42-44]。此外,蒽环类药物和曲妥珠单抗联合使用可明显增加发生心肌功能障碍和严重心力衰竭的风险(5%~ 10%)[45]。
2.2.2 帕妥珠单抗
帕妥珠单抗是一种新型的重组人源化单克隆抗体,目前认为它在心脏毒性方面是安全的,与曲妥珠单抗一起使用时,并没有使LVEF降低的风险增加[46]。但也有使用曲妥珠单抗和帕妥珠单抗后诱发Tako-Tsubo心肌病(tako-tsubo cardiomyopathy,TTC)的报道[47]。
2.2.3 拉帕替尼
拉帕替尼引起的心脏毒性的总发生率约为2.7%[48]。而与紫杉醇合用时,拉帕替尼可以使心脏毒性的发生率从5%增加到9%[49]。与曲妥珠单抗类似,拉帕替尼对心脏的不良影响会因合用蒽环类药物而增强。
2.2.4 来那替尼
近年来多篇文献报道使用来那替尼后的患者出现无症状性LVEF下降[50-52]。
2.2.5 吡咯替尼
相关临床试验中,吡咯替尼联合卡培他滨治疗后,12.5%的患者出现了QTcF超过480 ms或较基线增加60 ms以上,但其中部分患者混杂有低钾血症和相关心血管基础疾病,故目前尚不能明确吡咯替尼会导致QT间期延长;此外,观察到10.2%的患者出现2级LVEF下降,未观察到下降低于50%的情况[53]。
2.2.6 抗体药物偶联物
之前认为T-DM1在心脏方面是安全的,但最近的一项汇总分析发现,使用T-DM1的患者其心脏毒性的总体发生率为3.37%,多为可逆性心脏毒性,其中高龄和基线LVEF低于55%是主要危险因素[54]。
2.2.7 CDK4/6抑制剂
一项meta分析表明,当CDK4/6抑制剂加入内分泌治疗时,静脉血栓栓塞的风险增加3.5倍[55]。此外,瑞博西尼的一项研究显示,从600 mg/d开始出现剂量依赖性QTc延长[56]。有鉴于此,瑞博西尼的用药手册建议在基线、第14天、第2个周期开始时(第28天)以及此后根据临床需要定期监测QTc,如果QTc延长,则应减少剂量和(或)中断治疗。
2.3 乳腺癌免疫疗法(表3)

表3 乳腺癌免疫治疗及心脏毒性管理(强烈推荐)Fig.3 Immunotherapy and cardiac toxicity management of breast cancer (highly recommended)
近年来,乳腺癌的免疫治疗开始大规模进入临床实践,但其心肌炎的真实发生率并不明确。鉴于IMpassion130、KEYNOTE-522、KEYNOTE-355以及FUTURE-C-plus等诸多研究中使用的阿替利珠单抗、帕博利珠单抗、卡瑞利珠单抗在其他癌种的治疗中已经发现存在心肌炎免疫不良反应,因此推测乳腺癌患者接受上述免疫检查点抑制剂治疗后也有可能出现类似不良反应。心肌炎可以呈无症状、轻微症状、明显症状或暴发性心肌炎表现。初起症状多为非特异性,如乏力、心悸和气短等,也可出现心悸、胸痛、呼吸困难等,严重时可能出现端坐呼吸、下肢浮肿,甚至猝死等[57-62]。
对不稳定的亚临床心肌损伤[心肌肌钙蛋白(cardiac troponin,cTn)进行性升高],推荐每日口服泼尼松1~ 2 mg/kg,5~ 7 d后开始减量,首次减量25%~ 40%,以后每周减量一次,减量过程不宜短于4周,直至心脏损伤生物标志物恢复到基线水平后停用。
对轻症型心肌炎患者推荐每日静脉注射甲基泼尼松龙1~ 2 mg/kg(或视情况口服等效泼尼松,甲基泼尼松龙4 mg=泼尼松5 mg)5~ 7天,病情改善后开始减量,每1~ 2周减量一次,减量过程不宜短于4~ 6周,直至心脏损伤生物标志物恢复到基线水平后停用。对重症型和危重型心肌炎患者推荐静脉注射甲基泼尼松龙冲击治疗(1 g/d)3~ 5天,病情改善后每日甲基泼尼松龙的剂量改为1~ 2 mg/kg(视情况缓慢过渡到口服等效泼尼松),待传导阻滞及心功能恢复后开始减量,每1~ 2周减量一次,减量过程可能持续6~ 8周,甚至更长,直至心脏损伤生物标志物恢复到基线水平后停用。重症型心肌炎接受糖皮质激素冲击剂量治疗24 h后如病情无改善,推荐增加1~ 2类其他药物联合或序贯应用(1种化学药物或1种生物制剂+IVIG),ATG或阿仑单抗可能优于其他生物制剂。
危重型心肌炎接受糖皮质激素冲击治疗24 h后如病情无改善,推荐增加1~ 2类甚至3类其他治疗药物(1种化学药物+1~ 2种生物制剂+IVIG),也可以考虑起始即选择糖皮质激素冲击剂量联合上述药物治疗。危重型心肌炎如医疗机构条件许可且患者预期寿命较长,可以考虑联合血浆置换和淋巴细胞清除以及生命支持治疗等措施[62-64]。
2.4 乳腺癌内分泌疗法(表4)
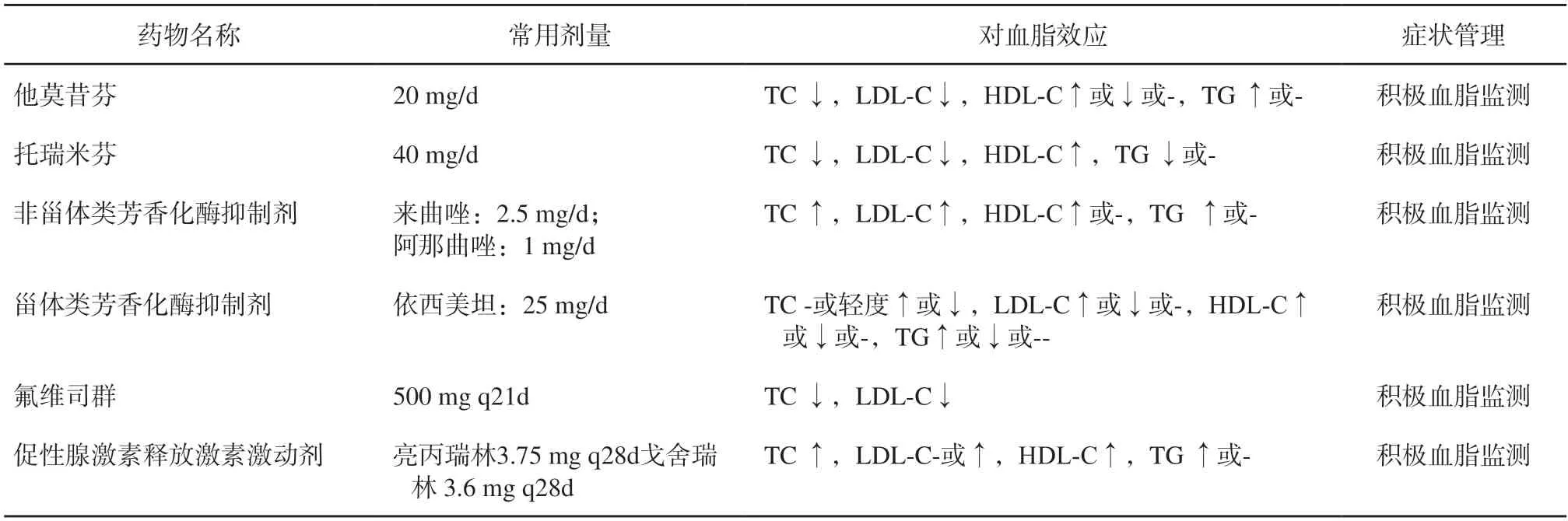
表4 乳腺癌内分泌治疗及血脂管理(强烈推荐)Fig.4 Endocrine therapy and blood lipid management for breast cancer (highly recommended)
乳腺癌患者内分泌治疗中,其血脂受到卵巢功能异常以及内分泌治疗药物的双重影响,容易出现血脂代谢异常,尤其是绝经后的乳腺癌患者,血脂异常的发生率明显升高[65]。甾体类芳香化酶抑制剂(aromatase inhibitor,AI)(依西美坦)的高胆固醇血症发生率与他莫昔芬基本相似[66],而非甾体AI(阿那曲唑、来曲唑)的高胆固醇血症发生率显著高于他莫昔芬[67-69]和甾体类AI[70]。氟维司群则未见血脂不良事件[71-72]。AI类药物对血脂的影响结论不一,一篇基于中国人群的研究发现非甾体AI可以导致总胆固醇(Total cholesterol,TC)、三酰甘油(triglyceride,TG)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)以及高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)的升高[73]。相比之下,甾体类AI对血脂的影响明显较小,甚至几乎不影响TC、HDL-C、LDL-C的水平[74]。氟维司群对血脂谱影响较小,可能会降低TC和LDL-C[75]。促性腺激素释放激素激动剂(gonadotropinreleasing hormone agonist,GnRHa)多引起全血脂谱的升高[76-77]。内分泌治疗中乳腺癌患者的血脂监测频率缺乏循证医学证据支持,尚无统一推荐,《绝经后早期乳腺癌患者血脂异常管理的中国专家共识》中建议动脉粥样硬化性心血管疾病(atherosclerotic cardiovascular disease,ASCVD)高危风险的患者每6个月检测血脂一次,普通患者每6~ 12个月检测血脂一次。针对肿瘤患者内分泌治疗期间出现的血脂异常的诊治方法主要遵循《中国成人血脂异常防治指南(2016年修订版)》,由心血管专家和肿瘤专家共同实现血脂管理[65,78]。
2.5 乳腺癌的放疗与心脏毒性(表5)

表5 乳腺癌放疗及心脏毒性(强烈推荐)Fig.5 Radiotherapy and cardiotoxicity of breast cancer (highly recommended)
在乳腺癌放疗期间,心脏结构的偶然辐射会产生炎症和促纤维化环境,可导致内皮功能障碍、加速动脉粥样硬化和心肌纤维化,临床上可表现为冠状动脉疾病或心肌病[79],心包疾病(包括急性心包炎,以及迟发性和缩窄性心包炎)、充血性心力衰竭、瓣膜损害以及心律失常[80]。这种与放疗相关的心脏不良反应通常称为辐射诱发的心脏病(radiation induced heart disease,RIHD)。在早期乳腺癌试验者协作组对>23000名女性所进行的meta分析中,发现5年后死于非肿瘤原因的比例高于未接受放疗者,主要归因于CVD和肺癌[81]。多项流行病学研究支持这一结果。对来自美国国立癌症研究所的监测、流行病学和最终结果(the Surveillance,Epidemiology,and End Results,SEER)项目的558871例乳腺癌女性患者,以偏侧性定义的死亡率比率为衡量标准,与右侧乳腺癌患者相比,接受放疗的左侧乳腺癌患者的CVD死亡率增加到1.19~ 1.90[82]。接受左侧和右侧乳腺放疗的患者冠心病和心源性死亡的风险分别增加了29%和22%[83]。
乳腺癌放疗后幸存者罹患RIHD的风险增加2.0~ 5.9倍,这种风险会由于放疗时年龄较小、接受其他心脏毒性药物治疗[蒽环类药物、抗人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)靶向药物等]、合并CVD和心血管病危险因素等因素而增加[84]。乳腺癌患者放疗时心脏所接受辐射的体积-剂量参数,主要是平均心脏剂量(mean heart dose,MHD)已被证实与RIHD的风险大小相关[85-86]。Taylor等[87]对2010年—2015年乳腺癌放疗方案的系统综述显示,当代乳腺癌放疗患者的平均心脏剂量为4.4 Gy。Darby等[86]提供了一项基于人群的病例对照研究,分析了2168例接受放疗的女性乳腺癌患者的主要冠状动脉事件(定义为心肌梗死,冠状动脉血运重建,或死于缺血性心脏病),结果表明,MHD每增加1 Gy,主要冠状动脉事件发生率线性增加7.4%。左心室心尖和左前降支段由于靠近前胸壁而特别容易受到较高剂量的辐射[88-90]。
较新的放疗技术试图通过深吸气屏气、呼吸门控、患者体位(侧卧位或俯卧位)和三维治疗计划[如调强适形放射治疗(intensity-modulated radiation therapy,IMRT)和容积弧形调强放疗(volumetric-modulated arc therapy,VMAT)]来限制辐射剂量和暴露于辐射的心脏体积,这些策略现在已经成为最佳实践标准的一部分[87,91-95]。这些较新的技术可能与较低的并发症发生率相关,但目前无法获得长期随访数据。鉴于辐射暴露和临床心血管事件之间的长潜伏期,进一步降低MHD的影响仍然未知。质子治疗是一种替代放疗技术,可进一步最大限度地减少心脏的辐射剂量,超出传统的基于光子的放疗技术所能达到的水平[96]。RADCOMP研究(NCT02603341)是一项随机临床试验,将比较接受质子放疗与光子放疗患者的10年心血管事件结果。
放疗前评估是否合并CVD,以及是否存在影响RIHD发生的因素,如年轻体胖、吸烟史、是否应用了具有心脏毒性的化疗药物、抗HER2药物及内分泌治疗药物等。心脏超声检查、磁共振成像(magnetic resonance imaging,MRI)、超声心肌应变率显像和生物标志物等常用于化疗相关心脏毒性的评估,这些手段在评估和检测RIHD方面也可能有一定价值[97-99]。然而,如何应用这些检测手段早期发现RIHD仍有待研究。
2.6 乳腺癌手术与心脏毒性(表6)
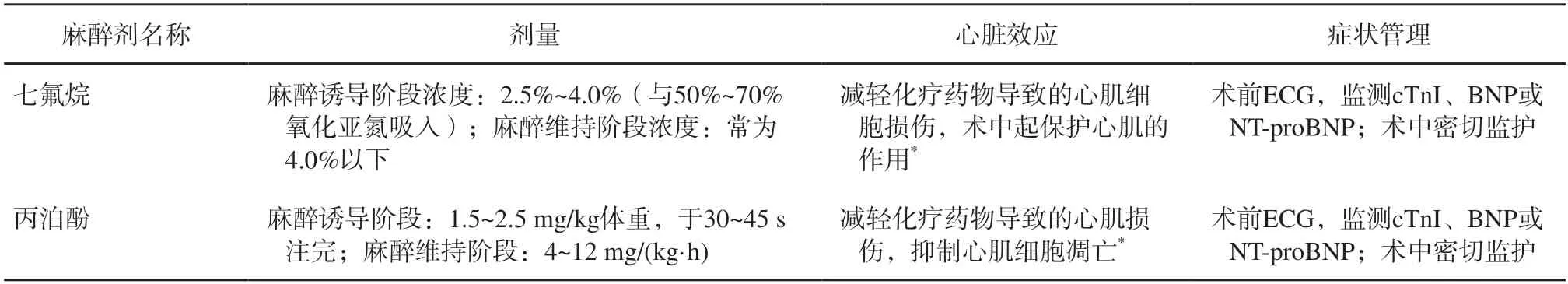
表6 乳腺癌手术用药及心脏毒性(谨慎推荐)Fig.6 Breast cancer surgery medication and cardiac toxicity (cautiously recommended)
在全世界范围内,接受非心脏手术的患者中每年有1.4%~ 3.9%会发生心脏并发症,这也是患者出现围术期并发症和死亡的重要原因[100]。在手术风险分级中,乳房手术属于低危手术,心脏风险<1%,通常不需要进一步行术前心脏检查[101]。不过,部分乳腺癌患者在手术前先接受了新辅助治疗,由于部分药物的心脏毒性损伤了人体正常的心肌细胞,这些患者在术前可能存在有临床症状或无症状的心血管不良反应。有研究[102]显示,10%~ 26%的患者服用累积剂量超过推荐剂量(多柔比星≥500 mg/m2,表柔比星1000 mg/m2)的蒽环类药物时会发生充血性心力衰竭,并且超过50%的患者会在治疗结束后数月至数年间仍存在器质性心功能损害。对接受蒽环类等药物化疗的患者,手术时可能恰好处于化疗药物的急性或慢性心肌损伤期。有研究[103]显示,蒽环类药物治疗后的患者在术前无心血管症状的情况下,在全身麻醉期间可发生严重的心脏不良事件,如窦房传导阻滞等。即使在静息状态下心功能表现正常的患者(特别是儿童)中,术前接受的蒽环类药物也可能增强麻醉剂的心肌抑制作用[104]。
就常用的麻醉剂而言,七氟烷具有确切的心肌保护作用,是有围手术期心肌梗死风险的患者行非心脏手术时全身麻醉用药的推荐药物[105-106]。此外,乳腺癌患者术前化疗后存在以红细胞变形性下降为特征的血液流变学变化,不利于微循环灌注。而全麻复合硬膜外麻醉较单纯全麻能更明显地改善血液流变学指标,可能对预防心脏毒性有一定作用[107]。
对新辅助化疗患者的麻醉及手术管理中要重视心血管状况。接受手术治疗的患者,术前心脏风险评估及管理的流程主要遵循《2014年欧洲心脏病协会非心脏手术患者围术期评估管理指南》。乳腺癌手术属于低危手术,通常不需要进一步行术前心脏检查;有心血管病高危因素的患者,则考虑术前及术后48~ 72 h内进行肌钙蛋白、脑钠肽(brain natriuretic peptide,BNP)和N-末端脑钠肽前体(N-terminal pro-brain natriuretic peptide,NT-proBNP)的检测,以获得有关围术期及长期的预后信息[108]。
3 乳腺癌各诊疗手段相关心脏毒性管理流程(图2~ 7)
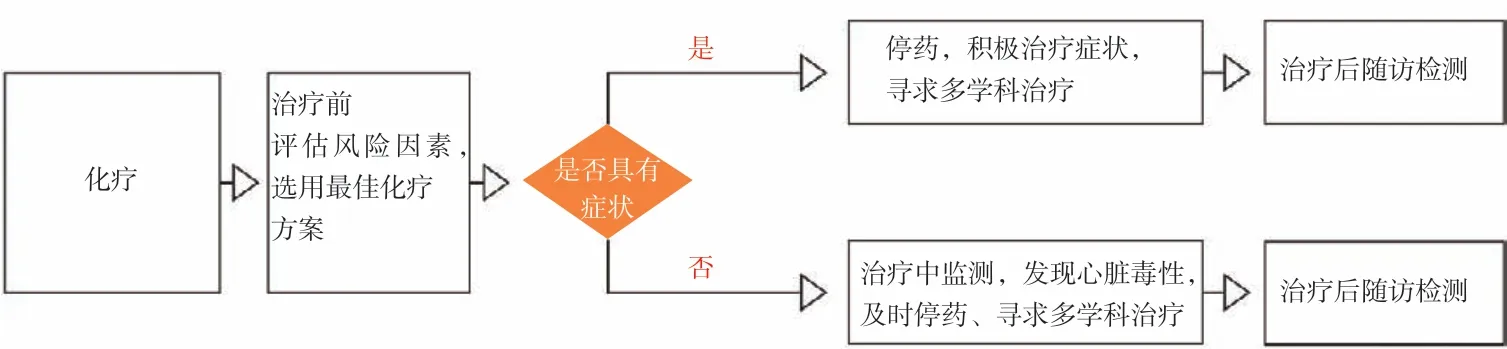
图2 乳腺癌化疗相关心血管毒性管理流程Fig.2 The process of managing chemo-cardiovascular toxicity associated with breast cancer
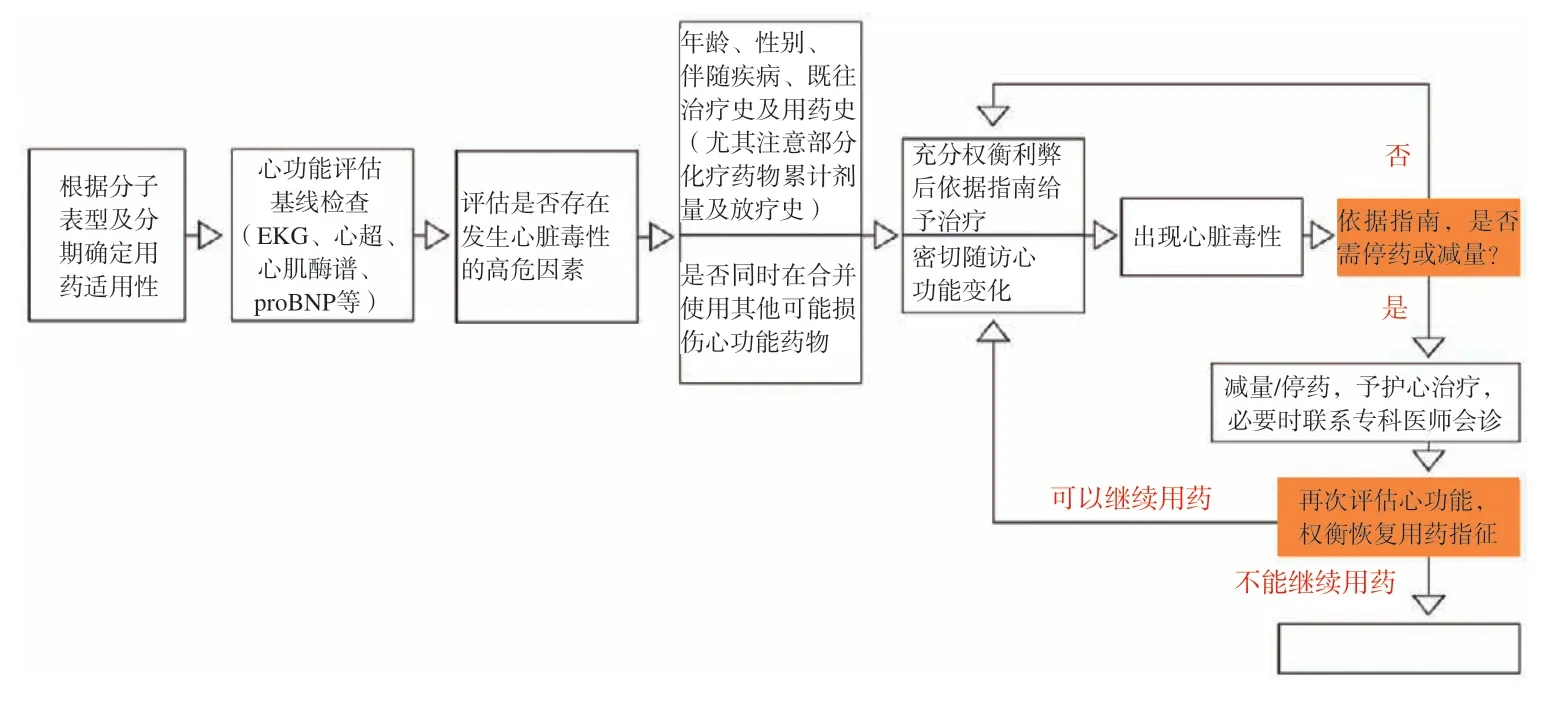
图3 乳腺癌靶向治疗相关心血管毒性管理流程Fig.3 The process of managing target-therapy-cardiovascular toxicity associated with breast cancer

图4 乳腺癌免疫治疗相关心血管毒性管理流程Fig.4 The process of managing immunotherapy-cardiovascular toxicity associated with breast cancer

图5 乳腺癌内分泌治疗相关心血管毒性管理流程Fig.5 The process of managing endocrine-cardiovascular toxicity associated with breast cancer

图6 乳腺癌放疗的相关心血管毒性管理流程Fig.6 The process of managing radiation-cardiovascular toxicity associated with breast cancer

图7 乳腺癌手术治疗相关心血管毒性管理流程Fig.7 The process of managing surgery-cardiovascular toxicity associated with breast cancer
3.1 乳腺癌化疗相关心血管毒性管理
在化疗前应充分评估风险因素,选用最佳的化疗方案;整个治疗流程中应密切监测心功能并根据监测结果调整治疗,必要时及时寻求多学科诊治。
3.2 乳腺癌靶向治疗相关心血管毒性管理
用药前充分评估风险因素,尽可能避免与其他可能损伤心功能的药物合用,治疗期间密切监测心功能,及时调整用药。
3.3 乳腺癌免疫治疗相关心血管毒性管理
用药期间密切监测心功能,如出现心功能损伤应综合评估,以明确是否为ICIs所致,并及时治疗。
3.4 乳腺癌内分泌治疗相关心血管毒性管理
治疗期间监测血脂变化,根据调脂目标评估危险级别,进行对应的调脂治疗。
3.5 乳腺癌放疗的相关心血管毒性管理
根据基线风险评估进行放疗决策,0级、I级、Ⅱ级预防应贯彻全程。
3.6 乳腺癌手术治疗相关心血管毒性管理
根据手术紧迫程度及伴随风险因素综合评估手术的必要性,并制定个体化的围手术期管理流程。
4 心脏毒性监测与管理
4.1 超声心动图
超声心动图是监测抗肿瘤治疗相关心肌损害及心脏结构、形态学变化的重要方法,具有便捷、敏感、无创、可重复及经济等优点,相关心肌损伤的建议指标包括LVEF、左心室舒张功能指标和心脏瓣膜结构与功能。
4.1.1 LVEF
LVEF是最常用于监测心肌损伤及抗肿瘤治疗心脏毒性的诊断指标,建议常规使用双平面Simpson方法测量。不伴有心力衰竭相关症状时LVEF降低≥10%且低于正常值下限(50%),或伴有心力衰竭症状时LVEF降低≥5%且低于正常值下限(50%)时可认为出现心脏毒性[109-112]。但LVEF敏感性低,不易发现亚临床心肌损伤,且测量时存在较高的变异性,可高达12%~ 15%[113]。整体纵向应变(global longitudinal strain,GLS)评估左心室收缩功能减低较LVEF更敏感,是ASE/EACVI以及ESC等指南公认用于早期监测心脏毒性的最敏感指标,可早期发现亚临床心肌损害[114-118]。研究显示,在LVEF出现降低前3个月GLS即出现异常,这为早期启动旨在预防心脏毒性的心脏保护治疗提供机会。通常LGS较基线值降低超过10%~ 15%,即使LVEF仍处于正常水平,亦可认为存在早期心肌损伤。
国际心脏肿瘤学会(International Cardio-Oncology Society,IC-OS)关于“癌症治疗心血管毒性的定义”的共识声明中推荐采用以下标准诊断癌症治疗相关的心功能不全(cancer therapyrelated cardiac dysfunction,CTRCD):⑴ 轻度CTRCD:LVEF绝对值≥50%,且新出现的GLS较基线降低>15%(相对百分数),伴有或不伴有新出现的心脏标志物升高(肌钙蛋白cTnI/T高于正常参考上限第99百分位,BNP≥35 pg/mL,NT-proBNP≥125 pg/mL,或新出现的测量值显著超出所用检测方法的正常参考值范围。);⑵ 中度CTRCD:①新出现的LVEF下降≥10%(绝对百分点),LVEF 40%~ 49%;② 新出现的LVEF下降<10%(绝对百分点),LVEF为40%~ 49%,且GLS较基线下降>15%(相对百分数);伴有或不伴有新出现的心脏标志物升高;⑶ 重度CTRCD:新出现的LVEF下降至40%以下。
4.1.2 左心室舒张功能指标
目前推荐左心室舒张功能监测主要测量指标包括E、e’、a’、LAVI、三尖瓣反流速度等。抗肿瘤治疗过程中,LVEF未出现显著减低时,E、E/A、e’、E/e’等指标可出现明显异常[119-120],但目前对左心室舒张功能评估心脏损害的价值尚未达成共识。临床常用的右心功能监测指标主要有三尖瓣环收缩期位移(tricuspid annular plane systolic excursion,TAPSE)、三尖瓣环收缩期运动速度(S’)、右心室面积变化率(right ventricular fractional area change,RVFAC)等。TAPSE<16 mm、S’<10 cm/s、RVFAC%<35%、右心室GLS(right ventricular GLS,RVGLS)绝对值<20%均可提示右心室收缩功能减退[121]。RVGLS在监测抗肿瘤治疗心肌损伤方面最为敏感。
4.1.3 心脏瓣膜结构与功能
胸部放疗尤其左侧胸部放疗可直接影响心脏瓣膜结构及功能。超声心动图可及时发现这些异常[122-123]。
4.2 ECG
药物诱导的QTc延长是药物安全的关键参数之一。QT间期显著延长,增加室性心律失常(如尖端扭转型室性心动过速)的发生。已知可能导致QT间期延长的抗肿瘤药物包括三氧化二砷、组蛋白去乙酰化酶抑制剂、酪氨酸激酶抑制剂和细胞周期蛋白依赖性激酶4/6抑制剂等[124-125]。当合并低钾血症或低镁血症等电解质紊乱、遗传性长QT综合征以及使用其他可能延长QT间期的药物(如部分抗生素、止吐药物)时,QT间期易出现延长。在开始治疗前和治疗期间应及时纠正任何电解质失衡,并应定期监测ECG是否有 QT 间期延长和其他心律失常。
4.3 生物标志物
4.3.1 肌钙蛋白
心肌肌钙蛋白T(cardiac troponin T,cTnT)和心肌肌钙蛋白I(cardiac troponin I,cTnI)是心脏特有的结构蛋白,是心肌损伤的特异性生物标志物。急性心肌梗死、急性心肌炎发生时会导致cTnT/cTnI 显著升高。然而除了心肌梗死、心肌炎外,还有多种原因可导致心肌损伤,而引起cTnT/cTnI小幅度升高,则需要进行鉴别诊断和病因分析[126-128]。
4.3.2 利尿钠肽(natriuretic peptid,NP)
血中BNP/NT-proBNP是目前最有价值的心衰诊断标志物,可用于多种类型心衰诊断:无症状性心衰、慢性失代偿性心衰、急性失代偿性心衰。BNP/NT-proBNP是急性心衰最重要的生物标志物,具有极高的敏感性和阴性预测价值。BNP<100 pg/mL和NT-proBNP<400 pg/mL是排除急性失代偿性心衰的可靠标准。但其特异性较差,多种临床情境可导致其上升:高龄、ACS、肾功能不全、房颤、肺高压、急性肺栓塞、贫血、脓毒血症、二尖瓣反流及应用特定药物(rhBNP、ARNI)等,因此,其用于诊断心衰的界值较难确定,目前认为BNP>400 pg/mL或NT-proBNP大于各年龄层界值应警惕心衰发生。
4.4 放射性核素显像
有一定的辐射暴露,LVEF可以较准确地评估局部室壁运动,可重复性好,但不能显示瓣膜的状况,对早期的心脏损伤敏感性较差。
4.5 心脏磁共振成像(MRI)
应费用稍贵而使其临床应用受限,但对心肌损伤的评估有临床价值,是其他检查项目的有益补充。在超声心动图检查存在疑问或患者胸壁厚、合并有COPD使得超声检查条件受限、且图像不理想时,心脏 MRI 可以考虑作为高危人群的检查方法,因为MRI可以提供心脏解剖、收缩功能和舒张功能的详细信息且没有辐射损伤。
4.6 心内膜心肌活检(endomyocardial biopsy,EMB)
是目前公认的评估蒽环类药物心脏毒性最敏感、最特异的方法,但EMB为有创性检查,对操作技术的要求高,临床应用受到极大的限制。蒽环类药物导致的心肌病活检样本具有特征性改变,若以活检组织细胞受累范围为基础对心脏毒性进行分级,1分和3分分别代表<5%和>35%的细胞受累[129]。具体评分标准为:0(正常范围)、1(5%细胞有早期组织学改变,早期心肌纤维消失和细胞质空泡化)、1.5[5%~ 15%的细胞显著心肌纤维消失和(或)细胞质空泡化]、2(16%~ 25%的细胞心肌纤维消失和细胞质空泡化)、2.5(26%~ 35%的细胞心肌纤维消失和细胞质空泡化)、3(>35%的细胞心肌纤维消失和细胞质空泡化,收缩纤维完全消失,细胞器消失,细胞核变性)。
5 生活方式与心脏毒性关系及全程管理
吸烟、肥胖、冠心病、原发性高血压、糖尿病和血脂异常是接受蒽环类药物和(或)曲妥珠单抗患者发生心功能不全的危险因素,其中以原发性高血压最为明显。存在两个及以上高危因素的患者出现心脏毒性的可能性非常高[130-131]。研究[132]表明,年龄是心脏毒性风险的独立危险因素,年龄≥60岁心脏受累的风险明显增加。如LVEF为50%~ 55%、有心肌梗死病史、有心衰病史或合并心脏瓣膜病的患者接受有心脏毒性的抗肿瘤药物治疗后出现心功能不全的风险增加3.6~ 11.8倍[133]。心脏毒性风险高的患者应该避免蒽环类药物的使用,对于需要使用蒽环类药物的患者,在应用过程中建议早期监测和积极预防心脏毒性。
临床医师在启动抗肿瘤治疗前应详细询问病史,进行全身体格检查,治疗过程中出现心功能不全的症状或体征时则需通过超声心动图明确诊断;如因主观或客观原因无法行超声心动图检查,可选用心脏核磁共振检查或核素扫描,首先推荐 MRI;血清心脏标志物(肌钙蛋白和脑钠肽)以及超声心动图应作为常规的监测方法,视检查结果决定是否请心脏病专科医师会诊;在治疗过程中出现心功能不全的危险因素时,应该常规行影像学监测,监测频率由临床医师通过患者的情况和临床检测结果来决定;对于出现心功能不全的患者是否继续抗肿瘤治疗,目前尚无推荐。肿瘤科医师应该在与心脏科医师充分评估患者临床病情和权衡继续抗肿瘤治疗所带来的利弊之后再作决定。
考虑到与治疗相关的心脏毒性和心功能不全往往发生在治疗后1年之内,因此肿瘤患者在治疗结束后6~ 12个月建议进行影像学检查,评估患者的心功能[134]。筛查和积极管理心血管危险因素(如吸烟、高血压、冠心病、糖尿病、血脂异常、缺乏身体活动、肥胖)可以改善癌症幸存者的长期心脏病预后,健康的生活方式,包括饮食和运动的干预,可作为癌症幸存者长期随访护理的一部分[135-136]。
6 展望
在乳腺肿瘤心脏病学领域,如何防治癌症治疗相关性心功能不全是一个需要肿瘤科医师和心脏科医师共同关注,即需要多学科交叉研究的新兴领域。在癌症初始治疗前需评估心血管病危险因素,为获得最佳临床结局需在癌症治疗方案与心血管病监测策略之间达成平衡[137]。对于具有较高心血管病风险的患者,需通过饮食、运动、药物等多种干预措施以降低心功能不全的风险。目前研究发现血管紧张素转化酶抑制剂(angiotensin-converting enzyme inhibitor,ACEI)、血管紧张素受体阻滞剂(angiotensin receptor blocker,ARB)及β受体阻滞剂对乳腺癌治疗相关性心功能不全的预防及治疗方面有一定作用[138-142],但药物剂量与用药时机选择以及如何选择合适预防人群等方面还不清楚,需要进行更大规模的临床试验加以验证[143]。在如何识别抗癌治疗者之中的心血管事件高风险人群方面目前缺乏有效的方法,建立合理的风险评估量表也许是不错的研究方向。针对癌症患者心血管高风险人群,可联合心脏影像学及心脏生物标志物检查以尽早发现异常,及时进行心脏保护,改善预后[112,136]。乳腺癌放射性心脏疾病目前缺乏有效的治疗方法,但随着放疗技术及放疗防护技术的快速发展,给预防和控制放射性心脏疾病带来了新的希望,今后放疗心脏损伤风险评估与个体化预防是研究的主要方向。随着免疫治疗在乳腺癌患者中广泛使用,预计在未来,免疫治疗相关性心脏毒性反应的发生率会有增长,目前关注的重点是免疫检查点抑制剂相关性心肌炎,而免疫治疗相关性血栓性疾病、心包炎、心律失常也是今后需要予以关注的。
7 结语
本共识首先对乳腺癌相关心脏病学这一概念进行了明确的定义,之后以近年来相关询证医学证据为核心,横向拓展、纵向深化,全方位阐述乳腺癌相关的心脏病诊断及管理策略,基于各领域的专家推荐管理模式深入细化到乳腺癌的不同治疗方案,推荐更加个体化、临床可操作性更强。在危险因素评估方面,提出了更全面的心血管健康状态及危险分层策略,且首次提出肿瘤手术前心血管疾病风险因素。在随访及检测方面,本共识结合患者危险度分层及肿瘤治疗方案,提出了乳腺癌诊疗相关心血管毒性全程管理流程,为制定个体化的随访监测勾勒出了切实可行的流程图。
随着临床证据的不断积累,乳腺癌心脏毒性反应的预防和管理策略日益清晰,较前取得了明显的进展,但如何在乳腺癌患者抗肿瘤治疗[144]与心脏保护方面实现个体化治疗,平衡抗肿瘤治疗的风险与获益,最大程度地降低对心血管健康潜在的不利影响,仍需进行更多的临床实践与研究。
致谢
中国乳腺癌相关心脏病诊疗共识编写委员会,上海市抗癌协会肿瘤心脏病学专家委员会(筹)。
利益冲突声明:所有作者均声明不存在利益冲突。本文作者承诺:作者间、作者与审稿人间、与指南/共识中出现的药物或器械厂商之间无利益冲突;本共识制定过程中无第三方进行赞助。
证据登记:参考文献的证据等级见附录Ⅰ。
附录Ⅰ
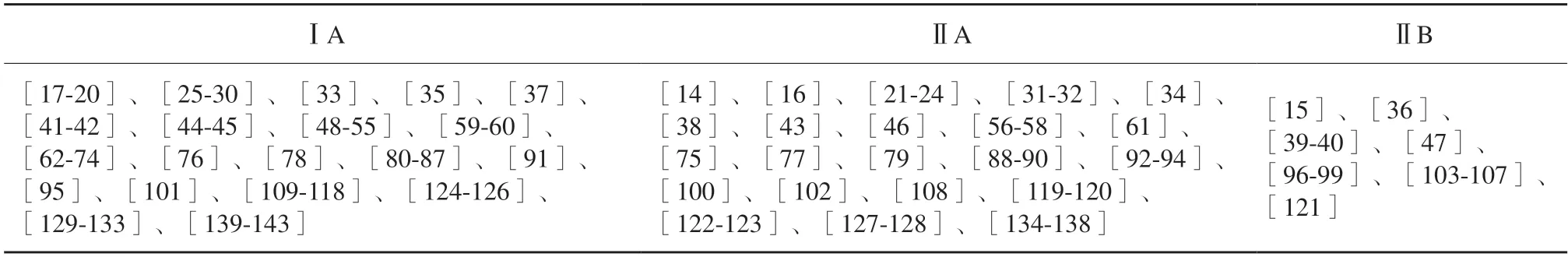
参考文献证据等级
中国乳腺癌相关心脏病诊疗共识(2022年版)
顾 问
邵志敏 复旦大学附属肿瘤医院
专家组组长
沈 赞 上海交通大学附属第六人民医院
副组长(按姓氏拼音排序)
李 悦 哈尔滨医科大学附属第一医院
马 飞 中国医学科学院肿瘤医院
王晓稼 中国科学院大学附属肿瘤医院
夏云龙 大连医科大学附属第一医院
专家组成员(按姓氏拼音排序)
鲍萍萍 上海交通大学附属第六人民医院(流行病学专家)
陈占红 中国科学院大学附属肿瘤医院
方凤奇 大连医科大学附属第一医院
葛 睿 复旦大学附属华东医院
何爱娜 上海交通大学附属第六人民医院
刘海霞 重庆大学附属肿瘤医院
刘基巍 大连医科大学附属第一医院
刘 莹 大连医科大学附属第一医院
马金利 复旦大学附属肿瘤医院
邵 群 哈尔滨医科大学附属肿瘤医院
臧远胜 海军军医大学第二附属医院
张 梅 山东大学齐鲁医院
张宇辉 中国医学科学院阜外医院
钟巧青 中南大学湘雅医院
特邀指导专家(按姓氏拼音排序)
卜 军 上海交通大学医学院附属仁济医院
范 江 上海交通大学附属第一人民医院
李鹤成 上海交通大学医学院附属瑞金医院
汪 成 上海交通大学医学院附属第九人民
医院黄浦分院
张 剑 复旦大学附属肿瘤医院
秘书组(按姓氏拼音排序)
安 涛 中国医学科学院阜外医院
段晓鹏 海军军医大学第二附属医院
高绰妍 三度医学(编辑学专家)
胡师慧 复旦大学附属肿瘤医院
黄 平 中国科学院大学附属肿瘤医院
刘斌亮 湖南省肿瘤医院
刘晓玲 山东大学齐鲁医院(方法学/循证医学专家)
龙 波 重庆大学附属肿瘤医院
余文熙 上海交通大学附属第六人民医院
翟 玫 中国医学科学院阜外医院
