Circ-0003910在HER2阳性乳腺癌中的表达、定位、生物学作用及蛋白质组学研究
2022-11-27刘嘉慧孙朝晖李林海
朱 艺,肖 斌,刘嘉慧,黄 玲,孙朝晖,李林海
1.广州医科大学附属第六医院,清远市人民医院检验医学部,广东 清远 511500;2.中国人民解放军南部战区总医院检验科,广东 广州 510000;3.玉溪市中心血站,云南 玉溪 653100;
乳腺癌是女性最常见的恶性肿瘤,是女性癌症死亡的主要原因。2020年全球最新癌症负担数据显示,乳腺癌已成为全球发病率最高的癌症[1]。乳腺癌可根据雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)的表达情况及Ki-67增殖指数进行分子分型,其中HER2阳性型乳腺癌恶性程度高,易转移,易复发,预后差,是乳腺癌治疗的重点和难点[2-3]。HER2能够影响PI3K/Akt和Ras/Raf/MEK/MAPK等信号转导通路,并且HER2阳性乳腺癌中波形蛋白(vimentin)、转录因子Slug、转录因子Twist表达明显高于癌旁组织,钙黏蛋白E(E-cadherin)的表达明显低于癌旁组织,提示HER2阳性乳腺癌细胞更容易发生上皮-间质转化(epithelial-mesenchymal transition,EMT)相关进程[4],该型乳腺癌细胞更常出现转移和浸润等。为了改善HER2阳性乳腺癌的治疗现状,有必要研究和探讨HER2阳性型乳腺癌发生、发展的分子机制。
环状RNA(circular RNA,circRNA)是一种内源性非编码RNA,普遍存在于真核细胞转录组中,与基因表达调控[5]、信号转导机制等细胞进程密切相关[6]。CircRNA的表达失调在胃癌[7]、肝癌[8]、肺癌[9]等多种肿瘤中发挥重要的调控作用。乳腺癌的发生、发展也与circRNA的表达异常相关,许多研究[10-11]证实circRNA能够通过多种机制影响肿瘤细胞转移。Circ-CCDC9可吸附miR-6792-3p,与微囊蛋白1(caveolin-1,CAV1)形成分子海绵调节网,抑制胃癌细胞的增殖、迁移和侵袭,从而抑制胃癌的进展,因此circ-CCDC9是胃癌的新型生物标志物和治疗靶点[12]。Circ-TADA2A-E6是三阴性乳腺癌(triple-negative breast cancer,TNBC)的抑癌基因,在TNBC中呈显著低表达,能够正向调节靶基因细胞因子信号转导抑制蛋白-3(suppressor of cytokine signaling 3,SOCS3)的表达,从而削弱乳腺癌的侵袭性[13],但circRNA在HER2阳性型乳腺癌细胞中的作用机制仍不清楚。
本研究以高通量circRNA芯片为切入点,重点关注circ-0003910在乳腺癌组织和细胞中的表达水平,探究circ-0003910的表达与乳腺癌细胞迁移和侵袭的关系,通过蛋白质组学鉴定circ-0003910调控的分子网络,为HER2阳性型乳腺癌的诊断与治疗提供一定的指导依据。
1 材料和方法
1.1 细胞和试剂
人正常乳腺上皮细胞(MCF-10A)和人乳腺癌细胞系(MDA-MB-231、MCF-7、BT-474,SK-BR-3,UACC-812)购自中国科学院典型培养物保藏委员会细胞库,DMEM、RPMI-1640、Opti-MEM培养基及胎牛血清购自美国Gibco公司,MCF-10A专用培养基购自武汉普赛诺生命科技有限公司,1%青链霉素混合液购自北京索莱宝科技有限公司,Lipofectamine™3000购自美国ThermoFisher公司,SYBR Green染料试剂盒和PrimeScript RT试剂盒购自宝生物工程(大连)有限公司。过表达circ-0003910 pSin-puro质粒由江西南昌聚焦生物科技有限公司构建。Circ-0003910的siRNA、RNA荧光原位杂交(fluorescencein situhybridization,FISH)试剂盒与探针购自广州锐博生物科技有限公司,BaseScope二代红色试剂盒(323900)购自美国ACD公司,139例乳腺癌组织芯片(HBreD139Su01)及90例正常乳腺组织芯片(HBre-Duc090Sur-01)购自上海芯超生物科技有限公司。
1.2 CircRNA芯片实验
提取4种乳腺癌细胞系的总RNA,反转录成cDNA后进行荧光标记,并进行标记效率质检,质控合格后进行芯片杂交。采用Agilent Scanner G2505C扫描仪扫描芯片,使用Agilent Feature Extraction(11.0.1.1版本)采集图像,并读取数值。经归一化和后续数据处理后,使用散点图和差异倍数筛选出两组间差异表达倍数大于2(fold change>2)circRNA。P<0.05为差异有统计学意义。
1.3 细胞培养
MDA-MB-231、MCF-7、SK-BR-3、UACC-812用DMEM培养,BT-474用RPMI-1640培养,正常乳腺上皮细胞MCF-10A用MCF-10A专用培养基培养,均在培养基中加入10%胎牛血清和1%青链霉素混合液。细胞置于37 ℃、CO2体积分数为5%培养箱中,隔天换液,细胞汇合度达到80%~ 90%时传代。
1.4 FISH实验
SK-BR-3细胞爬片后用4%多聚甲醛固定20 min,预冷的0.5%Triton X-100通透细胞,37 ℃探针预杂交以及探针杂交。采用DAPI进行细胞核DNA染色20 min后挑片,根据玻片大小用适量抗荧光淬灭剂封片,避光置于荧光显微镜下观察和拍照。
1.5 BaseScope实验
139例乳腺癌患者的手术时间从2001年1月—2004年8月,随访周期9.0~ 12.5年,最长随访时间至2013年7月,芯片附带有每个样本的ER、PR、HER2与Ki-67的免疫组织化学检测数据。首先将组织芯片进行烤片60 min,随后二甲苯与无水乙醇脱蜡20 min;经双氧水处理10 min后,用现配的靶标修复试剂在98~ 102 ℃缓慢沸腾进行靶标修复15~ 30 min,再用蛋白酶处理15~ 30 min;芯片用APM1-8试剂覆盖温育,进行信号放大,再用50%苏木精染液染色2 min;蒸馏水清洗后用现配的0.02%氨水复染玻片;再次用蒸馏水清洗并烘干,根据组织芯片大小用适量VectaMont封片液进行封片,最后扫描全片。在实验过程中,因部分组织脱落,实际可检测乳腺癌组织131例和乳腺正常组织82例,乳腺癌组织根据芯片已有的免疫组织化学结果分型,其中三阴性组织32例,luminal A型组织47例,luminal B型组织26例,HER2阳性型组织26例。运用QuPath软件分析各组织信号强度,用GraphPad Prism 8对信号强度进行统计学分析。在生存分析中,以信号值≥2作为circ-0003910高表达组(25例),信号值<2作为circ-0003910低表达组(106例)。
1.6 Transwell实验
消化细胞并离心后,弃上清液;细胞用1 mL无血清培养基重悬并计数。在transwell小室的下室加入500 μL完全培养基,用200 μL无血清培养基重悬20万细胞并加入transwell小室的上室,保证细胞分布均匀;将transwell小室置于37 ℃、CO2体积分数为5%的温箱中温育24 h。次日,甩干净小室内培养基后用多聚甲醛固定,结晶紫染色,待干燥后用中性树胶和盖玻片封片。显微镜下进行观察及拍摄,采用Image J软件分析迁移细胞数量。
1.7 实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)
用TRIzol试剂盒(购自加拿大Invitrogen公司)提取细胞总RNA,分光光度仪测总RNA 浓度。用Prime ScriptRT试剂盒反转录合成cDNA。以GAPDH作为内参,在BIORAD荧光定量PCR仪上利用SYBR Green染料试剂盒检测待测基因的表达水平。反应条件:95 ℃ 30 s;GOTO:39(40 个循环),95 ℃,5 s;熔解曲线。circ-0003910上游引物5'-GCTATAAGCTTCTTGAAGGCAG AG-3',下游引物5'-TTGCTTGGTTTTGCAGTAGATAC TT-3'。GAPDH上游引物5'-GAACGGGAAGC TCACTGG-3',下游引物5'-GCCTGCTTCACC ACCTTCT。
1.8 TMT蛋白质组学鉴定
弃掉细胞培养基,加入4 ℃预冷PBS,平放轻轻摇动洗涤细胞1 min,弃PBS,重复洗涤2次。在冰上加入预冷的PBS,用细胞刮将细胞刮于培养皿一侧,吸取液体至预冷的离心管内,离心去上清液后液氮速冻。由上海中科新生命公司完成质谱分析。
1.9 GO分析和KEGG分析
用DAVID(https://david.ncifcrf.gov/)在线网站对这些蛋白进行功能分类注释,并进行功能富集分析。
1.10 统计学处理
运用GraphPad Prism 8进行统计学分析和作图。对于两组定量资料分析比较,若满足正态分布,且满足方差齐性,采用独立样本t检验,以表示;只满足正态分布,不满足方差齐性,采用Welch’s校正非配对t检验,以表示;不满足正态分布,则采用Mann-WhitneyU检验,用中位数和四分位数间距表示。生存分析采用Kaplan-Meier法。P<0.05为差异有统计学意义。
2 结 果
2.1 Circ-0003910在HER2阳性乳腺癌细胞系中表达上调
为了筛选在HER2阳性乳腺癌细胞中高表达的circRNA,本研究整合了SK-BR-3细胞(HER2阳性型)、MDA-MB-231细胞(三阴性型)、MCF-7细胞(luminal型)和MCF-10A细胞(正常乳腺上皮细胞)的标准化circRNA芯片表达数据(图1),根据circBase数据库注释所得circRNA的名称,计算差异倍数,纳入差异倍数绝对值大于2的circRNA(fold change>2,P<0.05)。在HER2阳性型乳腺癌细胞组(SK-BR-3)与正常乳腺上皮细胞组(MCF-10A)比较中获得上调的circRNA 845个,下调的circRNA 998个;在三阴性乳腺癌细胞组(MDA-MB-231)vs正常乳腺上皮细胞组(MCF-10A)中获得上调的circRNA共938个,下调的circRNA共1154个;在luminal型乳腺癌细胞组(MCF-7)vs正常乳腺上皮细胞组(MCF-10A)中获得上调的circRNA 973个,下调的circRNA共793个(图2)。排除在三阴性乳腺癌细胞组和luminal型乳腺癌细胞组中同样上调或下调的差异表达circRNA,获得仅在HER2阳性型乳腺癌细胞组中差异表达倍数大于2(fold change>2,P<0.05)的circRNA,共889个,其中上调515个,下调374个。其中circ-0003910的差异表达倍数为24.39,引起我们的关注。我们通过RTFQ-PCR检测了circ-0003910在正常乳腺上皮细胞MCF-10A和5种乳腺癌细胞MDA-MB-231(三阴性型)、MCF-7(luminal A型)、BT-474(luminal B型)、SK-BR-3(HER2阳性型)、UACC-812(HER2阳性型)中的表达量,结果表明circ-0003910在HER2阳性乳腺癌细胞(UACC-812、SK-BR-3)中表达显著上调(图2H)。为了明确circ-0003910的亚细胞定位,我们在SKBR-3细胞中进行了FISH实验,结果表明,circ-0003910定位于HER2阳性型乳腺癌细胞质和细胞核,但主要定位于细胞质(图2I)。

图1 circRNA芯片荧光扫描图Fig.1 Fluorescence scan of circRNA microarraies
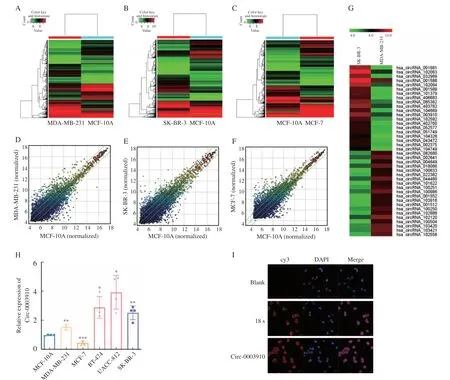
图2 Circ-0003910在HER2阳性乳腺癌细胞中表达上调Fig.2 Circ-0003910 was up-regulated in HER2 positive breast cancer cells
2.2 Circ-0003910在乳腺癌组织中的表达与患者预 后
为了明确circ-0003910在乳腺癌组织中的表达水平和定位,本研究通过BaseScope实验检测circ-0003910在131例乳腺癌组织和82例正常乳腺组织中的表达水平。实验结果表明,circ-0003910分布于细胞质和细胞核,但主要定位于细胞质,与FISH实验结果一致(图3A)。与正常组织相比,高表达circ-0003910的样本更多分布于乳腺癌组织,但两组相比差异无统计学意义(图3B)。在不同分子分型的乳腺癌组织样本中,高表达circ-0003910主要分布于HER2阳性乳腺癌组织,其表达量与luminal A型乳腺癌组织相比差异有统计学意义(P<0.05),但与其他分子分型差异无统计学意义(图3C)。Kaplan-Meier生存分析表明,高表达circ-0003910提示乳腺癌患者的预后可能更差,生存曲线无交叉(P=0.0559,图3D)。
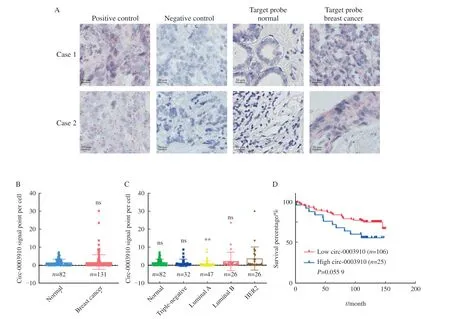
图3 Circ-0003910在乳腺癌组织中的表达与预后Fig.3 Expression and prognosis of circ-0003910 in breast cancer tissues
2.3 Circ-0003910在体外促进乳腺癌细胞迁移和侵袭
为了探讨circ-0003910在乳腺癌细胞中的生物学功能,本研究在circ-0003910相对表达量较低的MDA-MB-231细胞中瞬时转染circ-0003910过表达质粒及其对照质粒,另在circ-0003910相对表达量较高的SK-BR-3细胞中用siRNA敲低circ-0003910,用RTFQ-PCR验证circ-0003910的过表达和敲低细胞模型构建成功。肿瘤转移是癌症致死的主要原因之一[14],推测过表达(敲低)circ-0003910可能影响乳腺癌细胞的迁移和侵袭能力。Transwell迁移和侵袭实验表明,过表达circ-0003910能够促进MDA-MB-231细胞的迁移和侵袭,沉默circ-0003910则抑制SK-BR-3细胞迁移和侵袭(图4)。
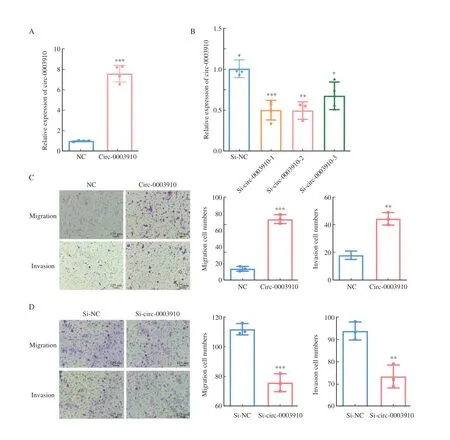
图4 Circ-0003910在体外促进乳腺癌细胞迁移和侵袭Fig.4 Circ-0003910 promotes breast cancer cell migration and invasion in vitro
2.4 高表达circ-0003910影响的蛋白质组学调控网络及差异蛋白的功能富集分析
为了确定circ-0003910可能通过哪些蛋白影响乳腺癌细胞的迁移和侵袭,本研究采用circ-0003910内源性相对表达量较低的MCF-7细胞构建了稳定过表达circ-0003910的细胞及其对照组细胞,并进行蛋白质组学定量分析,筛选显著性差异表达蛋白质。以差异表达倍数FC>1.2倍(上调大于1.2倍或下调小于0.83倍)且P<0.05为标准,筛选出104个蛋白质在过表达circ-0003910细胞中上调,93个蛋白质下调。对197个差异表达蛋白质进行了GO分析和KEGG分析。GO分析中的生物学过程(biological process,BP)显示,差异表达蛋白参与了细胞增殖、染色质的组装和调控、核小体的组装、蛋白质-DNA复合体的装配及炎症刺激相关反应等;细胞学组分(cellular component,CC)显示,差异表达蛋白主要位于染色体中的蛋白、蛋白质-DNA复合体、宿主细胞组分等;分子生物学功能(molecular function,MF)分析显示,差异表达蛋白质主要参与染色质及核小体DNA的结合、双链DNA形成及弯曲、蛋白质二聚化等进程(图5)。
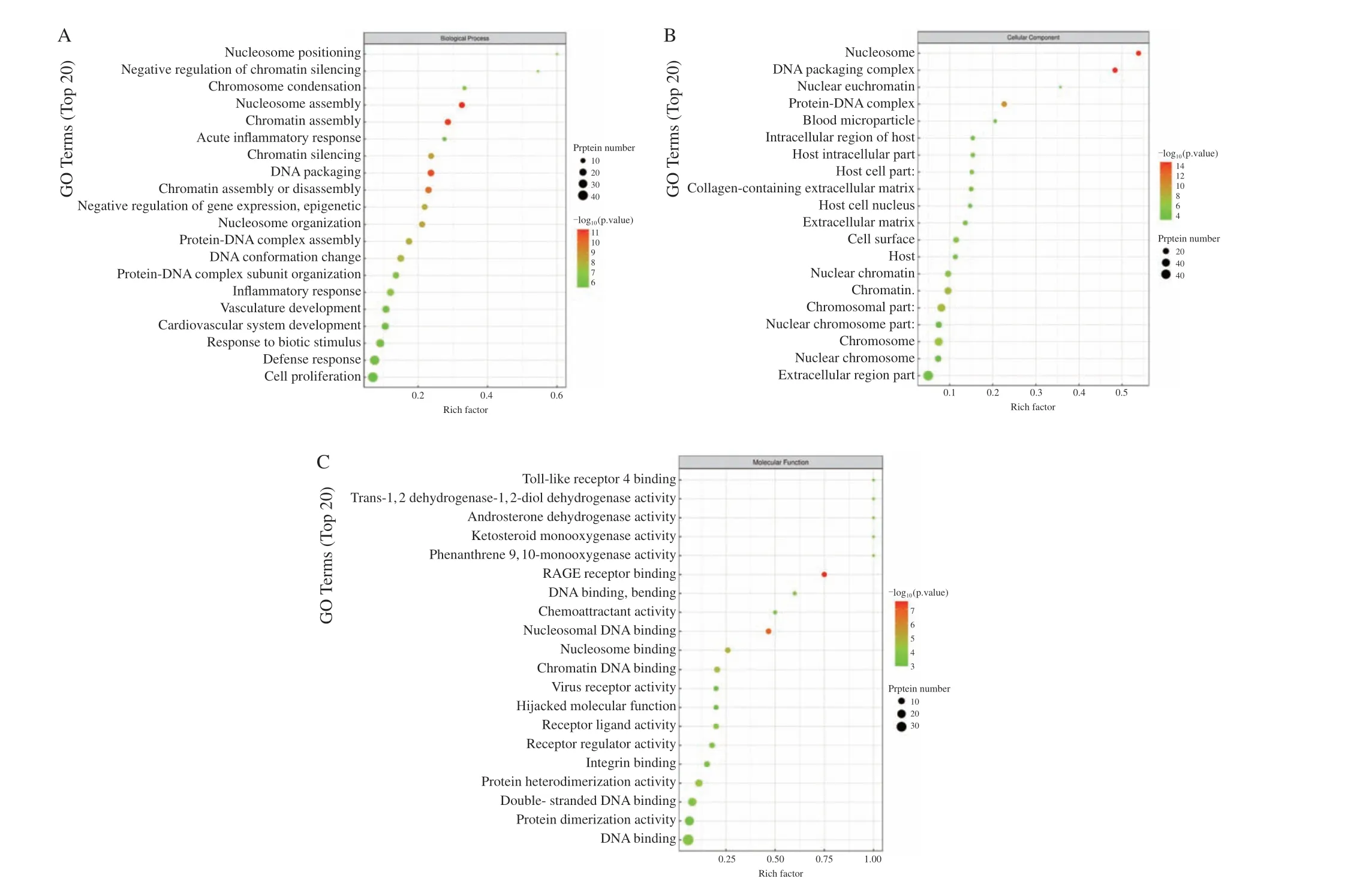
图5 Circ-0003910影响下游差异表达蛋白GO富集分析Fig.5 GO enrichment analysis of downstream differentially expressed proteins affected by circ-0003910 overexpression
KEGG信号转导通路分析表明,差异表达蛋白主要富集于与肿瘤转移显著相关的细胞黏附分子合成(包括整联蛋白家族的ITGB1、ICAM1和L1CAM)和参与癌症转录失调的组蛋白和转录因子(包括H3C15、H3C1和DDIT3)等(图6)。

图6 Circ-0003910影响下游差异表达蛋白KEGG富集分析Fig.6 KEGG enrichment analysis of downstream differentially expressed proteins affected by circ-0003910
3 讨 论
乳腺癌是一种威胁全球女性健康的肿瘤,发病率逐年上升,中国是全球乳腺癌发病例数最多的国家,并且乳腺癌患者呈现低龄化趋势[15]。HER2阳性型乳腺癌占所有乳腺癌病例数的15%~ 20%,其复发率高、淋巴结转移和脑转移概率高、内分泌治疗反应性低并且预后较差。寻找新的生物标志物用于早期诊断和及时治疗,是提高乳腺癌患者生存率与生存质量的关键。
目前,circRNA相关研究主要报道了其可以作为miRNA海绵,与RNA结合蛋白(RNA binding protein,RBP)相互作用,参与蛋白质翻译或直接调控靶基因等作用[16]。CircRNA具有共价闭合的环状结构、能够避免RNase R的降解、比线性RNA更加稳定、有明显的物种间保守性和组织特异性等特征[17-18],具有成为理想的肿瘤早期诊断、个体化治疗及预后评估的分子标志物的潜力。本研究通过circRNA芯片技术筛选出在HER2阳性乳腺癌细胞系中差异表达circRNA,其中circ-0003910在HER2阳性乳腺癌细胞中显著高表达,且主要定位于细胞质,提示其可能参与下游蛋白的表达调控。Basescope实验验证了其在HER2阳性乳腺癌组织中明显高表达。更重要的是,circ-0003910表达量与预后虽无显著相关性,但P值为0.0559,已接近临界值0.05,提示高表达circ-0003910的乳腺癌患者预后可能更差。此外,本研究通过构建circ-0003910过表达和敲低的乳腺癌细胞株进行体外实验,发现circ-0003910能够促进乳腺癌细胞的迁移和侵袭。以上结果表明,circ-0003910是乳腺癌转移的驱动基因,可能是乳腺癌患者的预后预测因子。
BaseScope的实验流程分为切片准备、RNA杂交、信号放大和成像4个环节。BaseScope基于信号放大和背景抑制技术[19],将组织样本中的单个RNA可视化呈现,该实验技术拥有高灵敏度、高特异性和高信噪比的优点,并且与PCR、免疫组织化学检测结果都有很好的一致性。在本研究中,阳性信号探针和阴性对照组的染色结果均符合预期,表明实验过程无问题。实验组染色结果显示,circ-0003910仅在部分乳腺癌组织中高表达,而在正常乳腺组织中circ-0003910几乎不表达,推测circ-0003910的表达水平可能在特定乳腺癌样本类型中受到特定顺式作用元件的调控。
circRNA可通过作为分子海绵、蛋白质支架和诱饵等方式影响下游靶蛋白的表达[20]。本研究绘制了高表达circ-0003910后的乳腺癌细胞蛋白质组学图谱。GO分析结果表明,受circ-0003910调控的蛋白质主要参与染色质、DNA的构象、组装、结合、基因表达与沉默的负调控等进程。在KEGG分析中,我们发现与细胞黏附相关的整联蛋白家族成员,包括ITGB1、ICAM1和L1CAM均显著高表达。β1整联蛋白(integrin beta 1,ITGB1)为整联蛋白家族成员,可以和α亚基结合形成12种整联蛋白受体,与胶原蛋白、层黏连蛋白和纤维连接蛋白等多种细胞外基质成分结合[21],在细胞黏附和迁移中起重要作用[22]。细胞间黏附分子-1(intercellular cell adhesion molecule-1,ICAM1)是乳腺癌转移的新靶点,可通过激活与细胞周期和细胞干性相关的信号转导通路而促进肿瘤转移。阻断同源性ICAM1相互作用可以显著抑制循环肿瘤细胞簇的形成、内皮迁移和肺转移[23-24]。L1-细胞黏附分子(L1-cell adhesion molecule,L1CAM)在多种恶性肿瘤中高表达,能够促进肿瘤细胞运动性和迁移能力,并且常与不良预后相关[25]。在乳腺癌中,L1CAM及其可溶性形式可促进细胞与细胞外基质的黏附和迁移能力[26]。鉴于上述差异表达蛋白质在肿瘤转移中的重要作用,circ-0003910可能通过调控这些蛋白质的表达进而影响HER2阳性乳腺癌细胞的迁移和侵袭。在后续研究中,我们将围绕circ-0003910如何影响整联蛋白相关蛋白的表达,影响细胞黏附和细胞迁移的分子机制进行深入探索。
综上,circ-0003910在HER2阳性乳腺癌细胞和乳腺癌组织中呈高表达,影响与肿瘤转移密切相关蛋白质的表达水平,促进乳腺癌细胞的迁移和侵袭,发挥致癌基因效应。circ-0003910可能是HER2阳性乳腺癌新的生物标志物和抗肿瘤转移治疗的靶点。
利益冲突声明:所有作者均声明不存在利益冲突。
