酮体β-羟基丁酸减轻癫痫持续状态模型大鼠离体海马神经元的损伤
2022-11-26耿俊红凌云张青王宝辉侯群蒋艳
耿俊红 凌云 张青 王宝辉 侯群 蒋艳
癫痫持续状态(status epilepticus,SE)可导致神经元丢失、胶质细胞增生和神经网络的重组,因此寻找一种能阻止癫痫发作后神经元损伤的治疗手段阻止癫痫的进一步形成或症状的恶化,具有重要意义。β-羟丁酸(β-hydroxybutyric acid,BHB)是生酮饮食(ketogenic diet,KD)的主要代谢产物,具有抗癫痫和神经保护作用。研究发现,BHB能够通过抑制活性氧簇和神经元凋亡对脑部相关疾病起作用,但是否对SE所致的海马神经元损伤具有保护作用,尚未完全清晰。本研究采用体外培养大鼠海马神经元,通过无镁灌流构建SE模型,采用MTT法检测细胞死亡,采用流式仪检测细胞活性氧簇(reactive oxygen species,ROS),以期为BHB的神经保护机制研究提供实验依据。
1 材料与方法
1.1 动物及主要试剂 出生24 h内的SPF级新生SD大鼠90只,雌雄不限,由上海斯莱克实验动物有限责任公司【SCXK(沪)2012-0002】提供,于浙江中医药大学实验动物中心细胞实验室进行实验操作。所有动物实验均严格按照浙江中医药大学实验动物伦理规定,实验过程中,按实验动物使用的3R原则给予人道主义关怀。β- 羟丁酸(BHB)、MgCl2、NaCl、KCl、HEPES、CaCl2、葡萄糖、甘氨酸、多聚L赖氨酸购于美国Sigma公司,Neurobasal培养基、B27、胎牛血清购于Gibco公司,DMEM/F12(1∶1)培养基、谷氨酰胺(Gln)、0.25%胰酶&0.02%EDTA购于浙江森瑞科技有限公司。ROS检测试剂盒购于上海碧云天生物技术有限公司,PE Annexin V凋亡检测试剂盒购于美国BD公司。
1.2 海马神经元培养 海马神经元培养方法[1]将新生大鼠采用75%酒精清洗后,置于消毒的冰板上。断颈取大脑,分离海马组织,置入事先准备的DMEM/F12+胰酶=1∶1溶液中用枪头充分吹打至无明显团块,放入37 ℃培养箱中孵育,消化20 min后加入含10%胎牛血清的DMEM/F12培养液终止消化,1,000rpm/min离心后,用含10%胎牛血清的DMEM/F12培养液重悬并过200目筛,转至细胞培养瓶中,差速贴壁1.5 h,收获贴壁速度慢的神经元,以2.5×104个/cm2的密度种植于事先用0.1 mg/mL多聚L赖氨酸包被的24孔板中,放入CO2培养箱中培养24 h后全量换液,更换为Neurobasal+2% B27+1% Gln培养基,以后每周2~3次半量换液。隔天在倒置相差显微镜下观察神经元的生长情况。海马神经元的鉴定按试剂盒说明书进行。
1.3 无镁灌流离体癫痫模型及分组 无镁灌流造模方法[2]:神经元维持培养2周后,将维持培养基更换为含不同浓度BHB,但不含1 mmol/L MgCl2的生理记录溶液(physiological recording solution,pBRS),由145 mmol/L NaCl、2.5 mmol/L KCl、10 mmol/L HEPES、2 mmol/L CaCl2、10 mmol/L葡萄糖和0.002 mmol/L甘氨酸组成,pH 7.3,用蔗糖将渗透压调节至(290±10)mOsm。在不含MgCl2(无Mg2+)的情况下将培养的神经元暴露于pBRS会诱导高频癫痫样爆发(SE)。实验总共分5组,包括对照组(含有1 mmol/L MgCl2的pBRS)、无Mg2+处理组(不添加MgCl2的pBRS处理),无Mg2+处理+BHB 2 mmol/L组,无Mg2+处理+BHB 4 mmol/L组,无Mg2+处理+BHB 8 mmol/L组。持续6 h后,将含有1 mmol/L MgCl2的pBRS添加回培养液中,继续培养4 h,进行后续实验。
1.4 MTT法测定神经元活性 所有组别培养细胞均予以MTT法测定细胞活性。将差速贴壁后取得原代海马神经元细胞,调节细胞悬液浓度为2×105/cm3,种植于96孔板,每孔100 μL,每组6个复孔。维持培养14 d,分别给予无Mg2+和不同浓度BHB处理6 h后,给予含有1 mmol/L MgCl2的pBRS维持培养4 h,各孔加入2 mg/mL MTT 50 μL,37℃继续培养4 h,离心后去除上清液,每孔加入150 μL DMSO,震荡至蓝色颗粒全部溶解,用酶标仪在570 nm波长测定其吸光值,可间接反映活细胞数量。目标组细胞活力(%)=目标值OD值/正常对照组OD值×100%。
1.5 流式细胞仪检测凋亡及ROS测定 原代大鼠海马神经元细胞维持培养14 d后,分别给予无Mg2+和不同浓度BHB处理6 h,每组2个复孔,再给予含有1 mmol/L MgCl2的pBRS维持培养4 h。之后将细胞于6孔板中消化,制成细胞悬液,分别进行流式凋亡和ROS测定的制备。流式凋亡检测的制备:PBS清洗两次后,加入1×结合缓冲液调整细胞悬液浓度为1×106个/mL,取100 μL溶液(含1×105个细胞)置于5 mL培养管,加入5 μL PE Annexin V和5 μL 7-ADD,25℃避光孵育15 min,继续加入400 μL 1×结合缓冲液,混匀后于1 h内用流式细胞仪完成测试。流式ROS检测的制备:用无血清DMEM/F12培养液按1∶1,000稀释DCFHDA至终浓度为10 μmol/L。将细胞用PBS清洗后离心,分别用稀释的DCFH-DA和Rosup(试剂盒自带阳性试剂)重悬,37℃培养箱孵育20 min。再用无血清细胞培养液洗涤3次,以不加染料组作为阴性对照,Rosup处理组作为阳性对照,用流式细胞仪进行检测。
1.6 统计学方法 采用SPSS 22.0统计软件。计量资料符合正态分布以()表示,组间数据比较采用单因素方差分析(One-Way-ANOVA),组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 形态学观察 使用荧光倒置显微镜观察神经元,随时间延长,神经元形态变大,突起逐渐增多,互相接触,可以看到清晰的轴突和树突等典型的神经细胞结构特征,见图1。

图1 神经元培养过程中形态学改变(×200)
2.2 MTT法检测细胞死亡 与对照组比较,无镁处理后神经元细胞活力显著下降(P<0.01),给予BHB 2 mmol/L组(P<0.05),4 mmol/L 组(P<0.01)神经元力仍较对照组减低,而BHB 8 mmol/L组和对照组相比无统计学差异(P>0.05)。BHB不同浓度组间比较显示高浓度组(8 mmol/L)较0 mmol/L组,2 mmol/L组,4 mmol/L组细胞活力高,差异有统计学意义(P均<0.01)。见图2。
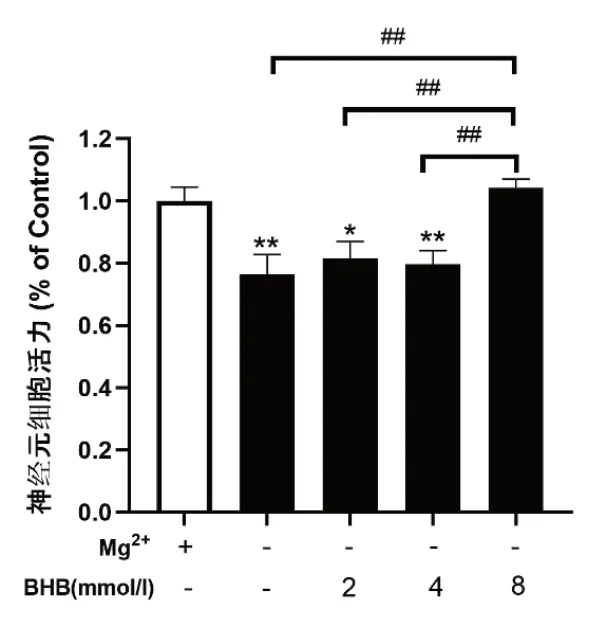
图2 各组神经元细胞活力(n=5)*P<0.05,与对照组比较,**P<0.01,组间比较,##P<0.01
2.3 流式细胞仪检测细胞凋亡 神经元在无镁环境下早期凋亡(P<0.05)、晚期凋亡(P<0.01)及凋亡总数(P<0.01)均增加。加入8 mmol/L的BHB后,早期凋亡及凋亡总数较不加入BHB组下降,差异有统计学意义(P均<0.05)。见图 3。

图3 BHB影响神经元凋亡
2.4 流式细胞仪检测ROS ROS水平在无镁BHB 0 mmol/L组较含镁对照组明显增高(P<0.01),无镁BHB 8 mmol/L组较无镁BHB 0 mmol/L组下降,差异有统计学意义(P<0.05)。见图 4。

图4 各组ROS阳性计数
3 讨论
癫痫是一种不可预测的、反复发作的神经系统疾病,严重危害人类身心健康[3]。KD是一种高脂肪、低碳水化物的饮食,长期以来一直被用作治疗阿尔茨海默病、帕金森病、脑缺血缺氧、难治性癫痫的非药物治疗方法[4],但它的作用机制仍不完全清楚。本研究团队既往的研究显示KD具有明确抗癫痫及减轻认知功能损伤[5]的作用。
BHB是最重要的酮体之一,它被认为很可能是KD的有效作用形式[4]。多项实验性研究认为BHB具有明确的抗癫痫作用[6-7]和神经保护作用。BHB能减少胶质细胞凋亡[8],它能改变神经元GABA转运体的活性,对抗谷氨酸诱导的细胞死亡[9],对AMPK和PPARα存在激活作用[10],还能通过刺激ATP及减少ROS以对抗低血糖导致的神经元损伤[11],此外,在慢性退行性疾病的HT22海马细胞系中,BHB还通过减少氧化应激、改善线粒体功能实现神经保护作用[12]。这些可能的作用机制和KD的神经保护作用存在重要关联。在急性癫痫模型中,BHB能减少匹罗卡品致痫小鼠模型中神经元丢失,促进凋亡通路的主要蛋白表达[10]。在癫痫模型的神经保护方面,BHB减轻癫痫小鼠的神经元损伤[10],减少学习功能缺损[13]。本研究证实在葡萄糖供应正常的情况下,高浓度BHB增加癫痫大鼠海马神经元细胞模型细胞的活力,具有保护神经元作用。流式检测结果直接显示BHB影响无镁灌流模型中神经元细胞凋亡,且8 mmol/L的BHB预处理能降低无镁灌流所致的ROS升高,提示在SE模型中,BHB能影响氧化应激过程。发作后缺氧是癫痫发作后的重要病理生理改变[13],尤其在SE模型中更为明显。升高的ROS水平被认为是癫痫神经元损伤的关键致病因素。BHB可能通过减少ROS的产生,继而减少细胞凋亡,从而起到神经保护的作用。
综上所述,高浓度BHB能增加神经元活力,减少神经细胞凋亡,对SE模型中体外培养海马神经元活性有保护作用,并可能通过影响ROS途径起作用。
