GW1929对于小鼠胆固醇结石的治疗和预防作用及其初步机制研究
2022-11-26吴凌智俞聪聪刘一舟杨秋萍
吴凌智 俞聪聪 刘一舟 杨秋萍
胆固醇结石病是临床上常见疾病之一,也是胆结石病最常见的形式。据相关报道显示,我国胆固醇结石发病率高达8%~10%[1]。作为核内受体转录因子超家族的成员,PPARγ可以调节多种基因表达,在糖脂代谢、炎症反应等关键过程中发挥重要作用[2]。目前已有文献证明,PPARγ也可调节胆盐合成,激动PPARγ通过上调CYP7A1的表达,对调节胆盐合成和胆汁组成起着关键作用[3]。GW1929是一种高效的非噻唑烷二酮、酪氨酸衍生的PPAR-γ高选择性激动剂[4]。本实验拟使用GW1929研究激动PPARγ对小鼠胆固醇生物合成和分解的影响,确认激动PPARγ对小鼠肝脏和小肠组织中HMGCR、CYP7A1、FXR和FGF15表达的调节作用,探究PPARγ作为靶点在胆固醇结石的预防和治疗中的重要意义。
1 材料与方法
1.1 实验动物 选用C57Bl/6J小鼠,购自南京青龙山动物饲养厂(动物合格证号:SCXK(苏):2017-001),于温度(24±2)℃,湿度(60%±5%)的环境中饲养,每日光照时间为7∶00~19∶00,小鼠可以自由获取水和食物,实验开始前适应性饲养1周。
1.2 实验试剂 致石饲料由普通啮齿科饲料中加入1.25%胆固醇,0.5%胆汁盐和15%脂肪制成。熊去氧胆酸胶囊购于德国福克大药厂。GW1929购于MedChemExpress公司。
1.3 动物分组 将60只C57BL/6J小鼠分为正常组、模型组、阳性对照组(熊去氧胆酸30 mg/kg)、GW1929低剂量组(5 mg/kg)、GW1929中剂量组(10 mg/kg)、GW1929高剂量组(20 mg/kg),每组10只,适应环境1周后开始实验。除正常组给予普通啮齿科饲料外,其余各组均给予高脂饲料,造模8周。同时开始给药,按各组剂量每日灌胃给予GW1929、熊去氧胆酸或等量0.9%氯化钠溶液一次。给药8周后,小鼠禁食一晚,从眼眶后静脉丛取血,随后脱颈处死,提取胆囊、肝脏和小肠组织,供后续相关生化指标检测。
1.4 判断小鼠成石情况 处死小鼠后,提取胆囊中的胆汁,在显微镜下涂片观察胆汁中的胆固醇晶体,判断各组小鼠的成石情况。
1.5 小鼠胆汁及血清生化指标 取眼眶后静脉丛血,3,000 g 4℃下离心10 min后,取血清,-20 ℃保存备用。采用相应检测试剂盒检测胆汁中胆汁酸(BA)和胆固醇(CH)的浓度,以及血清中甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)的浓度。
1.6 肝脏和小肠组织生化指标 取小鼠肝脏和小肠组织,使用匀浆器以组织重量(g)∶组织裂解液(mL)=1∶5的比例进行组织匀浆,转移组织匀浆液于离心管中,并于3,000 r/min,4℃下离心30 min后,取上清液,分装后放入液氮中保存备用,整个样品制备过程均在0~4℃条件下进行。通过Western blot方法检测肝脏中HMGCR和CYP7A1以及小肠中FXR及FGF15的蛋白表达水平。
1.7 统计学方法 采用SPSS 20.0统计软件。计量资料符合正态分布以()表示,数据均采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 GW1929对于小鼠胆囊成石的影响 相比于正常组小鼠,模型组小鼠胆汁中的胆固醇结晶显著增多,而阳性对照组和GW1929给药组小鼠胆汁中的胆固醇结晶相较于模型组显著减少,且与GW1929的剂量呈正向相关。
2.2 GW1929对于小鼠胆汁生化指标的影响 各组小鼠胆汁中的BA和CH浓度检测结果如图1所示。相比于正常组,模型组小鼠胆汁中的BA和CH浓度显著增加,而阳性对照组和GW1929给药组小鼠胆汁中的CH浓度显著降低,BA浓度显著增加,差异具有统计学意义(P<0.05)。

图1 各组小鼠胆汁中BA和CH浓度
2.3 GW1929对于小鼠血清生化指标的影响 各组小鼠血清中的LDL-C、HDL-C和TG浓度检测结果如图2所示。相比于正常组,模型组小鼠血清中的LDL-C和TG浓度显著增加,而给予阳性药物和GW1929后,小鼠血清中的TG浓度显著降低,差异具有统计学意义(P<0.05)。而各组小鼠血清中HDL-C浓度未表现出统计学差异(P>0.05)。

图2 各组小鼠血清中LDL-C、HDL-C和TG浓度
2.4 GW1929对于小鼠肝脏组织中HMGCR和CYP7A1表达水平的影响 各组小鼠肝脏组织中相关蛋白的表达水平如图3所示。相比于正常组小鼠,模型组小鼠肝脏组织中的HMGCR和CYP7A1表达水平均显著降低,差异具有统计学意义(P<0.05)。而相比于模型组,阳性对照组和GW1929中、高剂量组小鼠肝组织中的CYP7A1表达水平均显著增加,具有统计学意义(P<0.05)。然而,阳性对照组和GW1929给药组小鼠肝组织中的HMGCR表达水平相比于模型组并未表现出显著变化,且差异不具有统计学意义(P>0.05)。
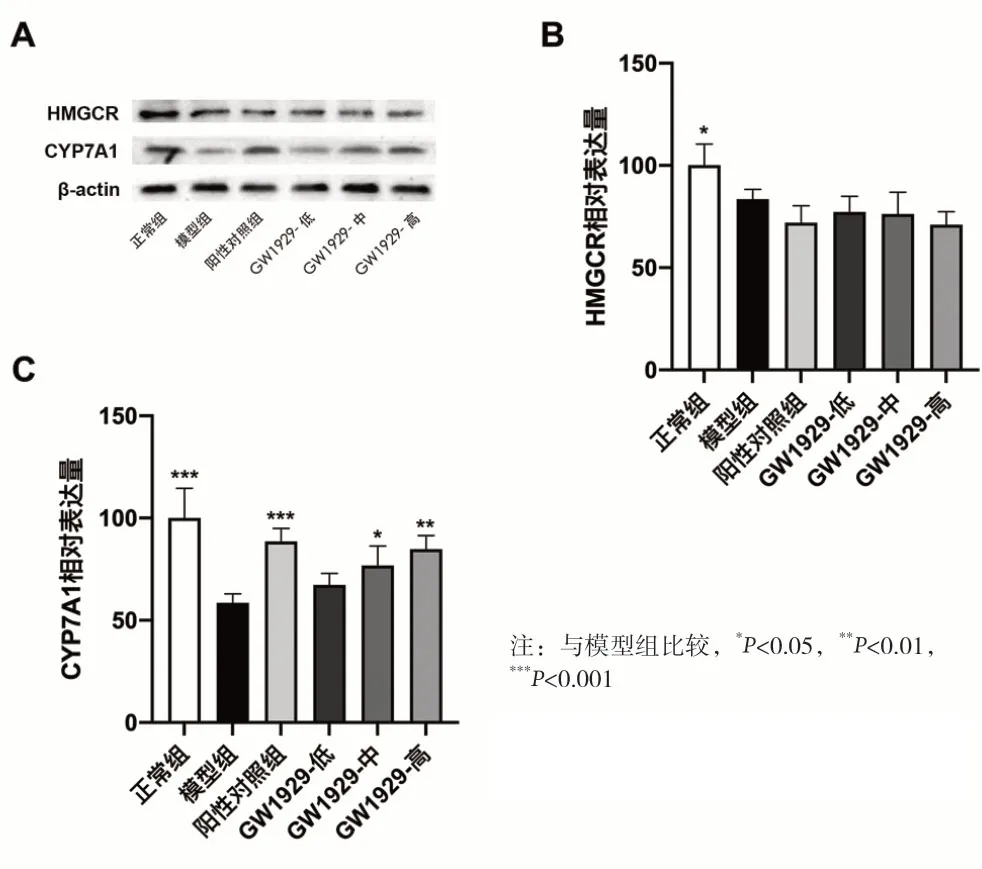
图3 各组小鼠肝脏组织中HMGCR和CYP7A1表达水平
2.5 GW1929对于小鼠小肠组织中FXR及FGF15表达水平的影响 各组小鼠小肠组织中相关蛋白的表达水平如图4所示。相比于正常组小鼠,模型组小鼠小肠组织中的FXR及FGF15表达水平均显著增加,且具有统计学意义(P<0.05)。而给予阳性药物和中、高剂量的GW1929后,小鼠小肠组织中的FXR和FGF15表达水平均相比于模型组均显著降低,且差异均具有统计学意义(P<0.05)。

图4 各组小鼠肠组织中FXR及Fgf15表达水平
3 讨论
胆固醇的生物合成过程包括约30步的酶促反应,其中,HMGCR作为该过程的限速酶,对胆固醇的生物合成发挥着重要的调节作用[5],通过抑制HMGCR的活性,可以有效降低胆固醇的合成。作为胆汁的主要成分,胆汁酸通过其强大的表面活性作用,与胆汁中的胆固醇以及卵磷脂形成溶解状态的胶束,但这一溶解状态依赖于这三者的浓度的平衡,病理状态下这一平衡被打破,导致胆固醇无法维持溶解状态从而析出为结晶,最终形成胆固醇结石[6]。人体内的胆固醇可以在肝脏中分解为胆汁酸进行代谢,细胞色素P450酶系成员CYP7A1是此一代谢过程的限速酶[7],其表达受到体内多种信号通路的调节,从而发挥维持人体胆固醇代谢稳定的作用,且在胆固醇结石的形成和治疗中具有重要意义。
FXR作为胆汁酸的细胞内传感器,主要表达于人体肝脏和肠道中。研究发现FXR激活可增加成纤维细胞生长因子19(FGF19)的表达,从而发挥抑制CYP7A1的作用[8]。FGF19属于FGF家族成员[9],在小鼠体内为FGF15,是特异性表达于结肠的细胞因子,具有激素样效应。相关研究显示,FGF15/19可显著抑制肝脏中CYP7A1的表达并减少胆汁酸的合成[10],在介导肝胆汁酸合成的肠-肝胆汁酸信号反馈抑制中起关键作用[10],在注射FGF15重组腺病毒的小鼠体内,CYP7A1的mRNA水平降低了5倍[11],进一步表明了FGF15/19对CYP7A1的负调控作用。
本研究采用致石饲料喂养造成小鼠胆结石模型,通过涂片观察小鼠胆汁,发现GW1929可以显著减少胆汁中的胆固醇结晶。检测胆汁和血清中的相关生化指标发现,小鼠给药GW1929后,胆汁中的胆固醇显著减少、胆汁酸显著增加,同时,血清中的甘油三酯浓度显著降低。但血清中的HDL-C和LDL-C浓度未显著变化,表明GW1929可能是通过减少胆汁中的胆固醇以及血清中甘油三酯的含量,同时提高胆汁酸含量,从而发挥减少胆固醇结晶的作用。随后,本研究通过分析小鼠肝脏和小肠组织中相关蛋白表达水平以进一步探究其机制。研究发现GW1929可以显著增加小鼠肝脏组织中CYP7A1的表达水平,同时减少小肠组织中FXR和FGF15的表达水平,且对肝脏组织中的HMGCR的表达则无影响。表明GW1929可能通过抑制小肠组织中FXR的表达,进而减少FGF15的表达水平,从而提高肝脏组织中CYP7A1的表达水平,促进胆固醇合成胆汁酸,减少胆固醇结晶的形成。以上结果表明,GW1929具有一定程度预防和治疗小鼠胆固醇结石的作用,对于寻找新的治疗胆固醇结石的靶点和药物具有重要意义。
