还原响应性肝靶向聚合物胶束的制备及其载药性能
2022-11-26冯荟如刘艳勤于香香
冯荟如, 刘艳勤, 董 营, 于香香, 巩 凯
(江南大学生命科学与健康工程学院, 江苏 无锡 214122)
原发性肝癌,是全球癌症相关死亡的第二大原因,肝细胞癌是其主要类型[1]。由于肝癌的潜伏期较长,并且大多数患者被发现时已经处于晚期或者中晚期,这给肝癌的治疗带来了极大挑战。通常情况下,化疗成为了必然选项[2]。然而,化疗药物常常在杀死肿瘤细胞的同时损害健康细胞,产生很大的毒副作用[3,4]。因此,肝癌靶向与个性化治疗极具研究意义。肝癌组织细胞中含有丰富的去唾液酸糖蛋白受体(ASGPR),而它在正常组织中表达较少,根据这一特性,可目标导向地设计肝靶向药物递送系统[5,6]。其中,半乳糖是良好的肝靶向分子,可作为靶向头功能化修饰药物递送系统,有效地与肝癌细胞上的受体进行特异性结合,进而实现对肝癌的靶向治疗。
近年来,纳米药物递送系统成为研究热点,尤其是在癌症诊断和治疗领域展现出巨大的应用潜力和前景[7]。纳米药物递送系统有纳米脂质体、纳米聚合胶束、纳米微球等,有效地改善了难溶性药物的溶解性、稳定性和生物利用度等性能[8,9]。然而,对于肿瘤的治疗,纳米药物递送系统仍有巨大的改进空间。肿瘤组织通常表现出弱酸性、强还原性、酶过度表达等特征[10,11],基于这一特性,可设计微环境响应性的智能纳米药物递送系统,以期实现药物可控释放的目的,进一步提升抗肿瘤药物的治疗效果和降低化疗副作用[12,13]。聚合物胶束粒径小且分布窄,不易被网状内皮系统吞噬,且能够透过血管选择性蓄积在肿瘤组织部位,起到被动靶向的作用[14]。因此,聚合物胶束作为药物传递载体,在肿瘤的治疗方面前景广阔[15]。
本文旨在构建一种还原敏感型肝靶向聚合物胶束。首先以半乳糖为靶向分子,制备了主体分子半乳糖-β-环糊精(Gal7-CD);然后以胱胺二盐酸盐、十八烷酸、金刚烷甲酸、双端氨基聚乙二醇等为原料,设计合成了客体分子金刚烷基聚乙二醇胺十八酰胺(Ad-PEG1000-SS-C18);最后Gal7-CD与Ad-PEG1000-SS-C18经主客体自组装形成了两亲性聚合物,进而制备了具有还原敏感性的肝靶向聚合物胶束半乳糖-胱胺-十八酰胺(Gal7-SSC18)。在此基础上,以阿霉素(DOX)为模型药物,系统研究了载药聚合物胶束Gal7-SS-C18-DOX的载药性能与体外释放行为;同时以肝癌细胞(HepG2)和正常组织细胞(HEK-293)为细胞模型,深入探讨了聚合物胶束的细胞毒性、载药聚合物胶束对HepG2的抑制性能和细胞摄取机制。
1 实验部分
1.1 实验材料与仪器
双端氨基聚乙二醇(NH2-PEG-NH2,Mn=1 000)、十八烷酸:分析纯,国药集团化学试剂有限公司;七(6-叠氮-6-脱氧)-β-环糊精、3-炔基丁基-β-D-半乳糖苷、金刚烷甲酸活性酯、O-苯并三氮唑-四甲基脲六氟磷酸盐(HBTU)、N, N-二异丙基乙胺(DIEA)、胱胺二盐酸盐、二硫苏糖醇(DTT)、N, N-二甲基甲酰胺(DMF):分析纯,上海毕得医药科技股份有限公司;DMEM培养基与RPMI-1640培养基(其中含体积分数10%的胎牛血清(FBS)、100 IU/mL的青霉素及100 μg/mL的链霉素):大连美仑生物技术有限公司;MTT、双抗(青霉素-链霉素)、胰酶:美国Sigma公司;FBS:上海双洳生物科技有限公司;HepG2、HEK-293:中国科学院典型生物保藏中心细胞库。
1.2 测试与表征
采用核磁共振氢谱(1H-NMR,美国Bruker公司Avance Ⅲ 400 MHz型)、傅里叶变换红外光谱(FT-IR,德国布鲁克公司TENSOR Ⅱ型)表征化合物的化学结构;用纳米粒度仪(英国马尔文仪器有限公司Zetasizer Nano ZS型)检测聚合物胶束的粒径和粒径多分散指数(PDI);使用荧光分光光度计(日本岛津有限公司RF-6000)测定临界胶束浓度;激光扫描共聚焦显微镜(CLSM,德国Leica公司TCSSP8型)用于细胞成像。
1.3 聚合物Ad-PEG1000-SS-C18的合成
1.3.1 化合物金刚烷基聚乙二醇胺丁二酸(Ad-PEG1000-COOH)的合成 将金刚烷甲酸活性酯(14 mg)溶于二氯甲烷(3 mL),将其缓慢滴加到装有NH2-PEG-NH2(150 mg)的二氯甲烷(5 mL)溶液的圆底烧瓶中,室温下反应12 h。反应结束后,经柱层析纯化得到化合物金刚烷基聚乙二醇胺(Ad-PEG1000-NH2)。在干燥的圆底烧瓶中加入化合物Ad-PEG1000-NH2(150 mg)和四氢呋喃(3 mL),向其中分别滴加丁二酸酐(15 mg)的四氢呋喃(3 mL)溶液、三乙胺(0.26 mL),于室温下反应4 h。反应结束后,用盐酸溶液(1 mol/L)调节pH至4~5,用去离子水(10 mL)洗涤,二氯甲烷(10 mL)萃取水相,合并有机相,真空浓缩得到粗产物;再经柱层析得到Ad-PEG1000-COOH,产率为70%。
1.3.2 聚合物Ad-PEG1000-SS-C18的合成 首先,根据文献[16]以胱胺二盐酸盐、十八烷酸为原料,经氨基保护、酰化反应、脱保护等步骤,得到胱胺基十八酰胺(NH2-SS-SA);然后,向干燥的圆底烧瓶中加入Ad-PEG1000-COOH(300 mg)、HBTU(114.72 mg)、DIEA(134.43 mg)和DMF(3 mL),于室温下搅拌反应30 min;然后,滴加NH2-SS-SA(156 mg)的DMF(2 mL)溶液,于室温下反应24 h;反应结束后,加入去离子水(50 mL),用二氯甲烷(50 mL)萃取2次;合并有机相,用无水硫酸钠干燥过夜;经过滤、真空浓缩得到粗产物;经柱层析纯化得到Ad-PEG1000-SS-C18,产率67%。图1所示为Ad-PEG1000-SS-C18的合成路线。
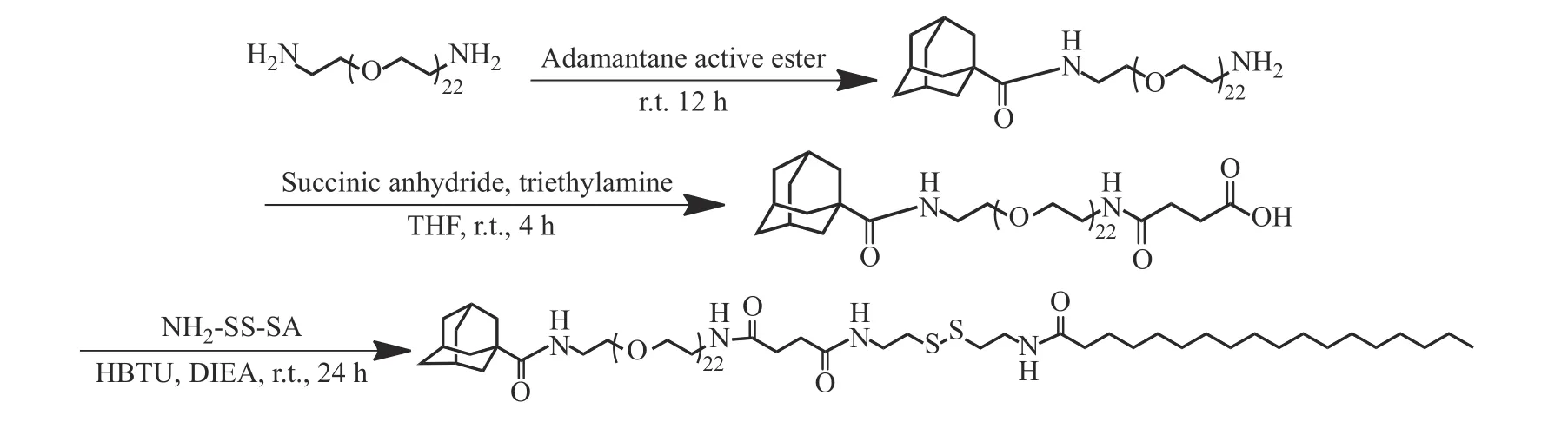
图 1 Ad-PEG1000-SS-C18的合成路线Fig. 1 Synthetic routes of Ad-PEG1000-SS-C18
1H-NMR (400 MHz, CD3OD)δ: 3.75~3.56 (m, 72 H, OCH2CH2O), 3.54 (dd,J=10.1, 5.5 Hz, 4 H, OCH2CH2NH),3.48 (t,J=6.9 Hz, 4 H, NHCH2CH2SS), 3.36 (dd,J=10.5, 5.5 Hz, 4 H, NHCH2,CH2O), 2.83 (t,J=6.0 Hz, 4 H,CH2SSCH2), 2.49 (s, 4 H, CO(CH2)2CO), 2.20 (t,J=7.5 Hz, 2 H, COCH2(CH2)16), 2.03 (s, 4 H, CCH2CH), 1.87 (d,J=2.7 Hz, 5 H, CCH2CH, CH2CHCH2), 1.77 (q,J=12.4 Hz, 6 H, CHCH2CH), 1.61 (s, 2 H,CH2CH2(CH2)14), 1.29 (s,28 H, (CH2)14), 0.91 (t,J=6.9 Hz, CH3)。
1.4 Gal7-CD的合成
向圆底烧瓶中分别加入七(6-叠氮-6-脱氧)-β-环糊精(500 mg)、3-炔基丁基-β-D-半乳糖苷(665 mg)、DMF(2.5 mL)。再称取硫酸铜(95.5 mg)、抗坏血酸钠(155.1 mg)溶于去离子水(2.5 mL)中,滴加至前述溶液中,于60 ℃下反应72 h。反应结束后,过滤除去不溶性固体,滤液经真空浓缩,残留物加去离子水复溶,用甲醇沉降后得到粗产物,经氧化铝层析柱纯化,得到Gal7-CD,收率为71%。图2为Gal7-CD的合成路线。
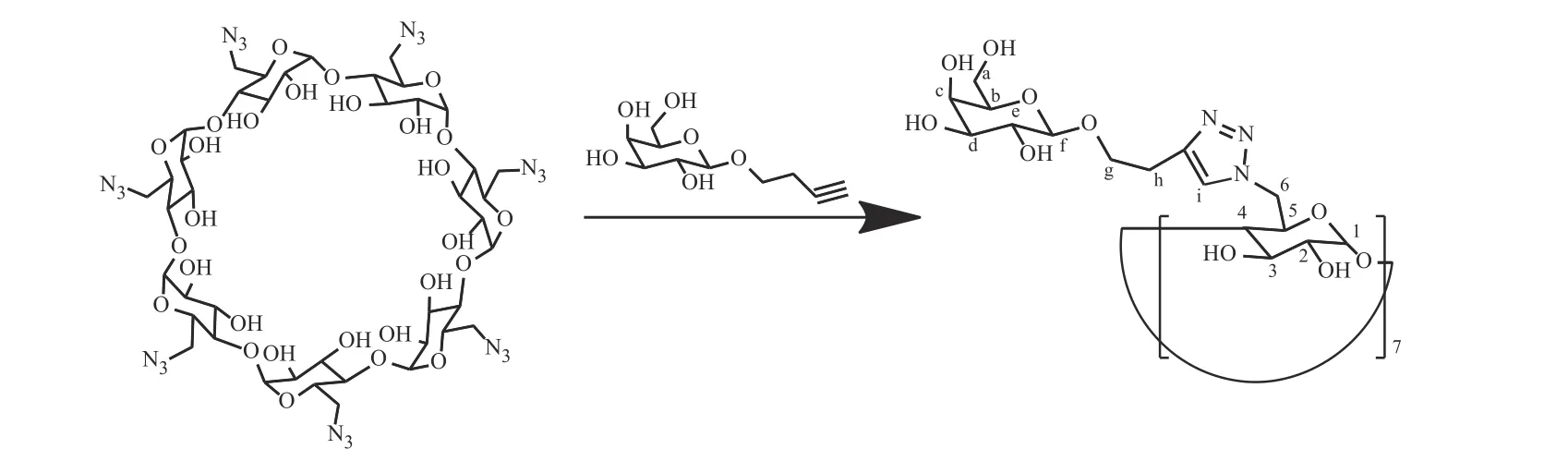
图 2 Gal7-CD的合成路线Fig. 2 Synthetic route of Gal7-CD
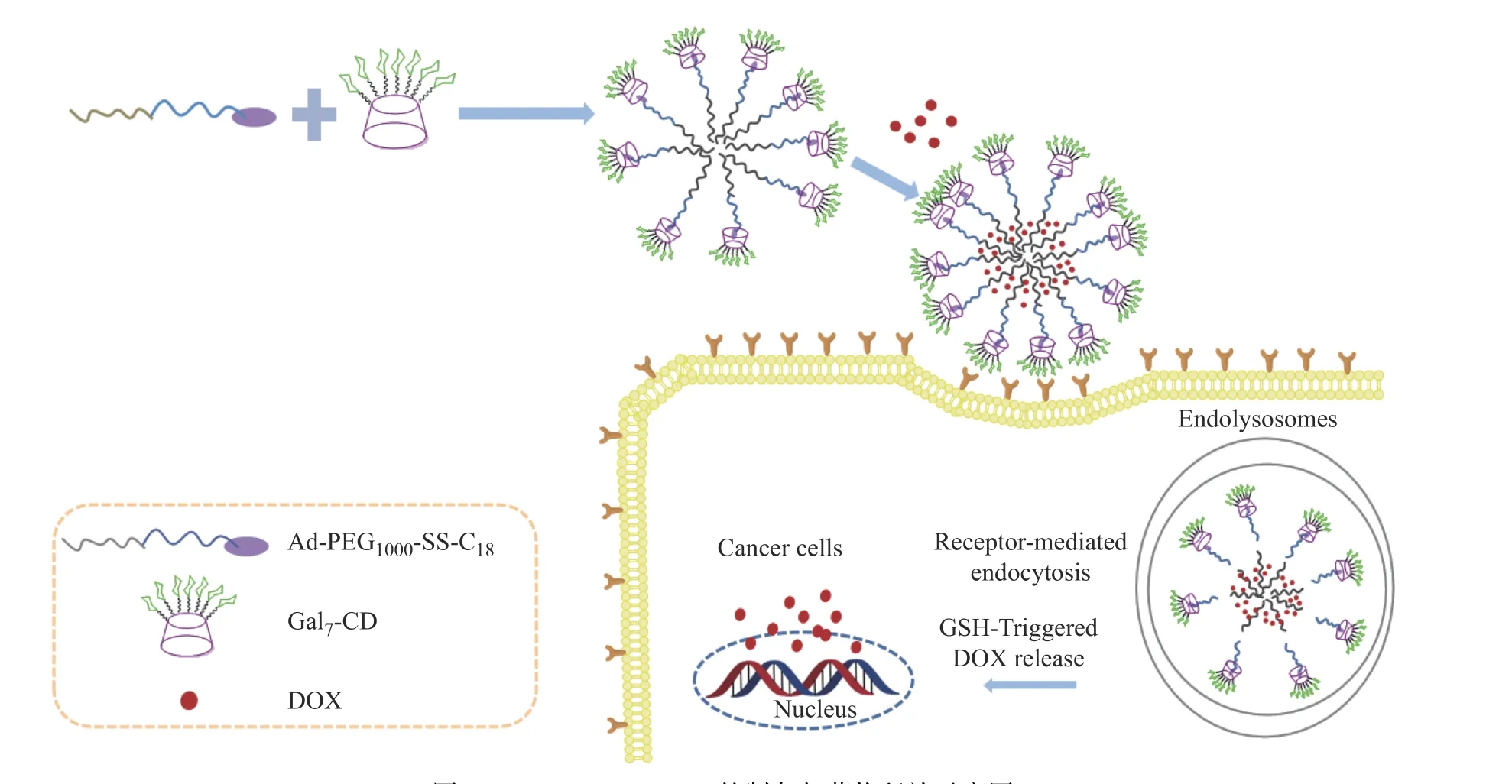
图 3 Gal7-SS-C18-DOX的制备与药物释放示意图Fig. 3 Schematic representation of formation and drug release of Gal7-SS-C18-DOX
1H-NMR (400 MHz, D2O)δ: 8.03 (s, 7 H, i), 5.19 (s, 7 H, 1), 4.66~4.55 (m, 7 H, f), 4.31 (s, 14 H, g), 4.20 (s,14 H, 6), 3.99 (s, 7 H, e), 3.94~3.51 (m, 56 H, a, b, c, d, 2, 3, 5), 3.44 (s, 7 H, 4), 2.92 (s, 14 H, h)。
1.5 聚合物胶束Gal7-SS-C18和载药聚合物胶束Gal7-SS-C18-DOX的制备与表征
采用透析法制备聚合物胶束:将Ad-PEG1000-SS-C18(19 mg)和Gal7-CD(33 mg)分别溶解于DMF(2 mL)中,在室温下搅拌4 h,然后缓慢加入去离子水(8 mL),继续搅拌24 h;然后,将反应液装入透析袋(截留分子量3 500)中,透析3 d,经0.45 μm水系膜过滤,即可得到Gal7-SS-C18溶液;透析液经冷冻干燥,得到Gal7-SS-C18粉末。
临界胶束浓度(CMC):首先,称取Gal7-SS-C18,用去离子水配制质量浓度为1×10-4~2 mg/mL的胶束溶液;然后,避光条件下,精密称取一定量芘,加入一定量的丙酮配制浓度为6×10-5mol/L的母液;最后,取30 μL母液至棕色试剂瓶中,N2吹干丙酮,向试剂瓶中分别加入3 mL不同浓度的胶束溶液,室温条件下,避光保存过夜。分别测定载有荧光探针芘的胶束溶液的激发光谱。通过测定373 nm和384 nm处的荧光强度比值(I384/I373)确定载体的CMC。
聚合物胶束的还原响应性考察:将制备好的1 mg/mL的聚合物胶束水溶液取2 mL在PBS的还原环境下(10 mmol/L DTT)和不含DTT的环境下37 ℃温育12 h,取出混合液经振荡均匀后分别加入样品比色皿中,用纳米粒度仪测试纳米胶束的粒径。
Gal7-SS-C18-DOX制备示意图如图3所示。首先,向干燥的圆底烧瓶中加入Ad-PEG1000-SS-C18(30 mg)、Gal7-CD(52.05 mg)、DMF(6 mL),缓慢滴加脱盐DOX的DMF溶液(1 mg/mL,8 mL),室温搅拌4 h;然后,缓慢滴加去离子水(12 mL),继续搅拌24 h;然后,将反应液装入透析袋(截留分子量3 500),透析3 d得到载药聚合物胶束Gal7-SS-C18-DOX溶液;透析液经冷冻干燥,获得Gal7-SS-C18-DOX粉末。
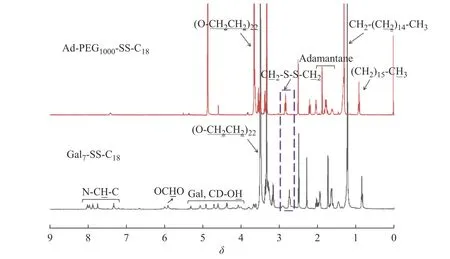
图 4 Ad-PEG1000-SS-C18和Gal7-SS-C18的1H-NMR图谱Fig. 4 1H-NMR spectra of Ad-PEG1000-SS-C18 and Gal7-SS-C18
作为对照,采用同样的方法制备去除靶向分子半乳糖的对照组载药聚合物胶束CD-SS-C18-DOX。
载药聚合物胶束的载药量测定:采用紫外-可见分光光度计法,测量480 nm处的总DOX和游离DOX的吸光度值,计算载药聚合物胶束Gal7-SS-C18-DOX的载药量和包封率。
1.6 载药聚合物胶束的体外药物释放行为
分别精确量取2 mL负载DOX的聚合物胶束溶液(1 mg/mL)加入2个密封的透析袋(截留分子量3 500)中,分别放置于DTT浓度为0、10 mmol/L的PBS(20 mL,pH=7.4)中,每组设置3个平行实验;在37 ℃,100 r/min的摇床中振荡,分别在预定时间每次取出2 mL温育的溶液,然后添加2 mL含有相应DTT浓度的新鲜PBS溶液。利用紫外-可见分光光度计测定取样样品的紫外吸光度,计算累积释放率。
1.7 体外细胞实验
1.7.1 细胞毒性实验 以HepG2和HEK-293为模型,研究了胶束的细胞毒性。首先将HepG2以每孔2.0×104个的细胞密度铺于96孔板中, HEK-293以每孔1.5×104个的细胞密度铺于96孔板中,在37 ℃、体积分数5%的CO2下培养12 h使其贴壁生长;然后加入100 μL聚合物胶束(1.25~20 μg/mL)、载药聚合物胶束(0.156~10 μg/mL)及游离DOX(0.156~10 μg/mL)来替代原培养液,同时设置阴性对照,继续孵育24 h;接下来除去培养液并加入等体积的MTT溶液,继续孵育4 h后吸出MTT溶液,每孔加入二甲基亚砜(100 μL),用酶标仪于570 nm处测定吸光度,并计算细胞存活率和半抑制浓度(IC50)。
1.7.2 细胞摄取实验 将HepG2和HEK-293以每孔8×105个的细胞密度接种于6孔板中,培养24 h;然后加入2 mL含游离DOX和载药聚合物胶束溶液(DOX的质量浓度为5 μg/mL)的培养基中继续孵育1 h或4 h后,移除培养基后用PBS洗3遍;然后用胰蛋白酶消化所有细胞,离心收集细胞;最后用PBS吹散细胞,利用流式细胞仪检测细胞摄取情况。
取对数生长期的HepG2和HEK-293接种于激光共聚焦皿((每个皿含有8×104个细胞))培养24 h;除去培养液,每孔加入2 mL游离DOX和载药胶束溶液(DOX的质量浓度为5 μg/mL)培养1、4 h后除去培养液,PBS洗涤细胞3次后加入400 μL DAPI染色30 min,PBS洗涤3次,加入400 μL多聚甲醛(4 g/mL)固定细胞20 min,用PBS洗掉表面的多聚甲醛,最后加入500 μL PBS,用CLSM进行观察。
2 结果与讨论
2.1 聚合物Ad-PEG1000-SS-C18和Gal7-SS-C18的合成与表征
图4为Ad-PEG1000-SS-C18和Gal7-SS-C18的1H-NMR谱图。由图可知,Ad-PEG1000-SS-C18的1H-NMR图谱中,化学位移0.88~0.93处的峰为十八烷基的甲基特征峰,1.77~2.03的峰为金刚烷基的氢特征峰,2.83处的峰为二硫键邻位亚甲基的特征峰;与Ad-PEG1000-SSC18相比,Gal7-SS-C18的1H-NMR图谱中不仅包含了Ad-PEG1000-SS-C18的特征峰,还出现一些新的特征峰,7.18~8.06处的峰为Gal7-CD中的三唑基团的氢特征峰,5.9处的峰为半乳糖的C2氢特征峰,4.0~6.1处的峰为环糊精和半乳糖的氢基团的氢特征峰。由此可见,Gal7-SS-C18是由Gal7-CD和Ad-PEG1000-SS-C18两部分组成。
Ad-PEG1000-SS-C18和聚合物Gal7-SS-C18的FTIR谱图如图5所示。由图可知,在Gal7-CD的FTIR谱图中,3 391 cm-1和1 045 cm-1处出现了环糊精上的羟基特征峰;Ad-PEG1000-SS-C18的FT-IR谱图中,3 300、1 632、1 542 cm-1处分别出现了NH-的伸缩振动峰、酰胺的C=O伸缩振动峰、酰胺的C-N伸缩振动峰,2 916、2 850 cm-1处出现了十八烷基的亚甲基的C-H伸缩振动峰;而Gal7-SS-C18含有Gal7-CD和Ad-PEG1000-SS-C18的所有特征峰(部分有重叠),分析表明本文成功合成了Gal7-SS-C18。
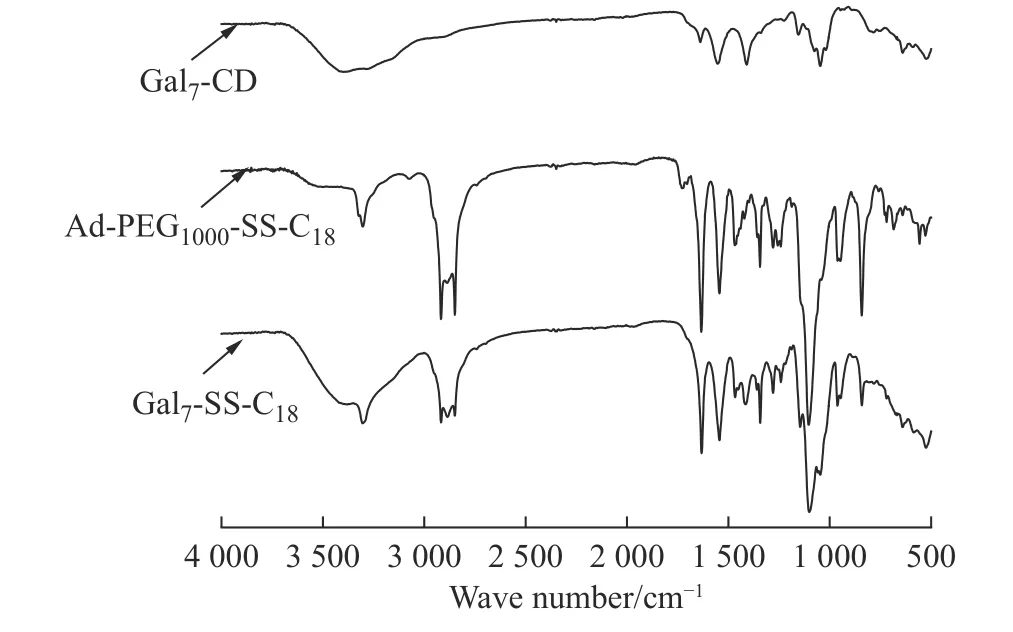
图 5 样品的FT-IR图谱Fig. 5 FT-IR spectra of samples
2.2 聚合物胶束和载药聚合物胶束的制备与表征
聚合物Gal7-SS-C18的CMC值如图6(a)所示,其CMC值为0.006 mg/mL,表明Gal7-SS-C18在较低的质量浓度下可形成胶束,且可以保持良好的稳定性,具备成为载药聚合物胶束的潜质。

图 6 (a) 聚合物胶束lg ρ与I384/I373的关系;(b) 聚合物胶束和载药聚合物胶束的粒径分布图;(c)聚合物胶束的粒径变化;(d) 载药聚合物胶束的体外药物释放曲线Fig. 6 (a) Relationship between lg ρ and I384/I373 of polymer micelles; (b) Particle size distributions of polymer micelles and drug-loaded polymer micelles; (c) Particle size changes of polymer micelles; (d) in vitro drug release profiles of drug-loaded micelles
聚合物胶束以及载药聚合物胶束的粒径如图6(b)所示。由图可知,聚合物胶束的平均粒径为(169.2±1.3)nm,PDI=0.294;载药聚合物胶束的平均粒径为(177.9±3.0)nm,PDI=0.123,DOX装入聚合物胶束的内核,致使其粒径略有增大。
聚合物胶束Gal7-SS-C18的还原响应性如图6(c)所示。由图可知,在DTT存在的情况下,聚合物胶束的粒径随时间延长而逐渐变大,12 h后,部分胶束发生分解,这说明了在DTT存在条件下,聚合物中二硫键发生断裂,致使两亲性聚合物结构分解,从而使聚合物胶束分解,证明了聚合物胶束Gal7-SS-C18具有明显的还原响应特性。
Gal7-SS-C18-DOX的体外释放性能结果表明,载药聚合物胶束Gal7-SS-C18-DOX的包封率为(71.1±0.5)%,载药量为(21.2±0.7)%。由图6(d)可知,在正常微环境体系中,Gal7-SS-C18-DOX呈缓慢释放趋势,48 h累积释放量仅为33.10%;而在还原性环境下,Gal7-SS-C18-DOX药物释放较快,在8 h时,药物释放量达到80%以上,进一步证明了载药聚合物胶束的还原响应特性。在DTT存在条件下,二硫键断裂,致使聚合物胶束分解,从而加快DOX释放与提高药物累积释放量。
2.3 细胞毒性研究
聚合物胶束的细胞毒性实验结果如图7(a)所示。当聚合物胶束质量浓度为1.25~20 μg/mL时,HepG2和HEK-293的存活率均在80%以上,这说明聚合物胶束的生物相容性良好。
载药聚合物胶束对HepG2和HEK-293体外的杀伤性能实验结果如图7(b,c)所示。由图可知,对于HEK-293来说,Gal7-SS-C18-DOX胶束、CD-SS-C18-DOX胶束和游离DOX对细胞的存活率表现出一定的浓度依赖性,Gal7-SS-C18-DOX胶束和CD-SS-C18-DOX胶束对其产生的细胞毒性无明显差异,但相比于游离DOX明显较低,其可能的原因是聚合物胶束不易穿过细胞膜被细胞摄取,或者即使被细胞摄取了,但其相对稳定,DOX未得到有效释放而降低了细胞毒性;对于HepG2来说,与游离DOX相比,Gal7-SS-C18-DOX胶束对细胞的毒性略强,IC50=(3.7±0.25)μg/mL,而对照组CD-SS-C18-DOX胶束对细胞的毒性明显较低。这是由于HepG2细胞表面的ASGPR受体会促进Gal7-SS-C18-DOX胶束的跨膜穿透,有利于细胞摄取;同时由于HepG2内的谷胱甘肽浓度较高,加快了Gal7-SS-C18-DOX胶束的分解,进而使其包载的DOX有效释放,从而杀死癌细胞。而对照组CD-SS-C18-DOX胶束不含能与ASGPR受体结合的半乳糖分子,细胞对其摄取量较低,所以其对HepG2的细胞毒性较低。

图 7 (a) 聚合物胶束对HepG2和HEK-293的体外毒性;载药聚合物胶束对(b) HepG2和(c) HEK-293的体外毒性Fig. 7 (a) in vitro toxicity of polymer micelles to HepG2 cells and HEK-293 cells; in vitro toxicity of drug-loaded polymer micelles to(b) HepG2 cells and (c) HEK-293 cells
2.4 细胞摄取研究
细胞对载药聚合物胶束和游离DOX的摄取情况如图8(a,b)所示。由图可知,两种细胞对游离DOX和Gal7-SS-C18-DOX胶束的摄取均表现出时间依赖性,在不同孵育时间,HepG2的荧光强度始终比HEK-293的荧光强。对于HepG2来说,在各个时间点,Gal7-SS-C18-DOX胶束与游离DOX相比,显示出更大的荧光峰移,荧光强度更强;而对于HEK-293来说,Gal7-SS-C18-DOX胶束与游离DOX相比,荧光强度差别不大。
载药聚合物胶束Gal7-SS-C18-DOX和游离DOX被细胞摄取的情况如图8(c,d)所示。在1 h时,HepG2中有荧光,表明有DOX进入细胞核;在4 h时,其荧光强度进一步增强,说明Gal7-SS-C18-DOX胶束进一步在细胞核聚集;然而,在HEK-293中,Gal7-SS-C18-DOX胶束没有拆解入核,仅检测到微弱的红色荧光。这是由于HepG2中,载药胶束通过ASGPR受体进入细胞,入胞更快;而在HEK-293中,红色荧光虽然有明显增加,但只有极少量与蓝色荧光重叠,这是因为只有微量的Gal7-SS-C18-DOX胶束在正常水平的GSH下拆解,DOX不能被释放入核,减少了其对正常细胞的毒性。以上结果显示载药聚合物胶束Gal7-SS-C18-DOX能较快地进入肝癌细胞的细胞核,并可控释放DOX,从而有效抑制肿瘤细胞生长。

图 8 载药聚合物胶束在(a) HepG2和(b) HEK-293的荧光强度分布图和平均荧光强度图;载药聚合物胶束在 (c) HepG2和(d) HEK-293中的共聚焦扫描显微镜图Fig. 8 Fluorescence intensity distribution and mean fluorescence intensity of drug-loaded polymer micelles in (a) HepG2 cells and (b) HEK-293 cells; CLSM images of drug-loaded polymer micelles in (c) HepG2 cells and (d) HEK-293 cells
3 结 论
(1)载药聚合物胶束粒径分布均匀,具有良好的载药性能和包封率。
(2)聚合物Gal7-SS-C18具有良好的生物相容性;载药聚合物胶束Gal7-SS-C18-DOX对肝癌细胞表现出良好的杀伤作用,且优于游离DOX对肿瘤的抑制作用,而对正常组织细胞表现出较低的毒性,具有良好的肝靶向性,以及可控释放性能。
