基于数据挖掘及网络药理学研究新安固本培元高频药对及其治疗慢性阻塞性肺疾病的作用机制
2022-11-26李泽庚王小乐高雅婷2杨勤军丁焕章
吴 凡,李泽庚,朱 洁, 王小乐,高雅婷2,,杨勤军,吴 迪,丁焕章
1安徽中医药大学中医学院,合肥 230012;2安徽中医药大学第一附属医院;3安徽省中医药科学院中医呼吸病防治研究所; 4安徽省教育厅中医药防治肺系重大疾病重点实验室,合肥 230038
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种以气流受限,气体交换异常,黏液高分泌及肺动脉高压等为特征的异质性疾病[1]。COPD在中医上多以肺胀、咳嗽及喘证命名,发病以虚、痰、瘀为主要病机,气虚为本,多始于肺脏、传于脾脏、终及肾脏,肺脾肾三脏功能失调,津液代谢失常则成痰饮,血瘀、痰浊、水饮交错为患。补气为治疗COPD的重要治则之一。中医药治疗效果明确,具有改善咳喘症状、提高生活质量的作用。
新安固本培元派作为新安医学中最具代表性的医学流派分支,以“培补脾肾、顾护元气”为学术主张,通过固护人体后天之本而达到扶正祛邪、治病愈疾的目的。固本关键在固肺、脾、肾三脏之气,培元核心在补益气血阴阳之偏。清代休宁医家汪文绮云“脾为仓廪之官……若久咳而滋补无功,须培养脾元,补母以及其子”。歙县名医程文囿:“肺金之虚,多由肾水之涸……若阴损于下,阳孤于上……是咳虽在肺,而实在肾”。新安固本培元理论以调气血、固脾胃、补肾气为治疗特色,对于COPD的防治特色突出,疗效明确[2]。
本文通过关联规则挖掘出新安固本培元医案中治疗COPD常用药对为人参(Ginseng Radix et Rhizoma,GRR)与黄芪(Astragali Radix,AR)配伍。人参-黄芪成分众多,治疗COPD机制尚不明确。对人参-黄芪药对开展网络药理学研究,进一步明确人参-黄芪活性成分及作用靶点,并分析其治疗COPD的作用机制,可以为人参-黄芪治疗COPD提供理论依据,对于阐释新安固本培元理论也有积极意义。
1 资料与方法
1.1 COPD相关医案收集
选取《石山医案》《孙文垣医案》《杏轩医案》《程茂先医案》《素圃医案》《程敬通医案》《吴氏医验录》及《冯塘医案》等新安医籍中涉及“肺胀”“咳嗽”“喘证”的医案,临床表现及病史符合《内科学》COPD特征,初步检索获取医案205篇,去重后严格按照纳入标准和排除标准去除53篇医案,最后纳入分析医案152篇。
纳入标准:(1)症状符合慢性阻塞性肺疾病表现;(2)医案记录比较完整,包括主症和方药等记录;(3)医案记载,有确切疗效,能够改善相关临床症状。
排除标准:(1)只有症状及发病过程论述,或只有方药;(2)单纯针灸治疗;(3)失治误治医案(医案记录中明确指出有误的医案)。
1.2 运用Apriori关联规则算法挖掘药对
将中药名称标准化后录入Excel表格,例如将“法半夏”“清半夏”统一命名为“半夏”,将“炙甘草”“生甘草”统一命名为“甘草”,建立中药数据库。运用SPSS Modeler软件处理数据库内中药,运用Apriori关联规则算法建立数据挖掘模型,得出使用频率最高的药对[3]。
1.3 药对中所含化学成分的收集与筛选
在中药系统药理学分析平台(traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP)中收集药对的主要化学成分。结合口服生物利用度(oral bioavailability,OB≥30%)和类药性(drug likeness,DL≥0.18)筛选所收集到的化学成分,建立药对的化学成分数据[4]。将上面收集到的靶蛋白在数据库UniProt(https://www.uniprot.org)中进行校正,选择物种为人(Homo sapiens),校正靶点蛋白信息并转化为gene symbol,建立药物的靶基因数据库。
1.4 COPD与药对相关靶点收集
通过TTD数据库(http://db.idrblab.net/ttd/)、OMIM数据库(https://omim.org/)、GeneCards数据库(https://www.genecards.org/),检索关键词“chronic obstructive pulmonary disease”收集COPD相关基因,其中GeneCards数据库relevance score≥30,三个数据库整合并去重得到COPD相关基因,并与中药活性成分靶基因进行映射筛选共同靶点,即为药对活性成分治疗COPD的靶点。
1.5 “化合物-靶点”的网络构建及可视化分析
利用Cytoscape 3.7.2软件构建药物活性成分-关键靶点基因网络图。网络中各节点(node)分别代表活性成分和靶点基因;网络中边(edge)用来连接活性成分与关键靶点基因;连接到网络的节点以度值(degree)为单位进行表示,某节点与其他节点连接的边数越多,则说明该节点在网络中扮演的角色越重要,度值也越大。
1.6 蛋白网络互作构建及拓扑分析
采用STRING数据库对人参黄芪与COPD的交集靶点进行蛋白质相互作用分析。物种限定为人,通过设定最小相互作用得分(interaction score)>0.4,获得交集靶点的PPI(protein-protein interaction)网络数据,保存“TSV”格式文件,利用Cytoscape 3.7.2软件分析所获得的蛋白相互作用并建立网络图。
1.7 GO生物学功能及KEGG通路富集分析
应用metascape数据平台(https://metascape.org/)对筛选出的共同靶点进行GO功能注释和KEGG通路富集分析,选择种族人类(Homo sapiens),设定P≤0.01,其余保持默认,分析人参-黄芪治疗COPD潜在的生物过程和信号通路。利用微生信在线平台(http://www.bioinformatics.com.cn/)绘制GO分析条状图以及KEGG富集气泡图。
1.8 成分-靶点分子对接
登录TCMSP数据库下载山奈酚(kaempferol)、人参皂苷Rh2(ginsenoside Rh2)及常春藤皂苷元(hederagenin)三种活性成分的主要成分结构,对3D结构进行能量最小化后保存,利用Autodock Tools 1.5.6软件生成pdbqt格式。然后登录PDB数据库(http://www.rcsb.org)下载AKT1(PDBID:1H10)、IL6(PDBID:7NXZ)、CXCL8(PDBID:6N2U)、MAPK1(PDBID:7NR9)及TNF-α(PDBID:7ATB)等5个靶点蛋白3D晶体结构,对其去水、配体,加氢,重新计算电荷;然后将活性成分文件导入,检测总电荷,分配电荷,查看柔性可旋转键。最后使用Autodock程序进行分子对接,计算结合能大小。Pymol软件将结果可视化。结合能绝对值>4.25代表分子与靶点初步具有结合能力,结合能绝对值>5.0代表较强结合能力,结合能绝对值>7.0代表很强结合能力[5]。
2 结果
2.1 运用关联规则获取药对
纳入医案处方152例,涉及中药217味,总频次1 962次,中药类别包括补虚药、化痰止咳平喘药、解表药、清热药等18大类。基于医案处方中药,运用SPSS Modeler中的Apriori进行建模,选取支持度≥0.11,置信度≥0.75,进行关联分析,得到二项关联(见表1),其关联关系网络图见图1。其中,置信度最高且关联性强的药对是人参-黄芪,置信度为90.91%,支持度为25.00%。
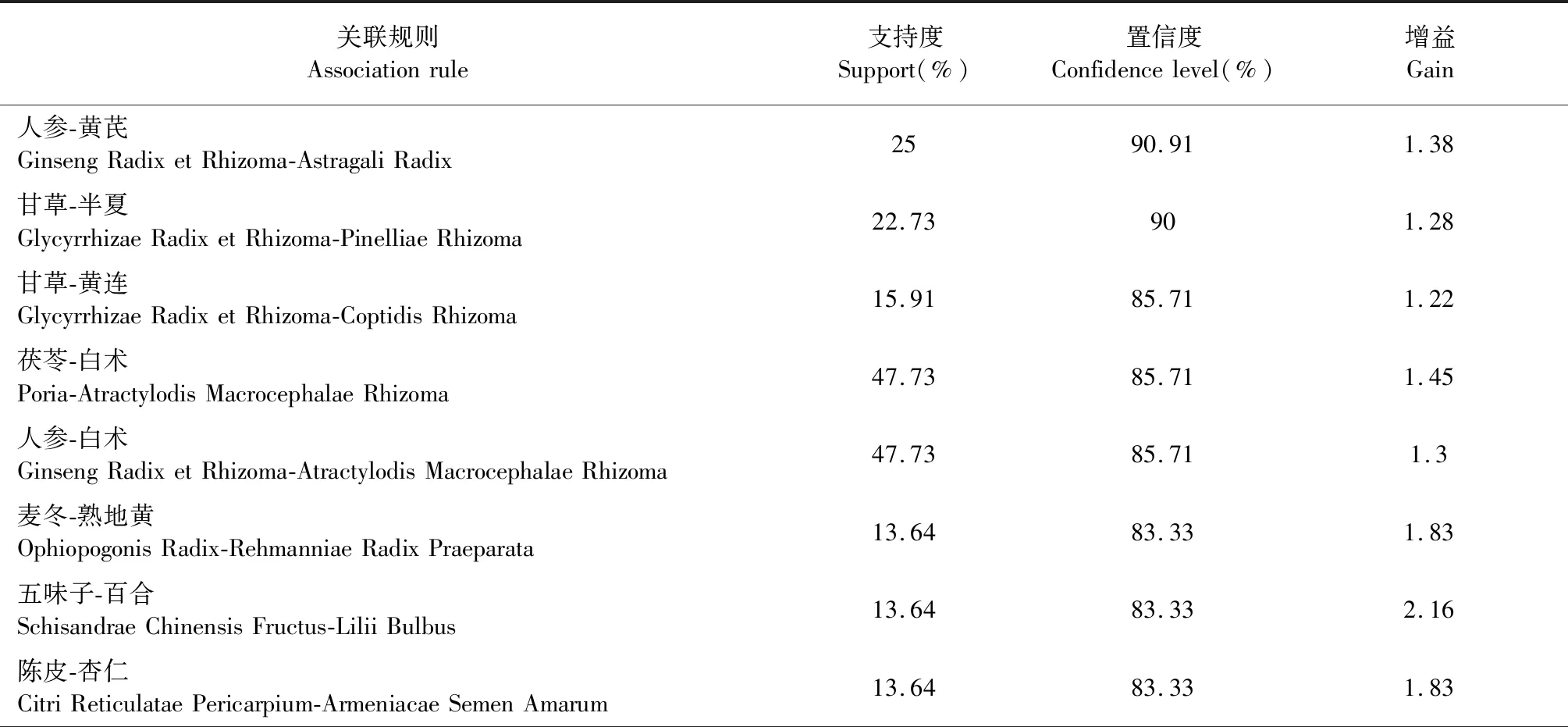
表1 治疗COPD处方中药物的关联规则(置信度≥0.75)Table 1 Association rules for drugs in the treatment of COPD (confidence≥0.75)
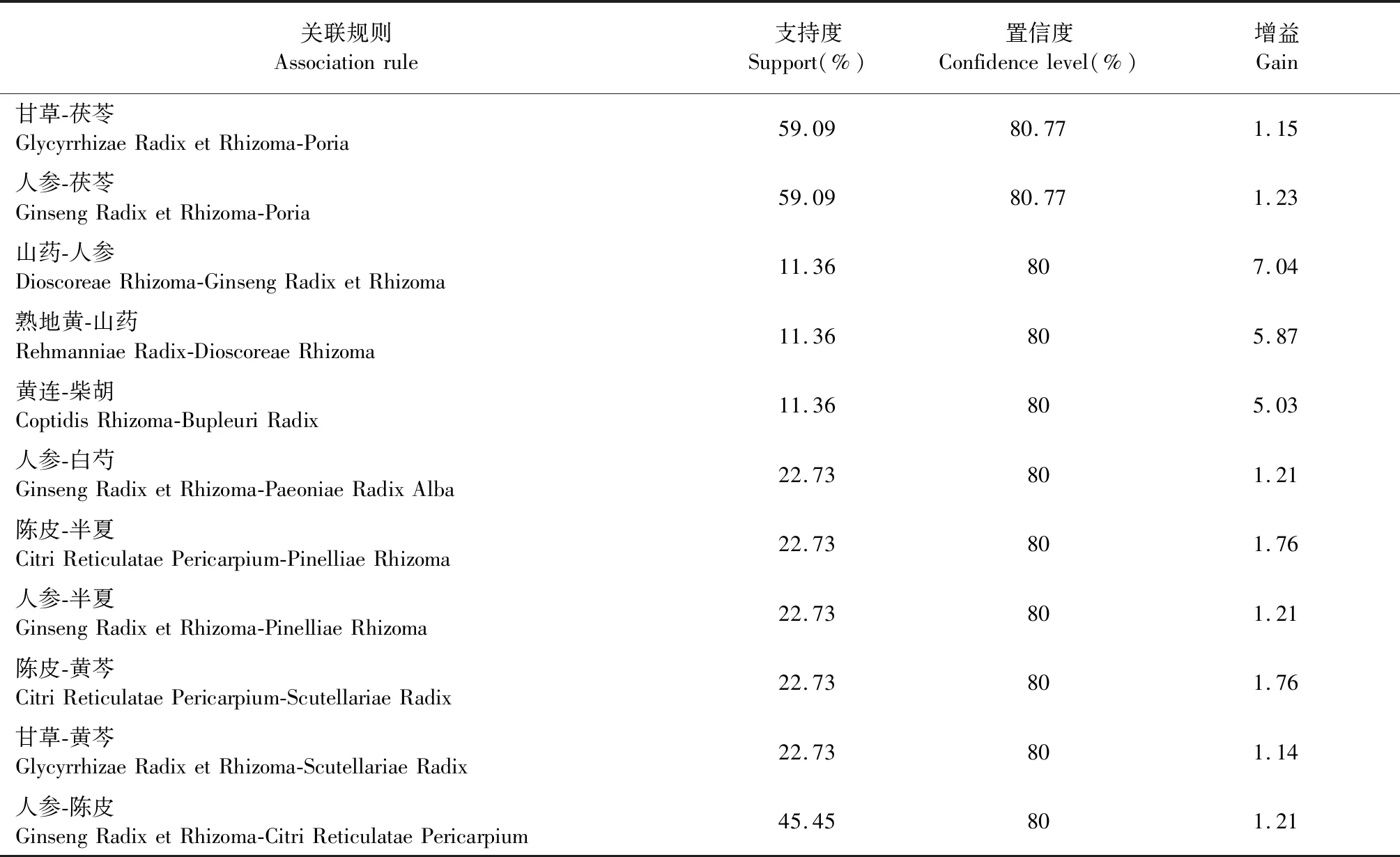
续表1(Continued Tab.1)
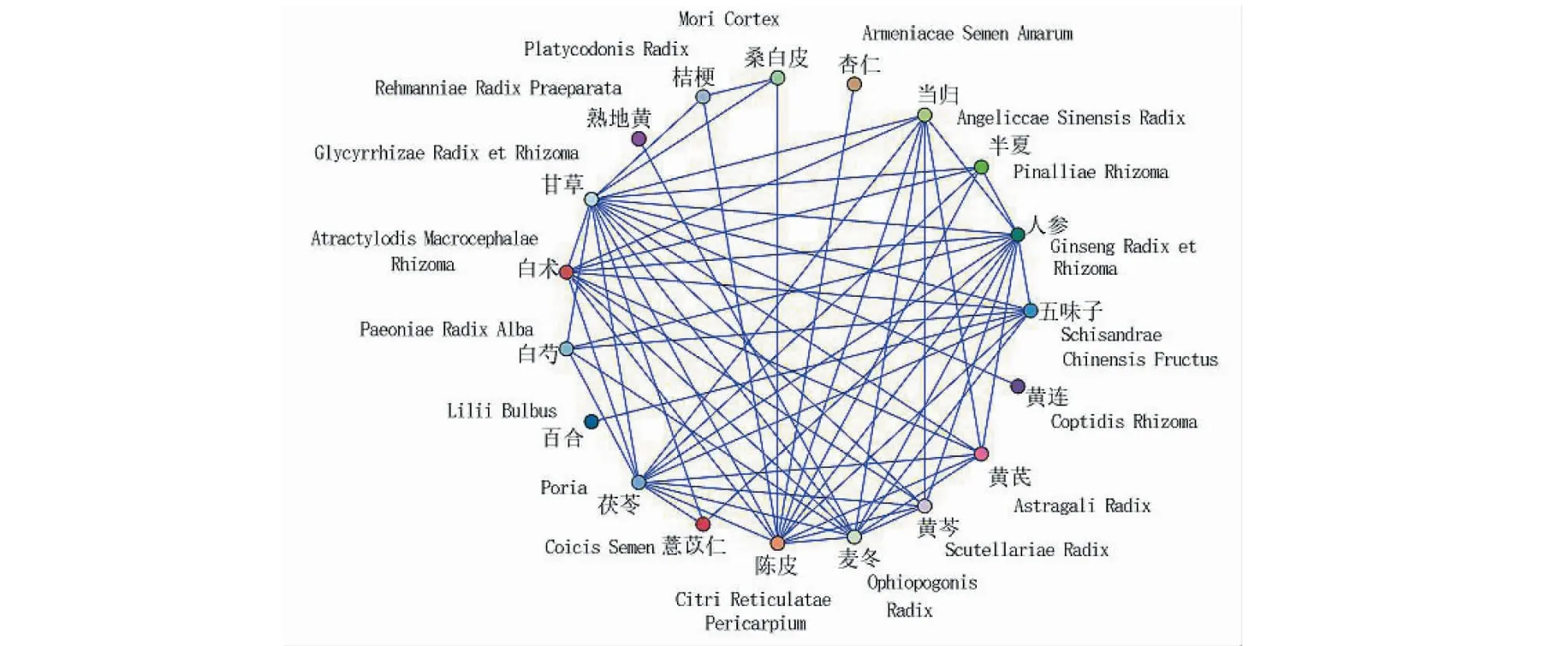
图1 药物关联网络图Fig.1 Drug association network diagram
2.2 所含化学成分收集与筛选
在TCMSP数据库,设置筛选条件为OB≥30%、DL≥0.18后得到人参化学成分22个,黄芪化学成分20个,剔除没有靶点的化学成分,人参化学成分17个,黄芪化学成分17个,山奈酚为二药共同成
分,其中共计筛选到化学成分33个,详见表2。通过Cytoscape 3.7.2软件构建化学成分与治疗靶点网络图(见图2)。图2共有216个节点、587条边,三角形代表活性成分,圆形为靶点基因。
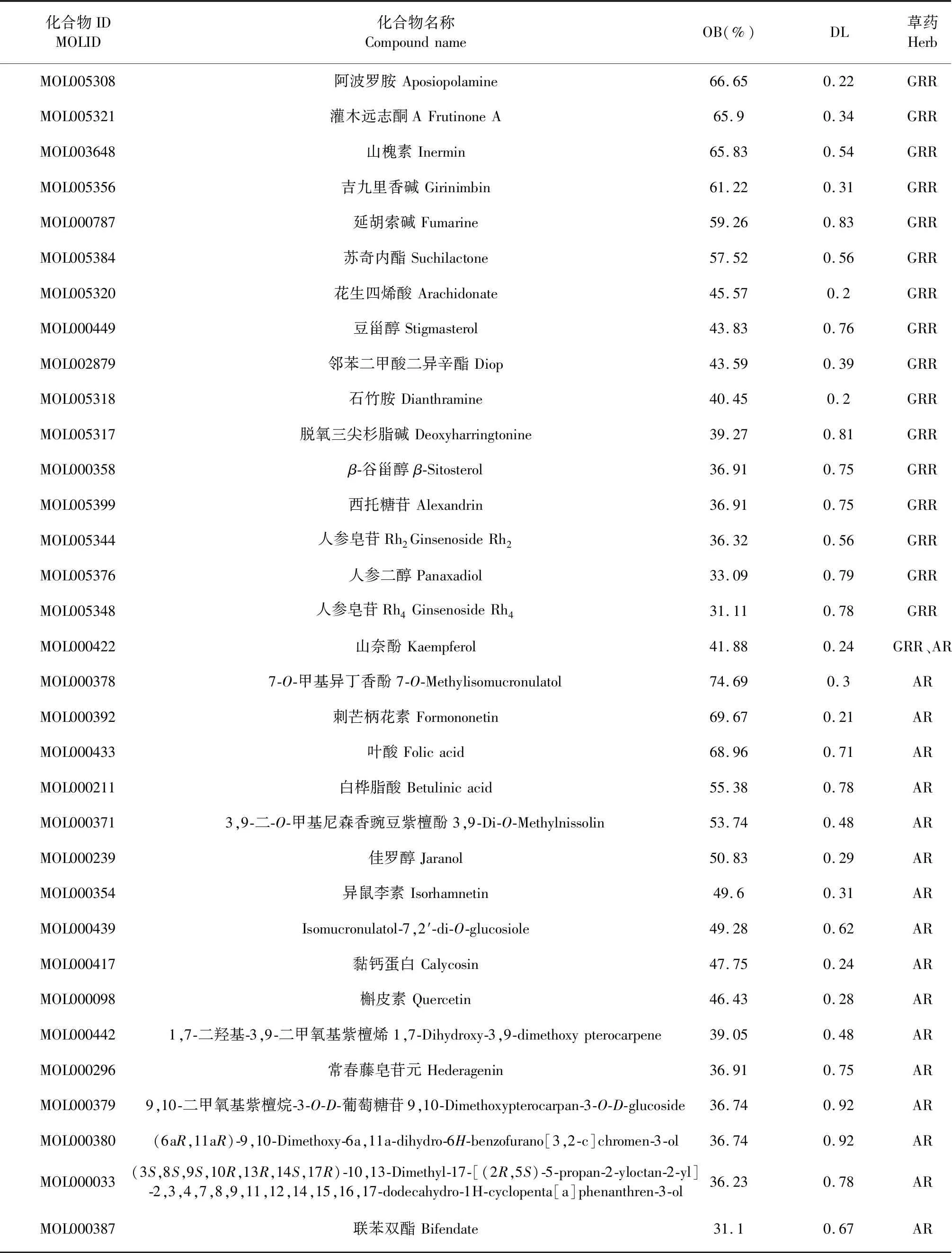
表2 人参-黄芪活性成分Table 2 Active ingredient of Ginseng Radix et Rhizoma-Astragali Radix
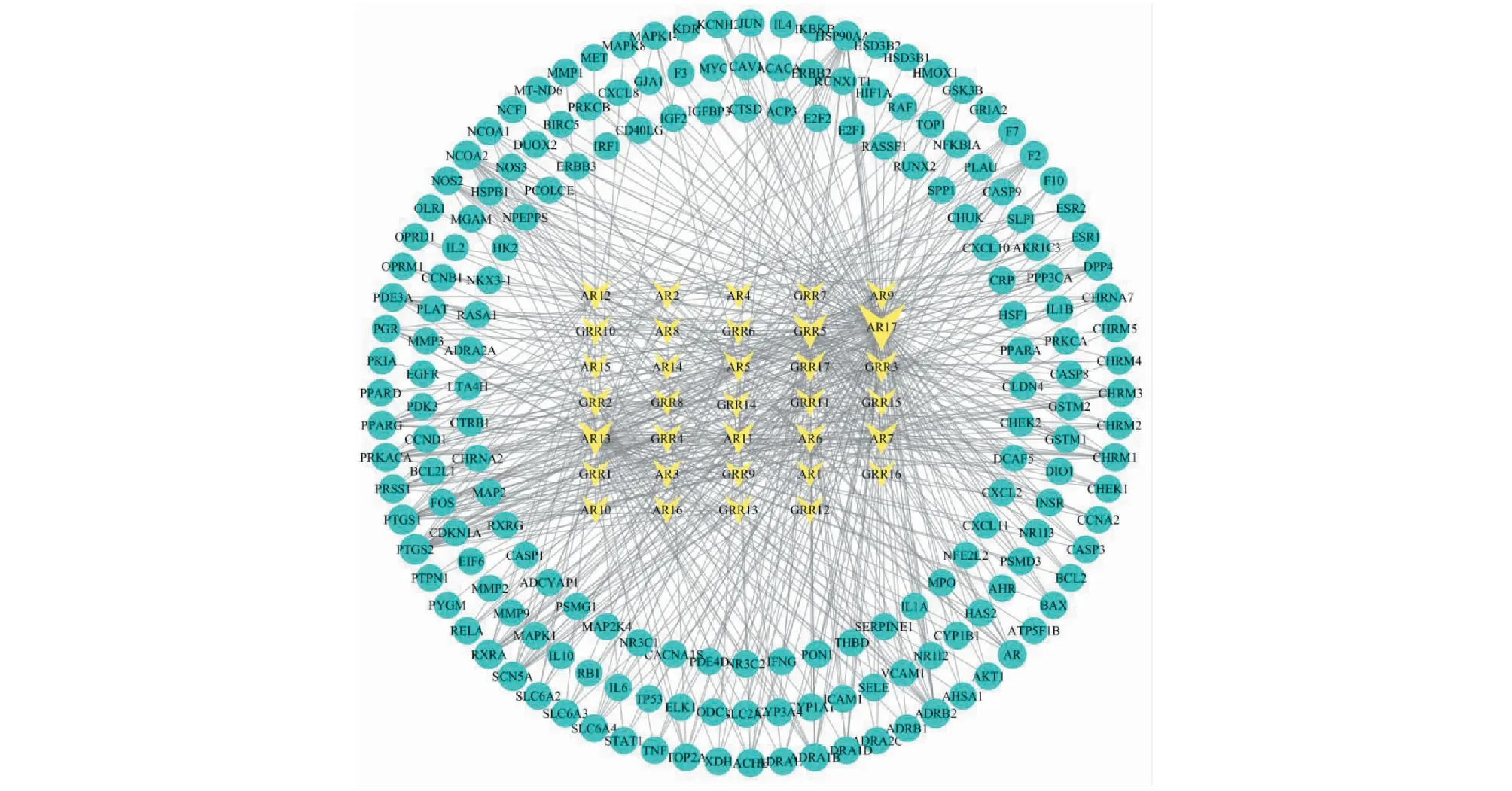
图2 人参-黄芪主要活性成分-靶点网络图Fig.2 Main active ingredient-target network of Ginseng Radix et Rhizoma-Astragali Radix
2.3 疾病和药物相关靶点的筛选
在GeneCards、OMIM及TTD中以“chronic obstructive pulmonary disease”为关键词,检索COPD相关靶基因,去重后得到靶基因946个,并与人参-黄芪活性成分治疗的靶基因取交集并绘制维恩图(见图3)。图中共同靶点64个,说明这些基因可能在人参-黄芪治疗COPD过程中,发挥一定作用,为进一步阐释人参-黄芪治疗COPD的作用机制,将这64个靶点作为目标关键靶点进行分析。
2.4 关键靶点蛋白-蛋白相互作用分析
在STRING数据库中分析64个关键靶点之间的相互作用关系并导出结果。将结果导入Cytoscape 3.7.2获取PPI网络,图中颜色越深、圆圈越大则得分越高(见图4)。可以看出,这64个靶点间有相互作用,表明这些靶点相互联系,并通过多途径、多方面的协调来起到治疗COPD。经拓扑分析,度值(degree值)排名前10的靶点依次为IL6、TNF、AKT1、TP53、MMP9、MAPK1、CXCL8、PTGS2、EIL1B、FOS,表明这些基因在人参-黄芪治疗COPD过程中具有重要意义。
2.5 GO生物学功能和KEGG通路富集分析
用Metascape数据库,从生物过程、分子功能和细胞组成3个模块对64个关键靶点进行GO功能富集分析,生物过程(biological process,BP)条目1 629条,主要涉及细胞分化、炎症反应、细胞凋亡、上皮细胞增殖及氧化应激等;分子功能(molecular function,MF)条目48条,主要涉及转录因子结合,受体调节,信号受体激活、受体配体活动及生长因子活动等;细胞组分(cellular component,CC)条目91条,主要涉及胞质核周区域、细胞外基质、线粒体外膜、细胞器外膜及膜微结构域等,具体GO功能分析结果可见图5。KEGG分析结果显示,P≤0.01的通路共计133条。结合表3和图6,每条通路的P值从小至大进行排序,与人参-黄芪治疗COPD相关的通路有PI3K-Akt信号通路、HIF-1信号通路、Toll样受体信号通路、Th17细胞分化及MAPK信号通路等。
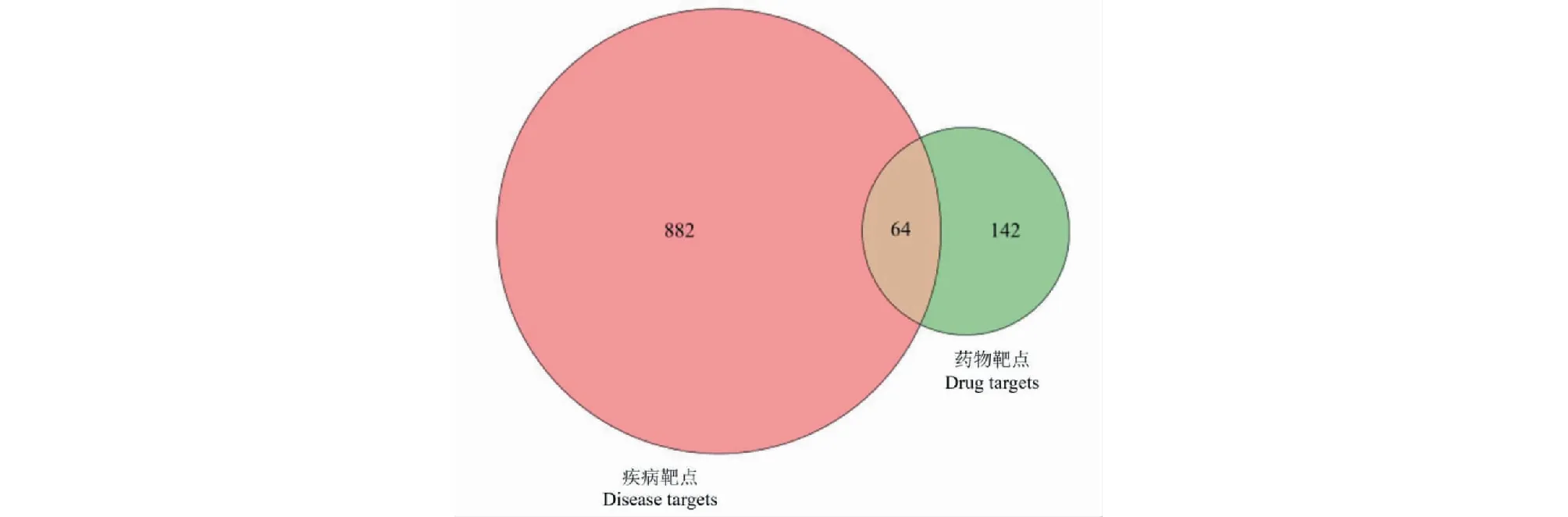
图3 疾病靶点基因与人参-黄芪靶点基因Veen图Fig.3 Veen diagram of disease target genes and Ginseng Radix-Astragali Radix target genes

图4 关键靶点PPI网络图Fig.4 PPI network diagram of key targets
图5 GO富集分析柱状图Fig.5 GO enrichment analysis histogram

表3 KEGG通路富集分析(前14条)Table 3 KEGG pathway enrichment analysis (Top 14)

续表3(Continued Tab.3)
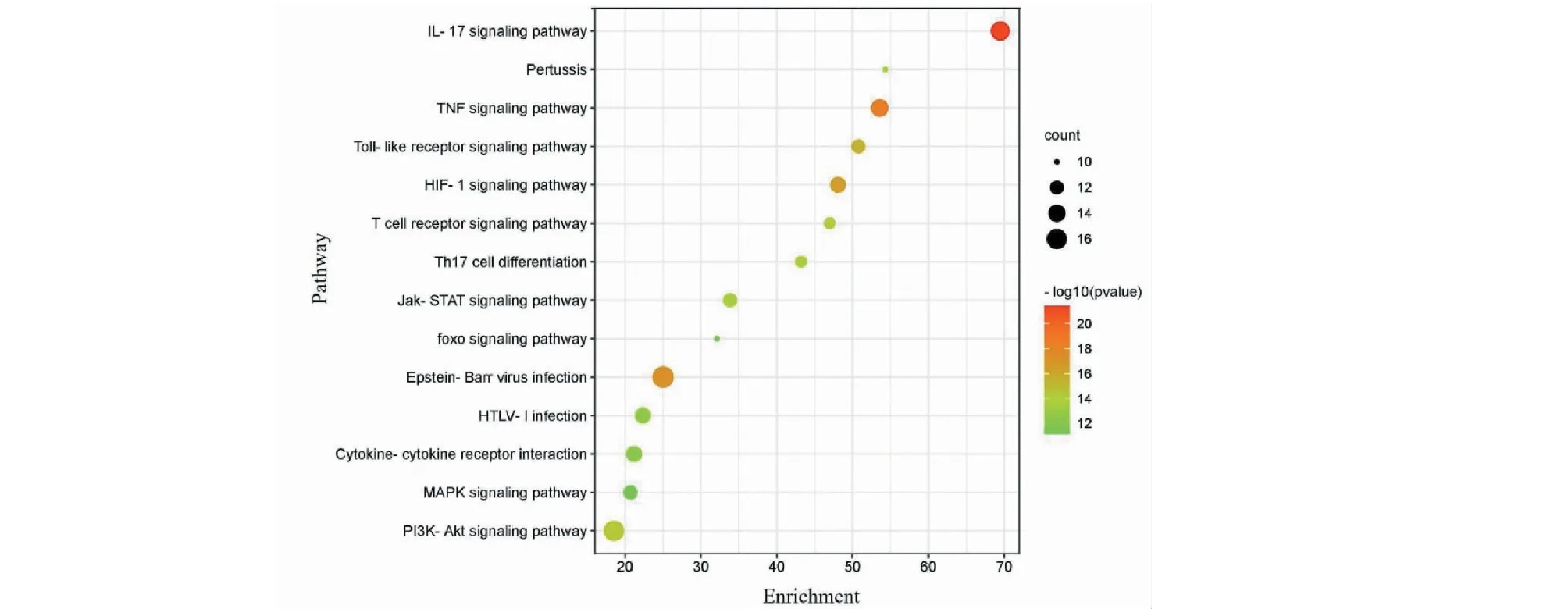
图6 KEGG通路富集分析气泡图Fig.6 Bubble diagram of KEGG pathway enrichment analysis
2.6 分子对接结果
使用Cytoscape 3.7.2中的插件cytoNCA、cytoHubba筛选出degree值排名前十的主要作用靶点,选择出人参、黄芪degree值得出评分较高的活性成分。结合文献报道[6],人参皂苷Rh2及常春藤皂苷元均有增强免疫作用,对于慢性支气管炎具有一定的治疗作用,人参、黄芪共同化学成分山奈酚具有抗炎、抗肿瘤、同时对肺损伤具有防治作用[7];选择上述三种化合物,根据KEGG分析得到得通路,运用PyMOL、AutoDock Vina等软件对人参-黄芪的关键成分及主要靶点进行分子对接,对上述三种化合物作用于AKT1、IL6、CXCL8、MAPK1及TNF-α的结合能进行对接并打分。根据文献[8-10]结合TCMSP数据库查询结果,以白藜芦醇(PubChem Cid:445154)作为AKT1阳性对照药、槲皮苷(PubChem Cid:5280343)作为CXCL8阳性对照药、木犀草素(PubChem Cid:5280445)作为IL6阳性对照药、异槲皮苷(PubChem Cid:5280804)作为MAPK1阳性对照药及苯甲酸(PubChem Cid:243)作为TNF-α阳性对照药。表4可得出,人参皂苷Rh2、常春藤皂苷元及山奈酚与AKT1、IL6、CXCL8、MAPK1及TNF-α均有较强的亲和力。同时运用PyMOL、LigPlot+软件制作了AKT1与人参皂苷Rh2、山奈酚,MAPK1与山奈酚,IL6与人参皂苷Rh2的3D对接示意图见图7。
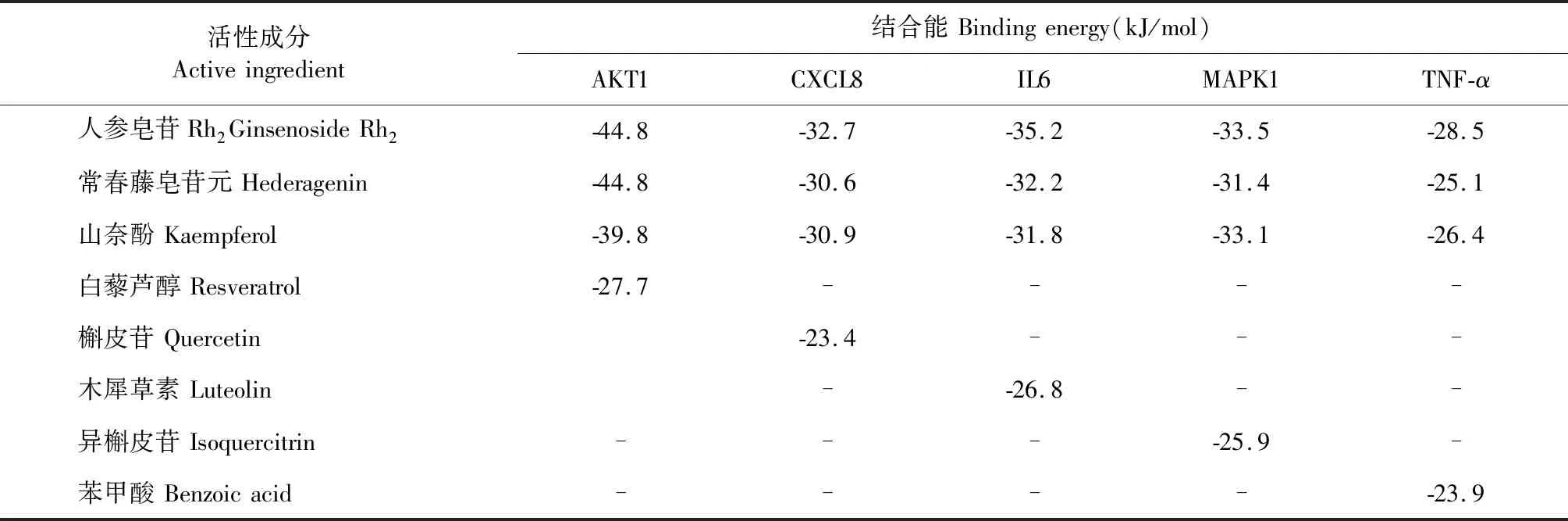
表4 活性成分与靶点受体蛋白间的最低结合能Table 4 Minimum binding energy between active ingredients and target proteins
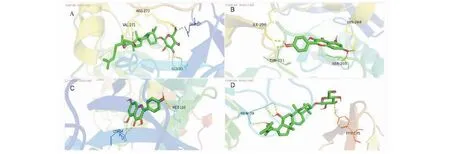
图7 靶点受体蛋白与活性成分的对接模式和相互关系模拟Fig.7 Simulation of docking mode and interaction between target receptor protein and active component注:A:AKT1-人参皂苷Rh2;B:AKT1-山奈酚;C:MAPK1-山奈酚;D:IL6-人参皂苷Rh2。Note:A:AKT1-ginsenoside Rh2;B:AKT1-kaempferol;C:MAPK1-kaempferol;D:IL6-ginsenoside Rh2.
3 讨论与结论
咳嗽、喘息、气短,动则加重及畏风等作为肺气虚证常见症状,最早见于COPD病理过程,肺气虚渐进性发展,影响及脾,发展为肺脾气虚,兼见纳呆或食少,胃脘胀满或腹胀或便溏等;病情进一步发展,可出现呼多吸少,呼吸表浅甚至气少不足以吸等肾气不足证候的症状,可见肺脾肾气虚[11]。COPD稳定期治疗以补肺健脾补肾为主,兼顾行气、化痰、活血,稳定期有效防治对于减少急性发作次数、改善患者感受、延缓病理改变和病情进展有积极意义。
在固本培元理论指导下,新安医家通过补益肺、脾、肾之气,恢复脏腑气血功能,以祛痰瘀、水饮等病理产物,与COPD稳定期治疗高度契合。通过Apriori关联规则分析目标数据库里的用药规律得到人参与黄芪同时配伍治疗COPD置信度最高。以汪机为代表的新安医学固本培元医家,认为“参芪不惟补阳,而亦补阴”,临床擅用人参、黄芪,重固脾胃,补益气血,平调阴阳。明代祁门医家陈嘉谟《本草蒙筌》云:“人参可定喘嗽,通畅血脉,泻阴火……肺寒受邪,短气少气,虚喘宜用”。歙县名医汪昂《本草备要》:“黄芪炙用补中,益元气,温三焦,壮脾胃……脾胃缓和,则肺气旺而肌表固实,补中即所以固表也。二药备受新安医家喜爱,合用而固本培元、健脾补肺、培土生金,符合COPD稳定期肺脾气虚证的基本病机。近代临床研究表明,以人参-黄芪为君药的方药对于COPD稳定具有良好的治疗作用,Dou等[12]研究发现自拟补肺益肾汤(党参、生黄芪、五味子等)可以降低慢阻肺肺肾气虚型患者的中医证候积分,升高PaO2,减少CO2潴留。
通过Cytoscape 3.7.2中的插件cytoNCA挖掘人参-黄芪中33个活性成分,参考degree排名,结合研究文献,发现山奈酚、人参皂苷Rh2及常春藤皂苷元等成分发挥着重要的作用。山奈酚具一种有二苯基丙烷结构的低分子量的黄色化合物,由4-香豆酰辅酶A与三个丙二酰辅酶A缩合而成,能够通过抑制NF-κB与髓系分化因子88(MYD88)的结合活性,抑制炎症反应的发生[13]。人参皂苷Rh2是人参中主要的生物活性皂苷之一,从结构上看,Rh2可分为S型和R型两种构型,其中20(S)-Rh2单体是从中草药中分离得到的主要构型,研究显示人参皂苷Rh2通过调节TGF-β1/Smad通路有效地抑制小胶质细胞活化和促炎细胞因子的产生[14]。常春藤皂苷元是一种天然存在的三萜类化合物,在A环的C-4位带有羟甲基,高度不溶于水,能够可抑制NF-κB和p-IκBα的核转位,从而抑制NF-κB的活化,抑制内毒素诱导的细胞NF-κB水平和NF-κB的核转位发挥抗炎作用[15]。
通过对交集靶点进行GO功能分析,发现人参-黄芪可能在胞质核周、细胞外基质、线粒体外膜区域,调控转录因子结合、受体调节、信号受体激活、配体活动等分子功能,发挥抗氧化应激、延缓炎症及抑制细胞凋亡和上皮细胞增殖等生物过程。KEGG通路富集分析显示,这些靶点参与了PI3K-Akt信号通路、IL-17信号通路、TNF信号通路、HIF-1信号通路、细胞因子受体相互作用信号通路、Toll样受体信号通路、Jak-STAT信号通路、MAPK信号通路、T细胞受体信号通路、Th17细胞分化及Foxo信号通路等。应用Cytoscape中的cytoHubba插件筛选出degree值排名前十的核心基因,依据文献[16]及KEGG富集分析的结果,选择Toll样受体(toll-like receptors,TLRs)和Th17细胞分化信号通路进行深入分析,得出两条通路富集的核心基因有AKT1、IL6、CXCL8、MAPK1及TNF-α等。TLRs是固有免疫中关键的模式识别受体,在吸烟、有害气体及微生物等因素的影响下,TLRs成跨膜信号转导,再通过依赖于MYD88的NF-κB通路调控炎症基因的转录、翻译和表达,产生并释放IL-6、IL-8、COX-2、PGE2等炎性因子,在损伤细胞同时,又作为内源性配体与中性粒细胞、NK细胞等表面受体结合,合成并释放大量炎症介质和募集炎症细胞,导致肺部炎症反应级联被放大并持续存在,TLR2、TLR4、TLR9都参与了COPD的发病过程,其中TLR4被认为是维持COPD炎症反应的主要TLRs[17]。辅助性T细胞17(T helper cell 17,Th17)是辅助性T淋巴细胞中的一个特殊亚群主要分泌白细胞介素17(interleukin 17,IL-17)和其他炎症细胞因子,在慢性气道炎症性疾病中与成纤维细胞、上皮细胞及平滑肌细胞表面的受体结合而发生免疫反应,诱导中性粒细胞的增殖和聚集,造成气道上皮损伤,介导纤维化[18];与Th17细胞相比,Treg细胞具有免疫调节功能,并分泌抗炎细胞因子来增强免疫耐受性和抑制炎症反应,Th17/Treg失衡被认为是COPD发生的重要诱因[19]。AKT是进化上高度保守的一种丝氨酸/苏氨酸蛋白激酶,AKT的活化能抑制FOXO3a的转录活性,诱导p53/p21途径参与香烟诱导支气管上皮细胞的衰老[20]。IL-6作为细胞因子之一能够促进Th17(辅助性T细胞17)分化通路,并诱导促炎细胞因子如IL-17(白介素17)和CXCL8(趋化因子8)的产生,促进COPD发展[21]。CXCL8是中性粒细胞炎症介质,CXCL8和其他由肺巨噬细胞分泌的趋化因子在外界刺激(香烟烟雾、空气污染物)下协调中性粒细胞(PMN)向肺部的运输,中性粒细胞和其他炎性细胞堆积产生的蛋白酶分泌会导致持续的广泛的组织损伤,还刺激气道上皮,使其收缩,增加其对炎症细胞的通透性,参与COPD的发病[22]。TNF-α为一种重要的炎症介质,能与香烟烟雾、LPS等协同活化炎症细胞的NF-κB系统,刺激IL-8等细胞因子的释放,使中性粒细胞数量增加,还能诱导基质金属蛋白酶(MMP-9、MMP-12等)释放,破坏肺泡壁而加重COPD进展[23]。MAPK1(丝裂原活化蛋白激酶1)是细胞内丝氨酸/苏氨酸蛋白激酶,在进化过程中高度保守,在活化进入细胞核之前位于细胞质中,可以通过磷酸化转录因子来改变基因表达,促进炎症因子TNF-α、IL-1、IL-6等的产生[24],诱导一系列炎症和免疫反应,从而在COPD的发病机制中发挥作用[25]。AKT1、IL6、CXCL8、TNF-α、MAPK1为富集于Toll样受体信号通路和Th17细胞分化信号通路的关键靶点,各基因之间也存在交互调控作用,可能通过炎症免疫影响COPD的发病和进程。
为了进一步验证网络药理学结果的可靠性,利用分子对接技术将核心成分和关键靶点进行分子对接,结果发现,核心成分山奈酚、人参皂苷Rh2及常春藤皂苷元与AKT1、IL6、CXCL8、MAPK1及TNF-α的结合能均小于-21.4 kJ/mol,其中AKT1与人参皂苷Rh2、常春藤皂苷元的结合能为-44.8 kJ/mol,表明他们之间有强烈的结合活性。上述结果表明AKT1、IL6、CXCL8、MAPK1及TNF-α可能是人参-黄芪发挥作用的重要靶点。
综上所述,通过数据挖掘证实新安医学固本培元派医家善用人参-黄芪药对治疗COPD,采用网络药理学方法构建“化合物-靶点”网络,从整体上分析人参-黄芪成分、靶点、信号通路之间的相互作用关系,推测人参-黄芪通过山奈酚、人参皂苷Rh2及常春藤皂苷元等潜在药效成分协同作用于AKT1、IL6、CXCL8、MAPK1及TNF-α等多个靶点,通过Toll样受体信号通路和Th17细胞分化信号通路等发挥抗炎及调节免疫等作用治疗COPD。初步揭示了人参-黄芪药对通过多成分、多靶点、多通路治疗COPD的机制,后续可对人参-黄芪药对进行实验研究,筛选该药对主要成分作用于香烟烟雾诱导的气道上皮细胞模型,检测核心靶蛋白的表达,深入探讨关键作用机制,为COPD治疗药物的研发提供新的方向及依据。
