黄连半夏药对治疗慢性萎缩性胃炎作用机制研究
2022-11-26向阳,黄琼,袁林
向 阳,黄 琼,袁 林
1云南中医药大学,昆明 650000;2风湿性疾病发生与干预湖北省重点实验室;3 湖北民族大学,恩施 445000
慢性萎缩性胃炎属于中医学“胃痞”“胃痛”范畴,病因多由正气不足、外邪犯胃、情志不遂、饮食失常等导致,病在脾胃,病性多虚实夹杂,“气滞、气虚、湿热、血瘀”等贯穿病程发展的始终,在不同阶段又有所侧重[1]。治疗上多采用清热化痰、益气养阴、活血通络等法[2]。黄连、半夏是中医临床常用药对之一,也是慢性萎缩性胃炎中医及中西医结合诊疗共识意见中所推荐方剂连朴饮、黄连温胆汤、半夏泻心汤的“君药”组成部分[3],对治疗慢性萎缩性胃炎具有坚实的临床基础[1]。相关研究发现,在慢性萎缩性胃炎发病过程中Janus激酶2(Janus kinase,JAK2)/信号转导与转录激活子3(signal transducer and activator of transcription,STAT3)信号通路的激活可以导致胃黏膜细胞的异常增殖、血管新生以及向恶性转化,并最终导致恶性肿瘤的发生与发展[4];胃癌患者胃黏膜中Yes相关蛋白1(yes-associated protein 1,YAP1)阳性率显著高于正常人胃黏膜、慢性萎缩性胃炎及肠上皮化生患者,其在胃黏膜中的过表达与胃癌的进展、淋巴结转移及不良预后密切相关[5];血管新生是影响慢性萎缩性胃炎及胃癌前病变相关预后转归的重要因素[6]。基于此,本次研究首先采用分子对接的方法探讨黄连半夏药对中有效活性成分与慢性萎缩性胃炎发病过程中关键性靶标白介素1β(interleukin 1β,IL-1β)、白介素6(interleukin 6,IL-6)、YAP1、STAT3、JAK2、血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)、表皮生长因子受体(epidermal growth factorreceptor,EGFR)的结合性;然后,通过动物实验方法建立慢性萎缩性胃炎大鼠模型,采用黄连与半夏的水煎液进行干预治疗;最后,通过检测血液和胃黏膜组织中相关靶标的表达情况,以探究该药对防治慢性萎缩性胃炎的作用机制,为后继研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 软件与数据库
Auto Dock Tools 1.5.7软件、Vina软件、Discovery Studio 2016软件、TCMSP数据库(http://tcmspw.com/tcmsp.php)、RCSB PDB数据库(https://www.rcsb.org/)。
1.1.2 动物
5周龄SPF级SD大鼠60只,雌雄各半,体重180±15 g,购于湖北省疾病预防控制中心动物中心,许可证号:SCXK(鄂)2020-0018。饲养于风湿性疾病发生与干预湖北省重点实验室IVC实验动物笼具中常规饲养,温度23±2 ℃,相对湿度70%~75%,昼夜各半间断照明。本实验经湖北民族大学医学伦理委员会审查批准(2021019号)。
1.1.3 药材与主要试剂
中药材黄连饮片(产地四川,批号:2005052,以下简称CR);半夏饮片(产地湖北,批号:20200521,以下简称PR)购于宜昌人福药业,均经湖北民族大学药用植物学专业李厚聪副教授鉴定为毛莨科黄连属植物黄连CoptischinensisFranch.的干燥根茎、天南星科半夏属植物半夏Pinelliaternate(Thunb.) Breit.的干燥块茎。用药比例设置为1∶1,以临床常规用量各15 g计算,各称取15 g加水300 mL浸泡60 min后煎煮30 min留取药液,浓缩至生药比1 g/mL,4 ℃冰箱保存备用。
N-甲基-N′-硝基-亚硝基胍(MNNG)溶液(东京化成工业株式会社生产,批号:WMUSI-LJ);雷尼替丁(宜昌人福药业,批号:88B09041);维酶素片(乐普恒久远药业,批号:20190705); IL-6 ELISA试剂盒(伊莱瑞特,批号:E-EL-R0015C);IL-1βELISA试剂盒(欣博盛,批号:ERC007);Trizol试剂盒(Aidlab,批号:252250AX);苏木素(Sigma,批号:H9627);伊红(国药集团,批号:71014544);磷酸酶抑制剂(碧云天,批号:S1873);PMSF(阿拉丁,批号:P105539);RIPA裂解液(碧云天,批号:P0013B);BCA蛋白浓度测定试剂盒(碧云天,批号:P0010);TEMED(国药集团,批号:80125336);兔多抗p-YAP1(Affinity,批号:Af3328);兔单抗p-STAT3(Cell signaling,批号:9145);X光胶片(锐珂,批号:6535876)等。
1.1.4 主要仪器
酶标仪(Thermo scientific Multiskan,MK3型);PCR仪(ABI,Quant Studio 6型);紫外分析仪(北京君意东方,JY02S型);电转仪(北京六一仪器厂,DYCZ-40型);凝胶成像系统(美国Aplegen公司,Omega Fluor型)等。
1.2 方法
1.2.1 分子对接
在TCMSP数据库中检索中药黄连、半夏的成分数据,以同时满足分子量(molecular weight,MW)<500、脂水分配系数(Alog P)<5、氢键供体(Hdon)<5、氢键受体(Hacc)<10、药物半衰期(drug half-life,HL)≥4、口服生物利用度(oral bioavailability,OB)≥20%、类药性(drug-likeness,DL)≥0.1筛选主要活性成分,并下载Mol2格式文件,经AutoDock Tools 1.5.7软件进行能量最小化等处理,并定义为配体。在RCSB PDB数据库中检索受体IL-1β、IL-6、YAP1、STAT3、JAK2、VEGF、EGFR所对应的PDB晶体结构文件,经Auto Dock Tools 1.5.7去水加氢等预处理后,定义活性位点,转化为PDBQT格式文件。利用Auto Dock vina软件将配体与受体进行分子对接,选取最佳(结合能得分数值越小代表结合性越好)对接构象,用Discovery Studio 2016软件分析对接构象的结合情况。为了验证本次分子对接结果的可靠性,本研究将各受体自带配体抽取出来后再次对接到原受体中,并计算对接模式的均方根偏差(root mean square deviation,RMSD)值,以RMSD≤2评估对接结果的可靠性。
1.2.2 动物分组造模与药物干预
大鼠适应性喂养1周后,随机分为6组,正常对照组(A组)、模型组(B组)、维酶素组(C组)、低剂量组(D组)、中剂量组(E组)、高剂量组(F组),每组10只。参照文献[1]建模方法复制大鼠模型,A组予以常规饲养;B~F组每日自由饮用量浓度为120 mg/L的MNNG溶液,饮水瓶用黑色塑料袋包裹后使用,此外每周(周1、周4)进行2次1 mL/100 g的MNNG溶液灌胃加强;进食2 d后禁食1 d,进食期间给予0.03 g/kg尼替丁的饲料喂养,进食第1 d予以56 ℃ 15% NaCl溶液灌胃(1 mL/100 g);禁食当天予以40%乙醇灌胃(1 mL/100 g)。造模14周时,随机挑选1只,用10%水合氯醛(0.35 mL/100 g)麻醉后,摘取胃组织进行常规HE染色观察,镜下证实胃黏膜固有腺体萎缩,表明造模成功。此后,B~F组进行灌胃治疗,B组采用生理盐水灌胃(1 mL/100 g),按照人与大鼠体表面积折算公式换算为大鼠用量,D组给予中药1.562 5 g/kg灌胃、E组给予中药3.125 g/kg灌胃、F组给予中药6.25 g/kg灌胃,C组给予维酶素0.3 g/kg灌胃,每日1次,连续干预8周。末次给药结束12 h后,用10%水合氯醛(0.35 mL/100 g)麻醉大鼠,腹主动脉取血进行血清学指标检测,摘取一部分胃组织超低温(-80 ℃)保存备用,另一部分进行形态学检测。
1.2.3 大鼠胃黏膜组织形态检测
利用10%多聚甲醛溶液固定大鼠胃组织48 h后,取胃中段组织进行梯度酒精脱水、透明、浸蜡、包埋、切片(4 μm),行苏木精-伊红(HE)染色,光学显微镜观察、拍照。
1.2.4 ELISA检测
大鼠血液样本静置30 min后,以3 000 r/min离心10 min后采集血清,按照试剂盒说明书要求进行检测,用酶标仪在450 nm波长测量各孔的光密度(OD值)。
1.2.5 实时荧光定量PCR检测
按照试剂盒说明书要求操作,采用Trizol法提取胃中段组织RNA,并逆转录成cDNA,设计引物序列(见表1),实时荧光定量PCR检测胃组织中JAK2、STAT3、AKT1、YAP1、VEGF、EGFR mRNA的表达。以GAPDH表达量作为内参,采用2-△△Ct法对数据进行分析。

表1 引物序列Table 1 Primer sequences
1.2.6 Western blot检测
参照试剂盒说明书操作要求,提取大鼠胃中段组织中总蛋白,采用酶标仪测定蛋白浓度OD值,并计算出样品蛋白浓度。依次进行蛋白变性、电泳、电泳分离、电转移(转膜条件:GAPDH,200 mA 90 min、p-STAT3,200 mA 120 min后300 mA 15 min;p-JAK2 200 mA,120 min后300 mA,30 min;p-AKT1、p-YAP1 200 mA 120 min)、ECL显色:封闭,滴加封闭液稀释的一抗(抗体稀释浓度GAPDH,1∶1 000;p-STAT3,1∶1 000;p-JAK2,1∶1 000;p-AKT1,1∶2 000;p-YAP1,1∶1 000)4 ℃孵育过夜,用TBST稀释相应的HRP标记二抗(1∶50 000稀释),室温摇床孵育2 h,显影、定影,冲洗胶片、扫描,用Band Scan分析胶片灰度值,以GAPDH为内参,目的蛋白表达量=目的蛋白灰度值/GAPDH灰度值。
1.3 统计学分析
2 结果
2.1 分子对接结果
经筛选获得符合筛选条件的有效活性成分共计13个,其中黄连8个、半夏5个,见表2所示。将这些主要活性成分与IL-1β、IL-6、YAP1、STAT3、JAK2、VEGF、EGFR进行分子对接,对接结果表明13种主要活性成分均能与靶标结合,选取最佳对接构象作图(见图1),结合能得分见热图所示(见图2)。在对接验证过程中,将各受体的原配体抽取出来后重新对接到原受体中,计算出的RMSD值均<2,说明对接参数可靠,对接结果可信。分子对接结果提示:黄连半夏主要活性物质能够作用于慢性萎缩性胃炎发生机制中的IL-1β、IL-6、YAP1、STAT3、JAK2、VEGF、EGFR靶标,进而发挥干预作用,其中主要活性成分与JAK2的结合能得分性最为突出,推测JAK2可能是其发挥防治作用的核心靶标之一,黄连碱(coptisine)可能是最佳成分之一。
表2 黄连、半夏中潜在活性化合物信息Table 2 Information of potential active compounds in CR and PR
2.2 对大鼠胃黏膜组织病理变化的影响
HE染色后镜下观察发现(见图3):A组大鼠胃黏膜组织上皮完整,腺体、细胞排列整齐,无炎症浸润;B大鼠胃黏膜组织上皮萎缩,腺体数目减少、排列紊乱,大量炎症浸润,部分肠上皮化生;C组较B组好转,但腺体排列仍紊乱、萎缩,炎症浸润,少量肠上皮化生;D、E、F组较B、C组明显好转,但腺体数量较少,未见明显肠化生。HE染色结果提示:黄连半夏水煎液能够对化学物质损伤与饥饱失常状态下的慢性萎缩性胃炎大鼠胃黏膜组织起到抑制炎症和修复作用。
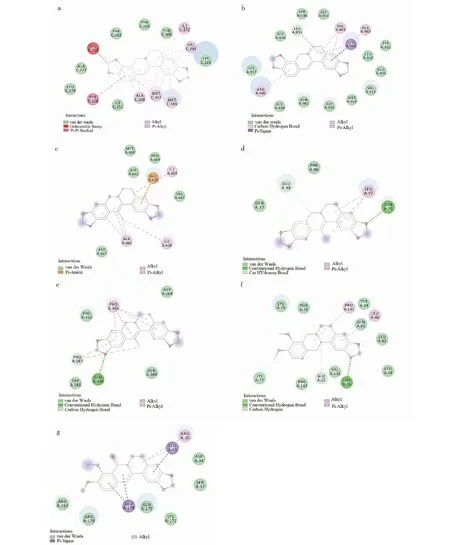
图1 分子对接结果(2D)Fig.1 Molecular docking results(2D)注:a:黄连碱与YAP1;b:黄连碱与JAK2;c:甲基黄连碱与STAT3;d:甲基黄连碱与VEGF;e:甲基黄连碱与EGFR;f:(R)-Canadine与IL1β;g:小檗浸碱与IL-6。Note:a:Coptisine and YAP1; b:Coptisine and JAK2; c:Worenine and STAT3; d:Worenine and VEGF; e:Worenine and EGFR; f:(R)-Canadine and IL1β (2D); g:Berlambine and IL-6.
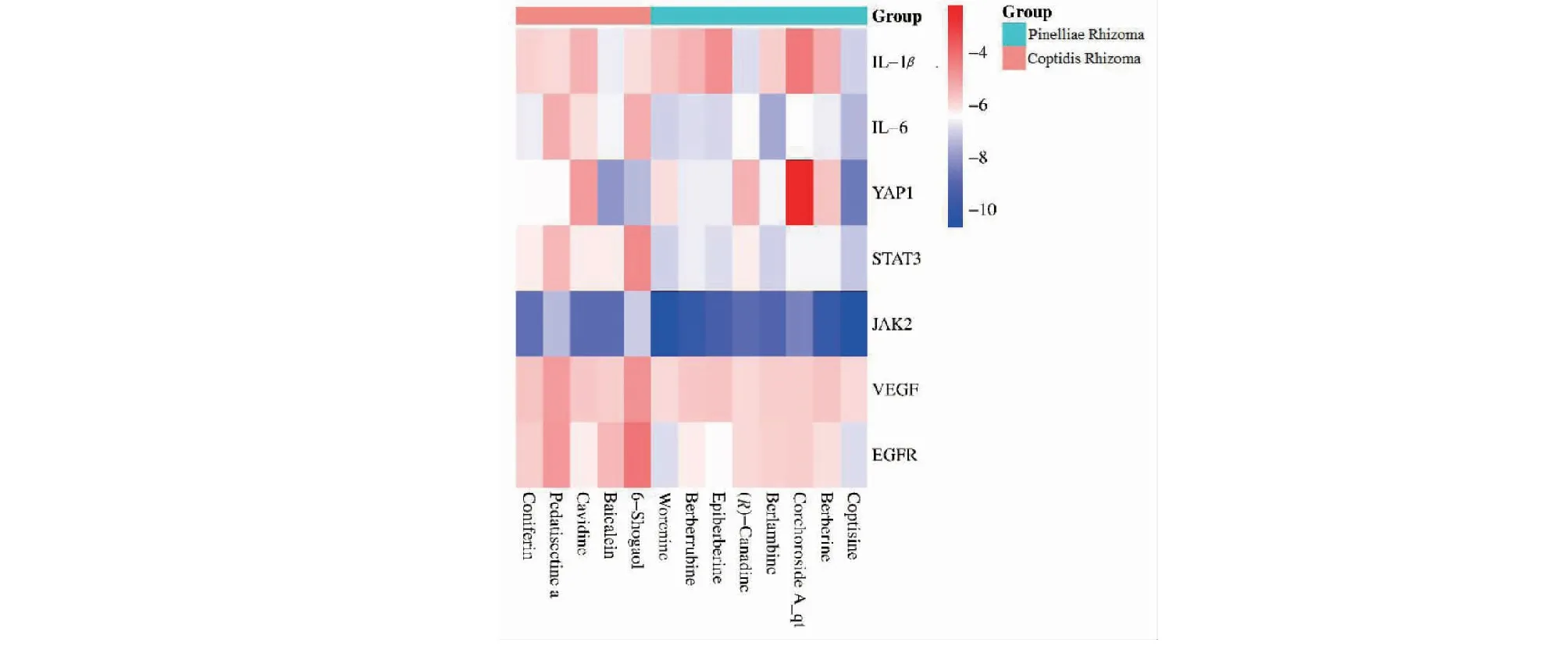
图2 分子对接得分热图Fig.2 Heat map of molecular docking scoring
2.3 对大鼠血清炎症因子IL-6、IL-1β浓度的影响
血清酶联免疫检测发现:B组大鼠血清IL-6、IL-1β浓度较A组显著升高(P<0.01),差异具有统计学意义;C、D、E、F组较B组显著降低(P<0.01)差异?统计学意义。见图4所示。结果提示:造模后大鼠血清炎症水平(IL-1β、IL-6)呈明显上升趋势,黄连、半夏药对水煎液能够显著降低血清炎症因子水平,发挥抑制炎症的治疗作用,特别以中剂量作用显著,并较维酶素更具有优势。
2.4 对大鼠胃黏膜组织中各指标 mRNA表达的影响
经过对大鼠胃组织进行RT-PCR检测发现(见图5):在YAP1、JAK2、STAT3、AKT1、VEGF、EGFR mRNA表达量上,B组显著高于A组(P<0.01)差异具有统计学意义。经过治疗干预后,C组在AKT1 mRNA水平上与B组没有统计学意义(P>0.05),在YAP1、JAK2、STAT3、VEGF、EGFR mRNA水平上均显著低于B组(P<0.01)差异具有统计学意义。D、E、F组在各指标水平上均显著低于B、C组(P<0.01)差异具有统计学意义。
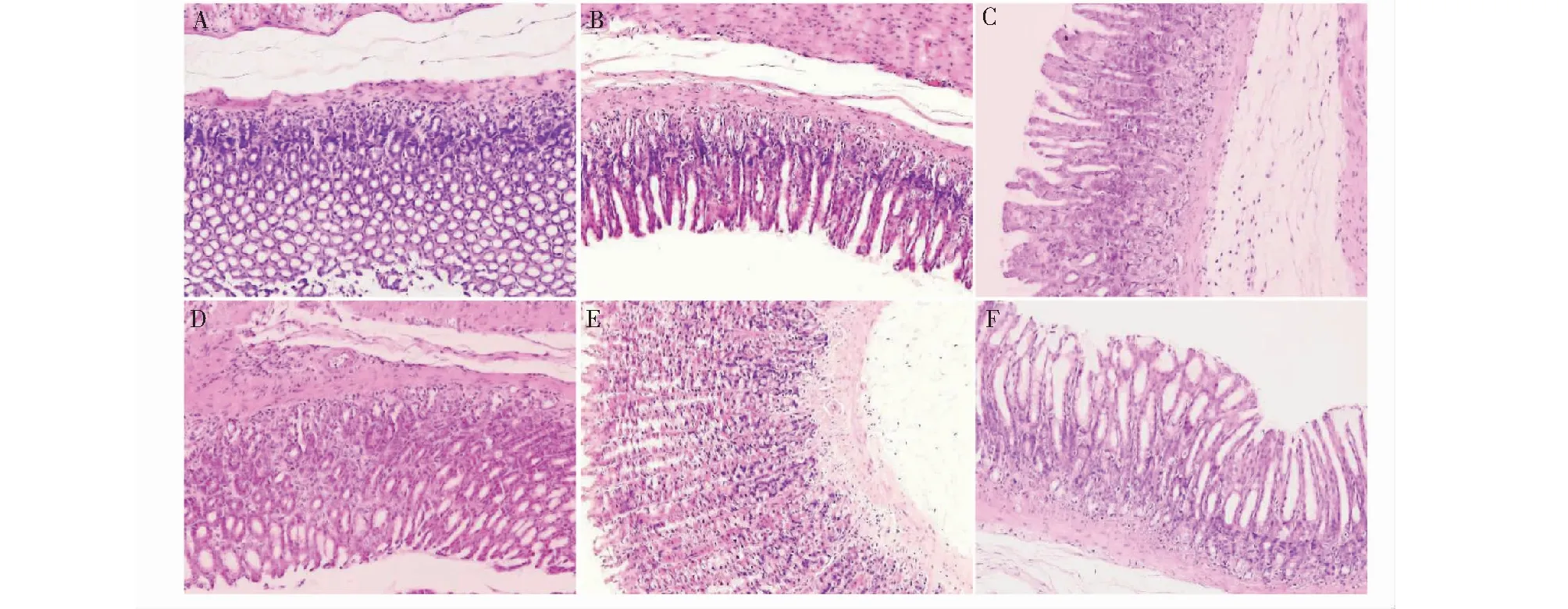
图3 各组大鼠胃组织HE染色(×200)Fig.3 HE staining of gastric tissues of rats in each group (×200)注:A:正常对照组;B:模型组;C:维酶素组;D:低剂量组;E:中剂量组;F:高剂量组,下同。Note:A:Normal control group; B:Model group;C:Vitase group; D:Low-dose group; E:Medium-dose group; F:High-dose group,the same below.
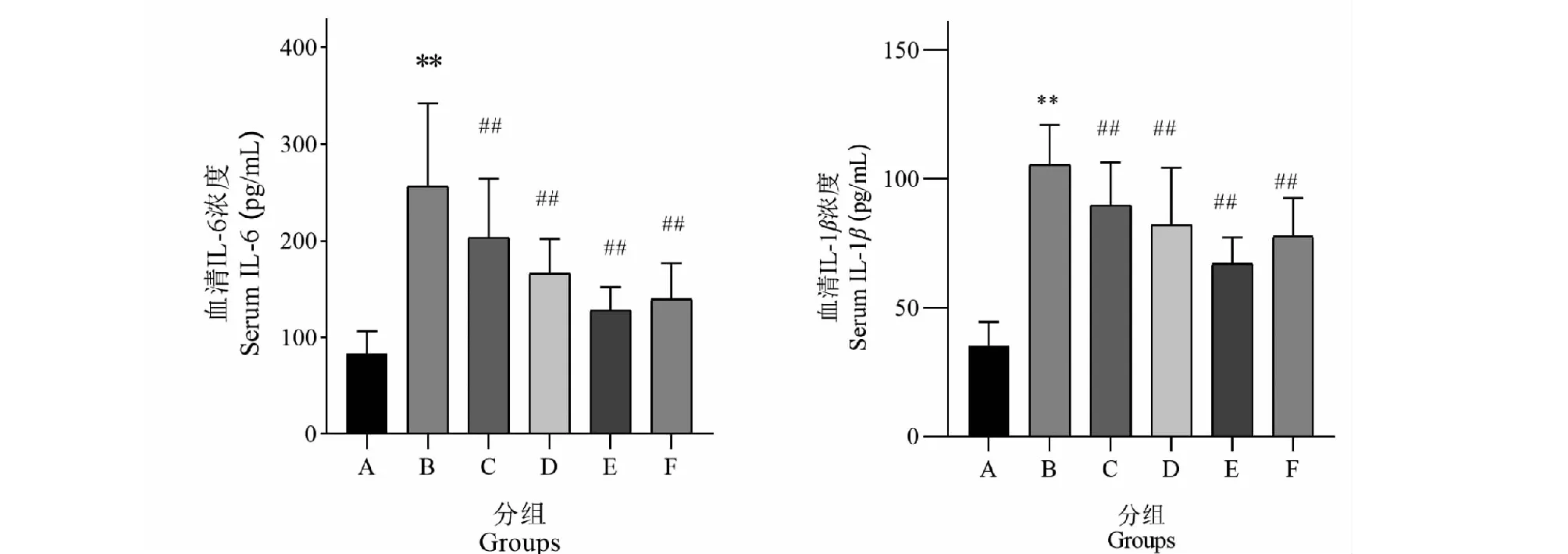
图4 血清IL-6、IL-1β浓度Fig.4 Serum concentrations of IL-6 and IL-1β 注:与A组比较,**P<0.01;与B组比较,##P<0.01。Note:Compared with group A, **P < 0.01; Compared with group B,##P < 0.01.
RT-PCR实验结果提示:模型大鼠胃黏膜组织中YAP1、JAK2、STAT3、AKT1、VEGF、EGFR mRNA水平显著升高,呈现过表达状态,经过黄连、半夏水煎液灌胃干预后,显著下调了相关靶标的表达水平,对慢性萎缩性胃炎具有治疗作用,其作用机制与调控JAK2/STAT3炎症信号通路和血管新生途径(VEGF、EGFR)有关。

图5 各组胃组织中YAP1、STAT3、JAK2、AKT1、VEGF、EGFR mRNA的表达Fig.5 mRNA expressions of YAP1,STAT3,JAK2,AKT1,VEGF and EGFR in gastric tissues of each s,n = 10)注:与A组比较,**P<0.01;与B组比较,#P<0.05,##P<0.01。Note:Compared with group A,**P < 0.01; Compared with group B,#P<0.05,##P<0.01.
2.5 对大鼠胃黏膜组织各关键指标磷酸化水平的影响
经过WB实验检测发现(见图6所示):在p-YAP水平上,B组显著低于A组(P<0.01)差异具有统计学意义,C、D、E、F组均较B组显著升高(P<0.01)差异具有统计学意义。表明造模后的胃黏膜组织中p-YAP水平较正常状态下的表达水平有所降低,经过药物干预后的p-YAP水平显著上调,黄连、半夏水煎液的上调作用显著优于维酶素。
在p-STAT3、p-AKT1、p-JAK2水平上,B组显著高于A组(P<0.01)差异具有统计学意义,C、D、E、F组较B组显著降低(P<0.01)差异具有统计学意义。表明模型大鼠胃黏膜组织中p-STAT3、p-AKT1、p-JAK2水平显著高于正常大鼠,持续的炎症刺激促进了JAK2/STAT3炎症信号通路的激活,经过黄连、半夏水煎液干预后的磷酸化水平明显下调,抑制了JAK2/STAT3信号通路的激活。

图6 各组大鼠胃黏膜组织中p-STAT3、p-YAP、p-AKT1、p-JAK2表达水平Fig.6 Expression levels of p-STAT3,p-YAP,p-AKT1 and p-JAK2 in gastric mucosa of rats in each s,n = 10)注:与A组比较,**P<0.01;与B组比较,##P<0.01。Note:Compared with group A,**P < 0.01; Compared with group B,#P<0.05,##P<0.01.
3 讨论与结论
黄连、半夏作为半夏泻心汤、连朴饮、黄连温胆汤的共同使用中药,在各方剂中发挥“君臣”作用。黄连属毛茛科黄连属多年生草本植物,主要含生物碱类、黄酮类、木脂素类、酸性成分等,具有清热燥湿、泻火解毒的功效[7];半夏属天南星目天南星科半夏属植物,含有生物碱、有机酸、甾醇类、氨基酸、挥发油、无机元素等多种化学成分,具有燥湿化痰、降逆止呕的作用[8]。黄连半夏相配,一温一寒无药性过偏之虑,一辛一苦辛开苦降调畅气机,一清一消清消结合,共同发挥和胃止呕、清热化痰、消痞散结、解毒消肿的效用,切合慢性萎缩性胃炎的病因病机规律。本次研究通过严格的Lipinski规则筛选到黄连与半夏中所含的13种主要活性成分,其中黄连8种、半夏5种。通过分子对接发现,以小檗碱、甲基黄连碱等为代表的主要活性成分均能与慢性萎缩性胃炎的核心靶标IL-1β、IL-6、YAP1、STAT3、JAK2、VEGF、EGFR结合,一定程度上代表了黄连、半夏防治慢性萎缩性胃炎的主要药效物质基础。
现代研究发现,炎症作为慢性萎缩性胃炎早期的主要病理改变,在“非可控性炎症”作用下促使病变的胃黏膜组织向恶性转化,加速癌症的早期血管生成。临床与实验研究证实慢性萎缩性胃炎胃黏膜中JAK2/STAT3等炎症信号通路的激活[9],促炎细胞因子(IL-6、IL-1β等)表达上调[10],血管新生途径(VEGF、EGFR等)的活化在这一演变过程中发挥着重要的作用。YAP1作为Hippo信号通路中关键的转录共激活因子,调控着细胞的生长、增殖和凋亡[11]。在正常情况下YAP1以磷酸化的形式存在于细胞浆中,参与器官及组织的再生调节。在非可控性炎症等上游异常信号作用下,YAP1去磷酸化后进入细胞核,促进相关癌症基因的表达与细胞增殖,并决定着致癌活性的大小[12,13]。AKT1参与胃癌的发生发展及浸润转移[14],干扰AKT1表达能抑制胃癌细胞增殖与迁移[15,16]。因此,IL-1β、IL-6、YAP1、STAT3、JAK2、AKT1、VEGF、EGFR在慢性萎缩性胃炎的发病机制中发挥着重要的作用,是防治其向恶行发展的重要靶标。
本次实验在MNNG溶液、热盐、乙醇等化学物质及饥饱失常等复杂条件的长期刺激下,添加含雷尼替丁(临床常用的选择性H2受体拮抗剂)饲料以抑制模型动物的胃酸分泌,促使饮用入胃的硝酸盐快速转为亚硝酸盐,加速造模。经HE病理检测发现该方法成功建立了慢性萎缩性胃炎模型。维酶素是目前用于治疗慢性萎缩性胃炎的常见西药,主要成分为核黄素、黄素单核苷酸以及多种维生素及氨基酸,具有促进胃黏膜上皮与腺上皮再生的作用,与多成分的中药具有较强的对比意义。经过对各指标进行检测发现,在大鼠血液中的炎性细胞因子IL-6、IL-1β显著升高,形成炎症微环境;引起p-JAK2、p-STAT3水平的升高,激活JAK2/STAT3信号通路,促使炎症向非可控性发展,进而导致VEGF、EGFR活化,加速癌症的早期新生血管形成,并引发YAP1去磷酸化(p-YAP1),导致AKT1的过表达,进而损伤胃黏膜组织形态,诱导慢性萎缩性胃炎向恶性肿瘤演变。经过黄连半夏药对中多种活性成分共同干预治疗后,显著抑制了血清炎性细胞因子IL-6、IL-1β的表达,同时降低了胃黏膜组织中JAK2/STAT3信号通路关键指标的磷酸化水平,抑制通路激活,改善炎症微环境,降低组织中VEGF、EGFR的表达,进而影响肿瘤血管新生,并调控YAP1、AKT1的过表达,修复受损的组织形态,延缓或阻断慢性萎缩性胃炎向恶性转变,进而对慢性萎缩性胃炎发挥治疗作用,在这一过程中以黄连半夏配伍的中剂量具有显著优势,且优于维酶素,没有发现剂量依赖。因此,我们认为黄连、半夏是防治慢性萎缩性胃炎的核心药物,其作用机制与调控炎症信号通路、抑制肿瘤血管新生等途径密切相关。
