对羟基苯甲酸及其钠盐在小鼠和食蟹猴体内药代动力学及组织分布研究
2022-11-26杨营营魏承琼韦杏淑王宇晖段小群
杨营营,魏承琼,韦杏淑,王宇晖*,段小群
1桂林医学院药学院;2桂林医学院生物医药产业学院,桂林 541199
对羟基苯甲酸(p-hydroxybenzoic acid,p-HBA)是一种单羟基酚酸,是自然界中常见的化合物,存在于高等植物、微生物、苔藓和土壤中[1]、具有抗菌[2]、抗氧化[3]、抗炎[4]和抗癌[5]等多种药理活性。前期研究发现p-HBA是地皮菜活性成分对羟基苯甲醛的活性代谢物,通过抑制炎症反应和改善肠黏膜损伤发挥抗结肠炎作用[6]。可见,p-HBA可作为治疗溃疡性结肠炎的潜在化合物,具有良好的开发前景。然而,课题组前期研究结果显示,p-HBA的水溶性较差,还伴随脾脏肿大等不良反应[7],严重影响了其进一步开发。因此,课题组对其钠盐对羟基苯甲酸钠(sodiump-hydroxybenzoate,s-HBA)进行研究,发现其稳定性较好,副作用不明显,且水溶性较好,pH接近于中性或弱酸性,便于医用,又不改变药理活性;而从药物代谢角度看,成盐后的药物更容易被人体吸收利用。同时为了进一步了解p-HBA和s-HBA在体内的吸收、分布规律,本文开展了p-HBA和s-HBA的药代动力学及组织分布特征的系统研究,为s-HBA的进一步开发利用提供科学依据。
1 材料与方法
1.1 药物与试剂
p-HBA(C7H6O3,分子量138.12,纯度≥98%,批号:S30121),s-HBA(C7H5NaO3,分子量160.1,纯度≥99%,批号为A04J11L107606),购自上海源叶生物科技有限公司;甲苯磺丁脲(批号:20-01-0903,中国食品药品检定研究所);肝素钠注射液(成都市海通药业有限公司);甲醇(色谱纯,美国Fisher Scientific公司);乙腈(色谱纯,美国Fisher Scientific公司);乙酸(色谱纯,美国Fisher Scientific公司);实验用水为纯化水。
1.2 动物
本实验的所有程序均经过桂林医学院动物伦理委员会的严格审核和批准,动物协议批准文号为GLMC201904008。SPF级C57BL/6小鼠,雌雄各半,共192只,体重18~22 g,购自昭衍(苏州)新药研究中心有限公司,动物许可证号SCXK(苏)2018-0006,饲养于温度23~27 ℃、湿度45%~65%、12 h光/暗循环条件下,适应性喂养7天后开始实验,给药前自由饮水,禁食12 h。
本实验的所有程序均经过桂林医学院动物伦理委员会的严格审核和批准,动物协议批准文号为GLMC201904010。食蟹猴,4只雄性,2只雌性,体重2~3 kg,2~3岁龄,购自永福县康顺生物科技有限公司,动物许可证号SCXK桂-2018-0006。实验动物的饲养场所为桂林医学院动物实验中心,室温21~25 ℃,相对湿度40%~60%,通风换气8次/h,光照周期10~14 h。实验动物于非人灵长类动物饲养笼内进行单笼饲养,保持与邻近实验动物进行听觉、视觉上的交互,并且在实验过程中,每天会周期性地打开笼隔,增加实验动物间的交互性活动,给药前自由饮水,禁食12 h。
1.3 方法
1.3.1 色谱条件
ZORBAX Eclipse XDB-C18色谱柱(150 mm × 2.1 mm,5 μm);流动相A为0.1%乙酸水溶液,B为乙腈,流速为0.6 mL/min,梯度洗脱(见表1);柱温40 ℃;进样量1 μL(小鼠血浆,小鼠肝、肾组织),3 μL(食蟹猴血浆及其他小鼠组织)。
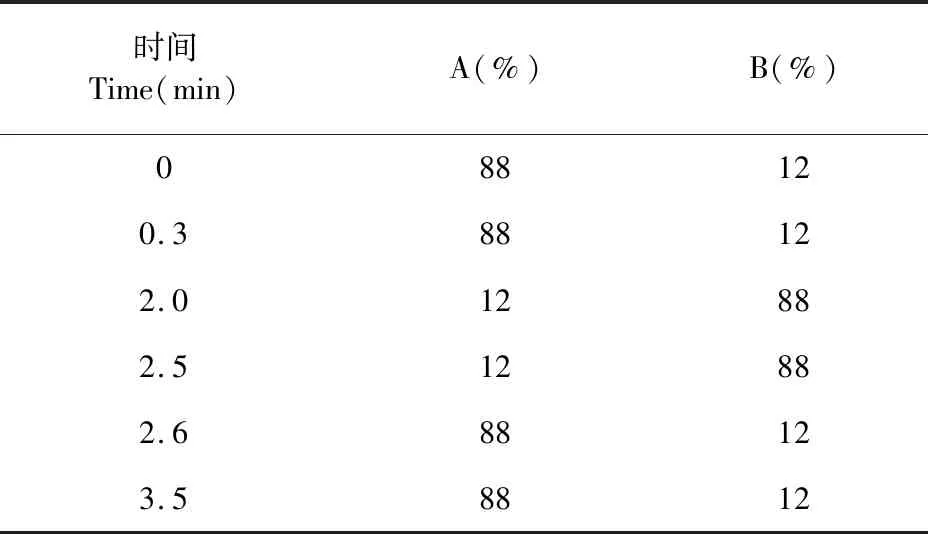
表1 流动相梯度洗脱程序Table 1 Gradient elution program of mobile phase
1.3.2 质谱条件
采用电喷雾离子化(ESI),负离子模式,电喷雾电压-4 500 V,离子源温度550 ℃,雾化气55 psi,干燥气55 psi,扫描方式为多反应监测(MRM)模式。p-HBA监测离子对为m/z136.80→m/z93.00,甲苯磺丁脲(内标)监测离子对为m/z269.10→m/z169.80。质谱参数如表2,二级质谱图见图1。
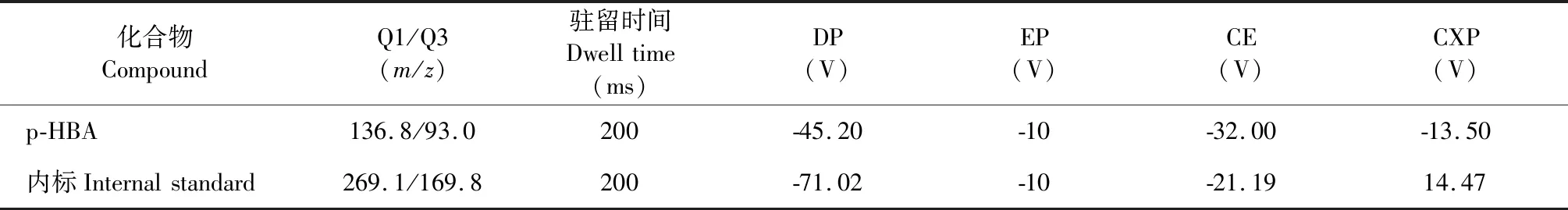
表2 质谱参数Table 2 Mass spectrum parameters

图1 p-HBA(A)、甲苯磺丁脲(B)的二级色谱图Fig.1 Secondary chromatogram of p-HBA (A) and tolbutamide (B)
1.3.3 对照品和内标溶液的制备
精密称量116.78 mg s-HBA(折算盐系数后即为p-HBA),用甲醇溶解并定容于10 mL,配制成浓度均为10 mg/mL的储备液,于-20 ℃保存。实验时用50%甲醇水稀释成500 000、200 000、100 000、50 000、20 000、10 000、5 000、1 000 ng/mL的标准系列工作溶液1。用50%甲醇水稀释成50 000、20 000、10 000、5 000、2 000、1 000、500、100 ng/mL的标准系列工作溶液2。用50%甲醇水稀释成200 000、80 000、40 000、20 000、8 000、4 000、2 000、400 ng/mL的标准系列工作溶液3。
精密称量甲苯磺丁脲10 mg,用甲醇溶解并定容于10 mL,配制成浓度为1 mg/mL的内标储备液,于-20 ℃保存,使用时用乙腈稀释成100 ng/mL。
1.3.4 药代动力学研究
1.3.4.1 小鼠药代动力学研究
取48只小鼠随机分为8小组,每组6只。单次灌胃给予20 mg/kg的p-HBA水溶液,给药浓度为2 mg/mL,于给药后0.03、0.08、0.17、0.25、0.5、1.00、2.00、4.00 h眼眶取血约0.2 mL,置于肝素钠化的离心管中,离心10 min,离心条件为4 ℃,4 000 r/min,吸取血浆于标记好的离心管中,于-80 ℃保存待测。
另取144只小鼠,分为三个大组,每组48只,分别单次灌胃给予20、50、100 mg/kg的s-HBA水溶液。给药浓度分别为2、5、10 mg/mL,同样于给药后0.03、0.08、0.17、0.25、0.5、1.00、2.00、4.00 h眼眶取血于肝素钠化的离心管中,4 ℃,4 000 r/min,10 min,转移血浆于另一个离心管中,于-80 ℃保存待测。
1.3.4.2 食蟹猴药代动力学研究
取6只食蟹猴,单次周期共三次给药,每次给药后至少清洗7天后再进行下一次给药。s-HBA的给药剂量分别为4、10、20 mg/kg,给药浓度分别为2、5、10 mg/mL。于每次给药前(0)和给药后0.03、0.08、0.13、0.17、0.25、0.50、0.75、1.00、1.50、2.00、4.00、6.00 h后肢静脉采血约0.5 mL于肝素钠化的离心管中。离心(4 ℃,4 000 r/min)10 min,取上清液于新的离心管中,于-80 ℃保存待测。
1.3.5 组织分布研究
将C57BL/6小鼠随机分为两组,分别灌胃给予20 mg/kg的p-HBA水溶液和100 mg/kg的s-HBA水溶液,分别于给药后0.03、0.08、0.17、0.25、0.50、1.00、2.00、4.00 h处死,解剖各组小鼠,分别取心、肝、脾、肺、肾、脑和结肠共7种组织,用生理盐水冲洗干净,滤纸吸干。精密称取各组织的重量,剪碎后置于匀浆管内,按组织与生理盐水1∶4(g∶mL)的比例进行匀浆,匀浆液于-80 ℃保存待测。
1.3.6 样本前处理
1.3.6.1 血浆样本前处理
精密吸取50 μL小鼠(或食蟹猴)血浆样品,加入500 μL(或300 μL)内标标准工作溶液(100 ng/mL),涡旋混合3 min,离心(4 ℃,15 000 r/min)10 min,取上清液100 μL,加入等体积纯化水,涡旋混匀后进样分析。
1.3.6.2 组织样本前处理
精密吸取50 μL各组织匀浆液,肝和肾样品分别加入500 μL内标标准工作溶液(100 ng/mL),心、脾、肺、脑和结肠组织样品则分别加入300 μL内标标准工作溶液。所有组织涡旋混合3 min,离心(4 ℃,15 000 r/min)10 min,取上清液100 μL,加入等体积纯化水,涡旋混匀后进样分析。
2 结果
2.1 专属性
取空白小鼠血浆(小鼠组织)样品、加入p-HBA和甲苯磺丁脲标准品的小鼠血浆(小鼠组织)样品和灌胃给药后小鼠血浆(小鼠组织)样品;同样取食蟹猴血浆样品、加入p-HBA和甲苯磺丁脲标准品的食蟹猴血浆和灌胃给药后食蟹猴血浆。上述样本按照“1.3.6”项下方法进行操作并进行分析得到色谱图,结果见图2和图3。结果表明,在所选定的液相和质谱条件中,p-HBA和甲苯磺丁脲基线分离,并且血浆中的内源性成分在两者的出峰时间均无干扰。

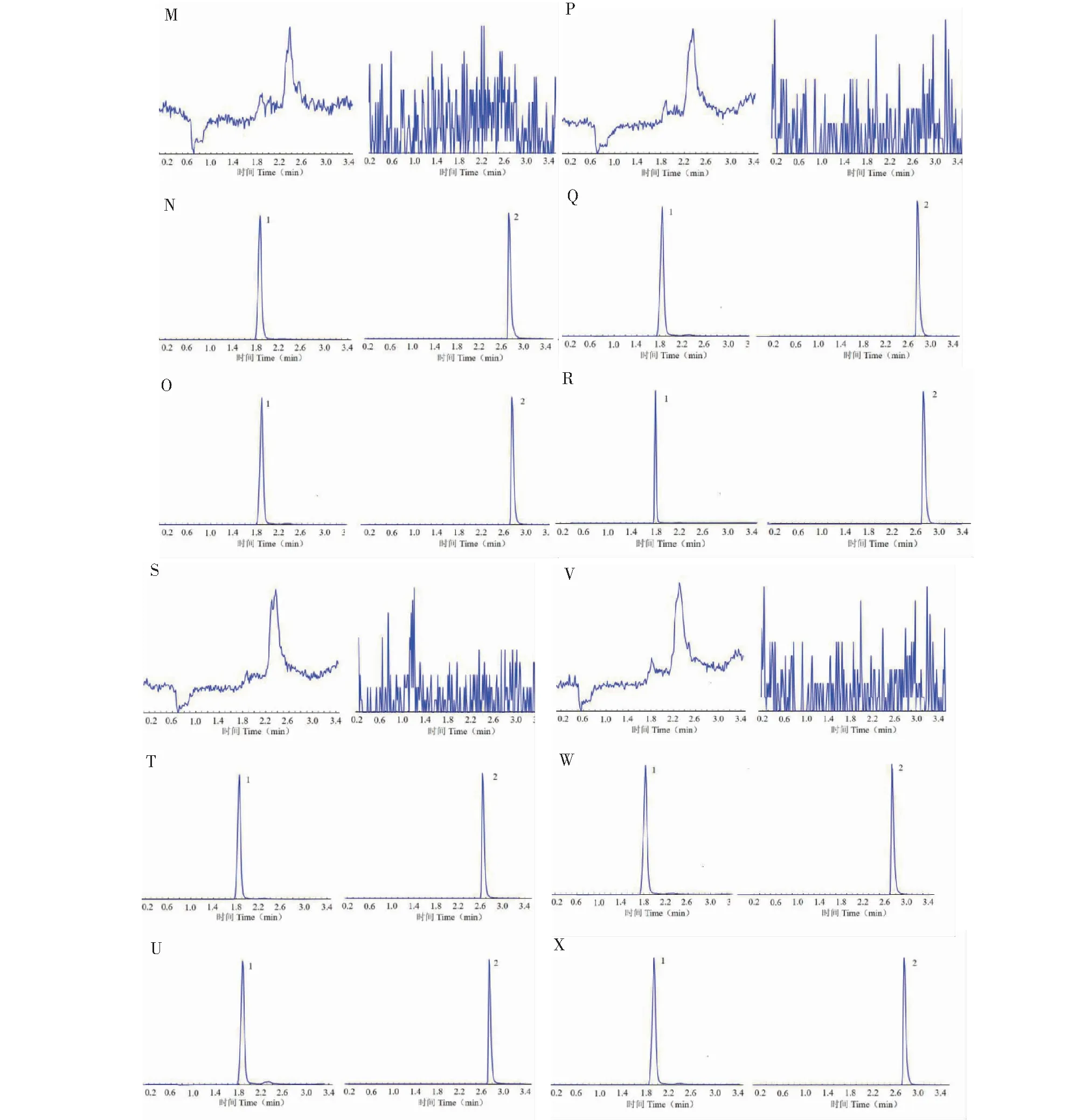
图2 p-HBA在小鼠中的特异性色谱图Fig.2 Specific chromatograms of p-HBA in mouse 注:A~C:小鼠血浆样本;D~F:肾脏组织样本;G~I:肝脏组织样本;J~L:心脏组织样本;M~O:肺组织样本;P~R:脾脏组织样本;S~U:脑组织样本;V~X:结肠组织样本;A、D、G、M、P、S、V:空白血浆(组织)样本;B、E、H、N、Q、T、W:空白血浆(组织)加对照品样本;C、F、I、L、O、R、U、X:灌胃s-HBA后的血浆(组织)样本;1:p-HBA;2:甲苯磺丁脲。Note:A-C:Mouse plasma samples;D-F:Kidney tissue samples;G-I:Liver tissue samples;J-L:Heart tissue sample;M-O:Lung tissue sample;P~R:Spleen tissue sample;S~U:Brain tissue samples;V-X:Colon tissue samples;A.D,G,M,P,S,V:Blank plasma (tissue) samples;B.E,H,N,Q,T,W:Blank plasma (tissue) plus control samples;C.F,I,l,O,R,U,X:Plasma (tissue) samples after intragastric administration of s-HBA;1:p-HBA;2:Tolbutamide.
2.2 标准曲线和线性范围
2.2.1 血浆样品
2.2.1.1 小鼠血浆样品
吸取45 μL小鼠空白血浆,精密加入5 μL不同浓度的p-HBA标准系列工作溶液1,分别配制成系列浓度为100、500、1 000、2 000、5 000、10 000、20 000、50 000 ng/mL的标准小鼠血浆样本。按照“1.3.6”项下方法进行处理分析。以p-HBA峰面积与甲苯磺丁脲峰面积之比为纵坐标,以待测物浓度与内标(内标浓度归一化)之比为横坐标,线性拟合成标准曲线,权重设置w=1/x2,所得方程为Y=0.000 757X+0.304 984,r=0.996 5。定量下限此时设为100 ng/mL,S/N大于10。表明方法在100~50 000 ng/mL的线性范围良好。

图3 p-HBA在食蟹猴中的特异性色谱图Fig.3 Specific chromatograms of p-HBA in monkey注:A:空白食蟹猴血浆样本;B:空白食蟹猴血浆加p-HBA和内标标准品样本;C:灌胃s-HBA后的食蟹猴血浆样本;1:p-HBA;2:甲苯磺丁脲。Note:A:Blank monkey plasma samples;B:Blank monkey plasma sample plus p-HBA and internal standard;C:Monkey plasma sample after intragastric administration of s-HBA;1:p-HBA;2:Tolbutamide.
2.2.1.2 食蟹猴血浆样品
吸取45 μL食蟹猴空白血浆,精密加入5 μL不同浓度的p-HBA标准系列工作溶液2,配制成系列浓度10、50、100、200、500、1 000、2 000、5 000 ng/mL的标准食蟹猴血浆样本。按照“1.3.6”项下方法进行处理分析,所得方程为Y=0.000 734X+0.008 59,r=0.998 6。此时定量下限为10 ng/mL,S/N大于10。
2.2.2 组织样品
精密吸取45 μL各小鼠空白组织匀浆液,分别加入5 μL不同浓度的p-HBA标准系列工作溶液1,所得标准曲线用来计算肝脏和肾脏组织中p-HBA的浓度,加入5 μL不同浓度的p-HBA标准系列工作溶液3则用来计算心、脾、肺、脑和结肠等组织的浓度。p-HBA在各组织中的标准曲线及线性范围见表3。
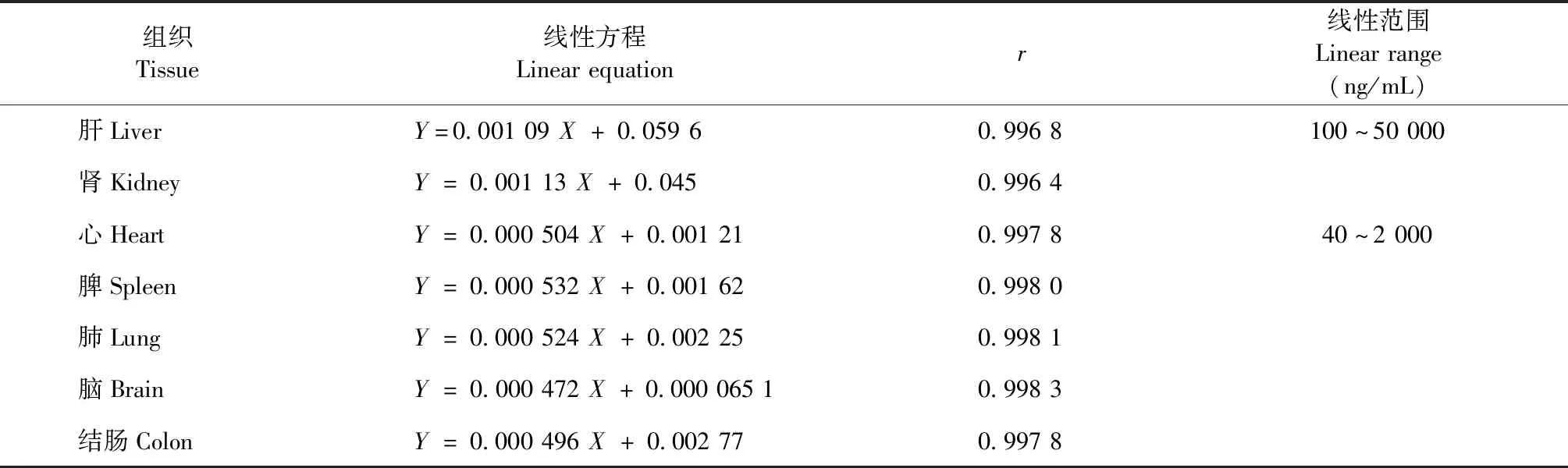
表3 小鼠各组织中p-HBA的线性方程和线性范围Table 3 The linear equations of p-HBA in various tissues of mice
2.3 精密度和准确度
取小鼠空白血浆45 μL,加入5 μL不同浓度的p-HBA配制成定量下限、低、中、高4个质控浓度(100、200、8 000、40 000 ng/mL)的质控样品,每个浓度平行6份,考察日内精密度和准确度;连续测定3批(至少2天)来考察日间精密度和准确度。精密度以相对标准偏差(RSD)表示,准确度以相对误差(RE)表示。分析结果见表4。
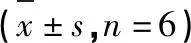
表4 p-HBA在小鼠血浆中的精密度和准确度Table 4 The precision and accuracy of p-HBA in plasma of
2.4 基质效应
精密吸取45 μL小鼠空白血浆,加入5 μL不同浓度的p-HBA标准溶液配制为低、中、高3个浓度(200、8 000、40 000 ng/mL)的质控样品,每个浓度平行6份,然后按照“1.3.6”项下方法进行处理并分析,得到的峰面积记为PA1。用空白血浆预处理后得到的上清液配制3个质控样品至最终进样浓度,每个浓度平行6份,进样分析得到的峰面积计为PA2。用纯溶液配制3个质控样品至最终进样浓度,每个浓度平行6份,进样分析得到的峰面积计为PA3。以PA1与PA2峰面积的比值计算提取回、收率,PA2与PA3峰面积的比值计算基质效应。经测定,提取回收率和基质效应结果见表5。3个浓度的质控样品和内标的提取回收率分别为97.41%、100.30%、102.22%和102.35%;基质效应分别为109.46%、94.58%、100.72%和101.57%。
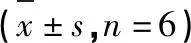
表5 p-HBA和甲苯磺丁脲在小鼠血浆中的提取回收率和基质效应Table 5 Matrix effect and recovery of p-HBA and Tolbutamide in mice
2.5 稳定性
精密吸取45 μL小鼠空白血浆,加入5 μL不同浓度的p-HBA标准溶液配制为低、高2个浓度(200、40 000 ng/mL)的质控样品,每个浓度平行3份。处理后柱后保存24 h进样分析;考察血浆样品在室温保存24 h、进柱后24 h的稳定性、-80 ℃保存28 d的长期稳定性以及反复冻融5次后的冻融稳定性。按“1.3.6”项处理后进样分析,结果见表6。

表6 p-HBA在小鼠血浆中的稳定性(n = 3)Table 6 The stability of p-HBA in mice plasma (n = 3)
2.6 药代动力学研究
2.6.1 小鼠体内的药代动力学研究
小鼠单次灌胃20 mg/kg的p-HBA水溶液和单次灌胃20、50、100 mg/kg的s-HBA水溶液后测得的血药浓度曲线图见图4,相应的药代动力学参数见表7。血药浓度曲线表明p-HBA和s-HBA给药后,两者浓度随时间变化趋势相似,具有迅速吸收和快速消除特点。
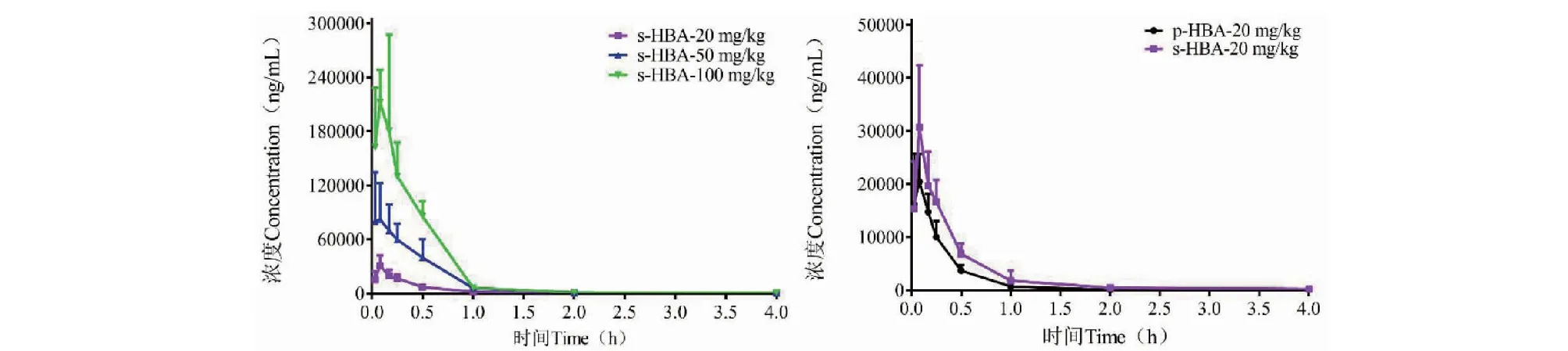
图4 小鼠单次灌胃p-HBA水溶液和s-HBA水溶液后的平均血药浓度-时间曲线Fig.4 Mean plasma concentration-time profiles of p-HBA and s-HBA after a single oral administration of
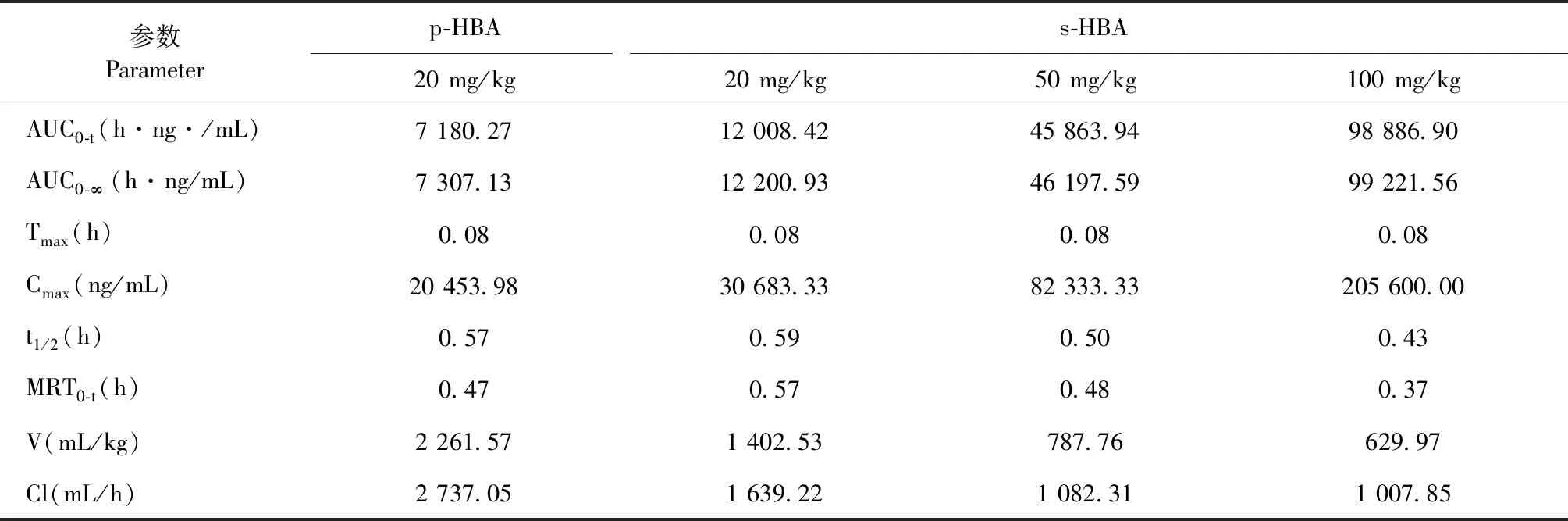
表7 小鼠单次灌胃p-HBA和s-HBA后的主要药代动力学参数(n = 6)Table 7 Main pharmacokinetic parameters after a single oral administration of p-HBA and s-HBA (n = 6)
2.6.2 食蟹猴体内的药代动力学研究
食蟹猴单次灌胃4、10、20 mg/kg的s-HBA水溶液后测得的血药浓度曲线图见图5,相应的药代动力学参数见表8。血药浓度曲线表明,s-HBA三个剂量组给药后浓度随时间变化趋势相似,同样被迅速吸收和快速消除。
2.7 小鼠体内的组织分布研究
小鼠单次灌胃20 mg/kg的p-HBA水溶液和100 mg/kg的s-HBA水溶液后不同时间点的分布情况见图6、表9和表10。组织分布结果显示,p-HBA和s-HBA水溶液灌胃给药后均能快速分布到组织中,以肾脏组织浓度分布最高,均在0.17 h时达到最高浓度,其余组织也均在0.17 h之内达峰。此外,检测的组织中1 h后消除均大于80%。p-HBA水溶液给药后组织分布情况为肾>肝>肺>结肠>心>脾>脑;s-HBA水溶液给药后分布情况为肾>肝>肺>心>脾>结肠>脑。
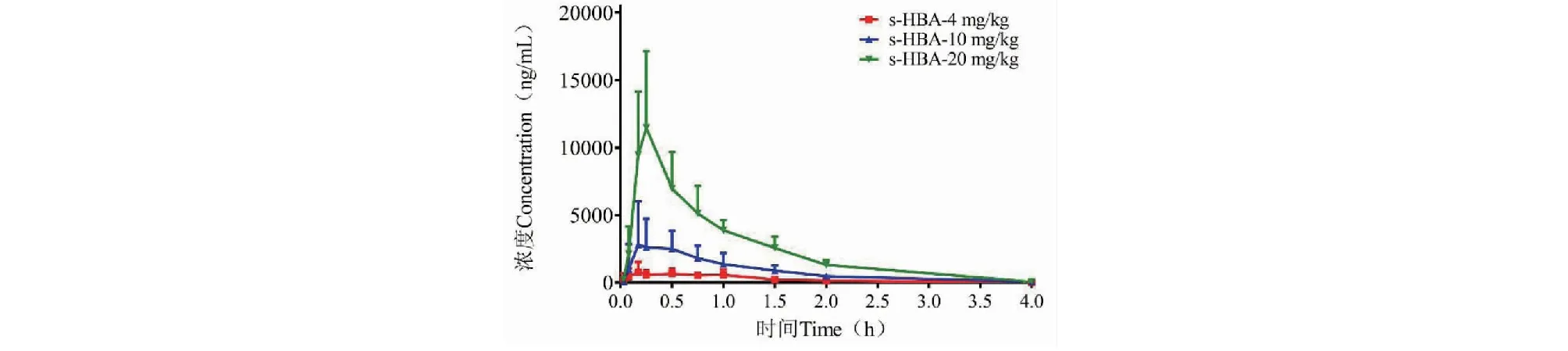
图5 食蟹猴单次灌胃s-HBA水溶液后的平均血药浓度-时间曲线Fig.5 Mean plasma concentration-time curves of s-HBA after a single administration of
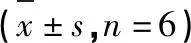
表8 食蟹猴单次灌胃s-HBA后的主要药代动力学参数Table 8 Main pharmacokinetic parameters of of s-HBA after single intragastric administration in
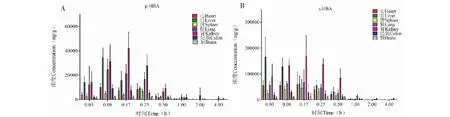
图6 小鼠单次灌胃p-HBA和s-HBA水溶液后的组织分布图Fig.6 Tissue distribution of p-HBA and s-HBA after single intragastric administration of mice
表9 小鼠单次灌胃p-HBA水溶液后的组织分布浓度Table 9 Tissue distribution of p-HBA after single intragastric administration of
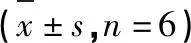
表10 小鼠单次灌胃s-HBA水溶液后的组织分布浓度Table 10 Tissue distribution of s-HBA after single intragastric administration of
3 讨论与结论
本研究基于前期药效实验研究,而后期也将会对溃疡性结肠炎造模后的小鼠继续进行药代动力学研究,研究其病理状态对p-HBA和s-HBA药代动力学的影响,为保持与药效研究一致,因此继续选用在组织病理学方面与人类结肠炎最为相似的C57BL/6小鼠造模来开展药代动力学实验。本研究在预实验中通过设计密集的采样点,采样时长为24 h,并根据预实验结果,对p-HBA和s-HBA的吸收相、分布相和消除相进行实验设计,正式实验采样时长为4 h,共8个采样点。结合药效学和安全性实验,最终确定p-HBA的剂量为20 mg/kg,经盐系数校正后s-HBA的剂量为20、50、100 mg/kg。在药动学研究中两种药物采用了相同剂量20 mg/kg;在组织分布研究中两种药物均选择最佳剂量,由于p-HBA的最佳剂量为20 mg/kg,s-HBA的最佳剂量为100 mg/kg,因此选择p-HBA(20 mg/kg)和相差5倍剂量的s-HBA(100 mg/kg)单次给药后研究其组织分布情况。此外,还设计了s-HBA在食蟹猴体内的药代动力学实验,经等效剂量换算后,最终确定给药剂量为4、10、20 mg/kg,采样时长为6 h,共13个时间点。
药物在体内吸收的程度直接影响药物的作用效果,消除的快慢则与其作用时间息息相关。从小鼠药代动力学实验上看,灌胃给药后,p-HBA和s-HBA均具有良好的药代动力学过程,在血浆中吸收迅速和快速消除,没有明显的体内蓄积情况。相同剂量下,s-HBA的Cmax和AUC均比p-HBA稍高,而V和Cl稍低,但差异无统计学意义。这可能是由于p-HBA的水溶性较差造成的[8],衍生为钠盐后,s-HBA的水溶性大大增加,灌胃给药后可能其在胃黏液各层分布更均匀,吸收更充分。s-HBA在食蟹猴体内也具有良好的药代动力学过程,同样被迅速吸收和快速消除;三个剂量灌胃给药下,s-HBA在小鼠和食蟹猴体内的Cmax和AUC0-t与剂量同样呈良好的线性关系。此外,s-HBA在小鼠体内的MRT0-t、V和Cl比食蟹猴稍低,相差2~3倍,差异不算太大。总体表明s-HBA在啮齿类和非啮齿类的体内过程均较稳定,无特殊吸收与消除情况。
药物进入机体后会随循环系统运送至各组织中,由于药物在生物体内分布存在差异,会影响到药物的治疗效果、蓄积、毒副反应,因此研究药物在各组织的分布情况对药物的研发和改进具有重要意义[9]。组织分布结果显示,p-HBA和s-HBA给药后,两者在组织中迅速分布和快速消除,达峰时间集中在0.03~0.17 h,并在1 h后消除大于80%。p-HBA在组织中广泛分布,肾和肝分布浓度最高,而肺、心、脾次之。这些组织均为血流量丰富并且毛细管内屏障小的组织,可能是浓度分布较高的原因之一。此外,猜测p-HBA在体内可能以肾排泄、肝代谢为主;同时可能也是药物蓄积的主要部位,这与前期研究中s-HBA最大耐受剂量下的轻微的肾、肝毒性相符。脑组织中检测到一定浓度的p-HBA,表明其可通过血脑屏障。一个比较特殊的情况是,p-HBA和s-HBA给药后,结肠中p-HBA的浓度存在较大的差异,p-HBA给药后组织分布大小为肾>肝>肺>结肠>心>脾>脑,s-HBA给药后分布为肾>肝>肺>心>脾>结肠>脑,原因尚未明确,这可能与p-HBA和s-HBA作为治疗结肠炎的潜在药物,而结肠作为结肠炎发生病变的主要器官有关,后续实验将进一步查证。
综上所述,p-HBA和s-HBA均具有良好的药代动力学过程,体内吸收和消除均较快,在组织中广泛分布,以肾和肝分布浓度最高,提示组织的靶向性,还能通过血脑屏障,这些均证明p-HBA和s-HBA具有良好的开发前景。有研究表明,病理状态下对药物的多个过程均有影响[10-12],课题组接下来将探讨p-HBA和s-HBA在病理状态下的药代动力学和组织分布是否发生变化,为后续研究提供更多的参考。
