维生素D、单核细胞/高密度脂蛋白比值与不同年龄糖尿病周围神经病变相关性研究
2022-11-26朱海伟梁琳琅
朱海伟, 梁琳琅, 于 浩, 王 宇, 林 淼
北部战区总医院 内分泌科,辽宁 沈阳 110016
糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)是糖尿病患者最常见的并发症之一,通常表现为远端、对称、感觉运动神经病变[1-3]。超过一半的糖尿病患者会出现DPN[4],而DPN是糖尿病晚期致残的主要因素,不仅会降低患者的生活质量,还会给患者的家庭和社会带来沉重的经济负担。因此,DPN的防治具有重要意义。DPN的发病机制有多种学说,其中以微循环障碍为主[5-6],各种引起神经微血管结构及功能改变的因素均可能与DPN的发生、发展有关。单核细胞/高密度脂蛋白比值(monocytes/high-density lipoprotein ratio,MHR)被假设为炎性指标与抗炎和氧化应激指标之比。随着对MHR认识的深入,其在糖尿病、冠心病等疾病中的作用也逐渐受到重视。对于MHR与2型糖尿病微血管病变之间的关系,国内外已有相关研究[7-8],但关于MHR与DPN关系的报道较少。维生素D具有促进钙和磷的吸收,以及调节骨骼和葡萄糖代谢的作用[9-11],其受体不只存在于小肠、骨骼、肾、甲状旁腺,也存在于大脑的组织和细胞中[12]。有研究表明,低水平维生素D可能增加DPN风险[12-13]。一项大规模的队列研究发现,81%的糖尿病患者有维生素D缺乏症,其与患者的周围神经病变症状(如刺痛感、麻木或手足感丧失)有关[14]。基于年龄分层来调查维生素D与DPN之间关系的研究较少见。本研究旨在探讨维生素D、MHR与不同年龄DPN的相关性。现报道如下。
1 对象与方法
1.1 研究对象 选取北部战区总医院自2019年10月至2021年10月收治的1 153例2型糖尿病患者为研究对象。纳入标准:符合2型糖尿病诊断标准[15];可配合完善相关化验及检查。排除标准:非糖尿病所致神经病变;合并严重肝肾功能或心功能不全;合并甲状旁腺疾病;合并骨质疏松;合并恶性肿瘤;应用抗癫痫药、抗精神药、糖皮质激素;近期应用钙剂及维生素D。本研究经医院伦理委员会批准。
1.2 研究方法 收集患者的临床资料,包括血液生化数据、肌电图、身高、体质量、既往史、用药情况等。根据空腹甘油三酯和空腹血糖水平,计算甘油三酯葡萄糖指数(TyG指数)。TyG指数=ln[空腹甘油三酯(mg/dl)×空腹血糖(mg/dl)]/2。通过TyG指数评估患者的胰岛素抵抗水平及心血管风险[16]。根据年龄,将患者分为青年组(24~44岁,n=281)、中年组(45~64岁,n=565)及老年组(年龄≥65岁,n=307)。根据25羟基维生素D3[25(OH)D3]表达水平,将患者分为25(OH)D3缺乏组[25(OH)D3<20 ng/ml]和非25(OH)D3缺乏组[25(OH)D3≥20 ng/ml]。根据是否存在DPN[17],将患者分为DPN组和无DPN组(NDPN组)。

2 结果
2.1 患者25(OH)D3表达水平和DPN发病情况 25(OH)D3缺乏组989例,非25(OH)D3缺乏组164例。DPN组551例,NDPN组602例。25(OH)D3缺乏组DPN患病率为50.46%(499/989),高于非25(OH)D3缺乏组的31.71%(52/164),差异有统计学意义(P<0.05)。
2.2 各组25(OH)D3表达水平比较 DPN组25(OH)D3表达水平为(13.28±4.36)ng/ml,低于NDPN组的(15.22±4.68)ng/ml,差异有统计学意义(P<0.05)。老年NDPN组25(OH)D3表达水平为(15.01±4.41)ng/ml,高于老年DPN组的(11.87±3.03)ng/ml,差异有统计学意义(P<0.05);青年DPN组和NDPN组的25(OH)D3表达水平比较,差异无统计学意义(P>0.05),中年DPN组和NDPN组的25(OH)D3表达水平比较,差异也无统计学意义(P>0.05)。
2.3 各组MHR水平比较 DPN组MHR水平为(0.41±0.14),高于NDPN组的(0.34±0.12),差异有统计学意义(P<0.05)。青年DPN组MHR水平为(0.39±0.14),中年DPN组为(0.40±0.13),老年DPN组为(0.43±0.13)。中年DPN组MHR水平高于NDPN组的(0.33±0.11),差异有统计学意义(P<0.05);老年DPN组MHR水平高于NDPN组的(0.33±0.10),差异有统计学意义(P<0.05)。
2.4 DPN相关影响因素分析及ROC曲线 (1)MHR(比值比84.642,95%可信区间24.540~291.963)、TyG指数(比值比1.285,95%可信区间1.128~1.464)是所有患者DPN的危险因素(P<0.05),25(OH)D3是保护因素(比值比0.936,95%可信区间0.911~0.963)。(2)TyG指数(比值比1.453,95%可信区间1.116~1.893)是青年组DPN的危险因素(P<0.05),25(OH)D3是保护因素(比值比0.909,95%可信区间0.860~0.962)。(3)MHR(比值比85.031,95%可信区间19.482~371.124)、TyG指数(比值比1.259,95%可信区间1.047~1.893)是中年组DPN的危险因素(P<0.05),25(OH)D3是保护因素(比值比0.962,95%可信区间0.926~0.999)。(4)MHR(比值比4 157.461,95%可信区间298.302~57 942.829)是老年组DPN的危险因素(P<0.05),25(OH)D3是保护因素(比值比0.962,95%可信区间0.926~0.999)。在青年组、中年组及老年组中,仅老年DPN组和NDPN组的25(OH)D3表达水平比较,差异有统计学意义(P<0.05)。ROC曲线进一步分析显示:25(OH)D3是老年组DPN的保护因素,切点值为14.270 nmol/L,约登指数为0.34,敏感度为84%,特异度为50%,曲线下面积为0.718(P<0.05),95%可信区间为0.661~0.775(P<0.05);MHR是老年组DPN的危险因素,切点值为0.375 nmol/L,约登指数为0.44,敏感度为73%,特异度为70%,曲线下面积为0.747(P<0.05),95%可信区间为0.692~0.802(P<0.05)。25(OH)D3+MHR的切点值为0.296 nmol/L,约登指数为0.52,敏感度为75%,特异度为77%,曲线下面积为0.817(P<0.05),95%可信区间为0.770~0.865(P<0.05)。25(OH)D3+MHR联合检测对老年2型糖尿病患者DPN发生的预测价值高于25(OH)D3、MHR单独检测(P<0.05)。见表1。
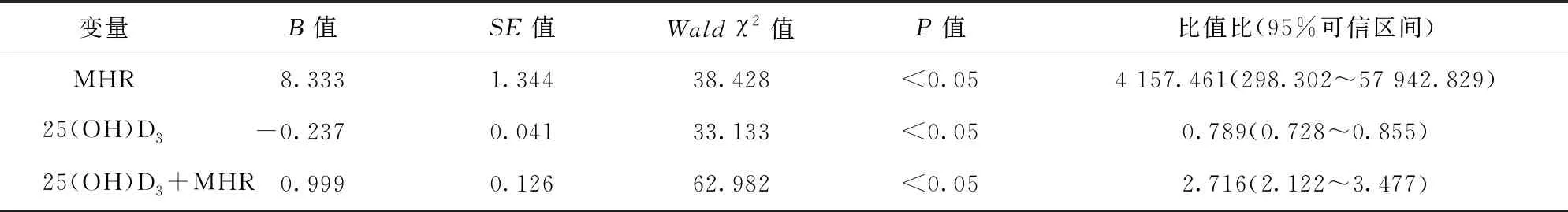
表1 老年组多因素Logistic回归分析
3 讨论
本研究中:25(OH)D3缺乏组989例(85.78%),非25(OH)D3缺乏组164例(14.22%);DPN组25(OH)D3表达水平低于NDPN组(P<0.05);老年NDPN组25(OH)D3表达水平高于老年DPN组(P<0.05)。本研究中25(OH)D3缺乏率高于国外的可能原因为[18]:我国公众对晒太阳的益处普遍缺乏认识,造成25(OH)D3的主要合成途径被抑制;我国钙剂补充意识差,钙摄入严重不足;部分地区空气污染较为严重,冬季供暖期间燃煤释放了大量粉尘颗粒,减少了日照水平,进一步加剧25(OH)D3缺乏。
有研究报道,年龄、疾病持续时间、血糖控制不良均为DPN的危险因素[12,19]。Shehab等[13]研究报道,210例2型糖尿病患者的DPN发生率为41.4%,DPN患者的25(OH)D3水平(36.90 nmol/L)低于非DPN患者(58.32 nmol/L)。本研究结果中,老年NDPN组25(OH)D3表达水平高于老年DPN组(P<0.05),25(OH)D3缺乏组DPN患病率高于非25(OH)D3缺乏组(P<0.05)。但Brewer等[20]研究报道,在557例2型糖尿病患者中,25(OH)D3缺乏与DPN无显著相关性(P>0.05)。本研究结果显示:在青年组、中年组及老年组中,仅老年DPN组和NDPN组的25(OH)D3表达水平比较,差异有统计学意义(P<0.05);25(OH)D3是老年组DPN的保护因素,切点值为14.270 nmol/L,约登指数为0.34,敏感度为84%,特异度为50%,曲线下面积为0.718(P<0.05),95%可信区间为0.661~0.775(P<0.05)。本研究的25(OH)D3切点值为14.270 nmol/L,低于Rui等[12]报道的40.020 nmol/L,可能与年龄、地域不同,以及样本大小有关。
韩啸等[21]指出,MHR与2型糖尿病患者稳态模型胰岛素抵抗指数相关,MHR越大,2型糖尿病患者胰岛素抵抗越严重。已有多项研究证实了MHR与2型糖尿病微血管病变之间具有相关性[5-6]。本研究结果显示:老年DPN组MHR水平高于NDPN组的(0.33±0.10),差异有统计学意义(P<0.05);MHR是老年组DPN的危险因素,切点值为0.375 nmol/L,约登指数为0.44,敏感度为73%,特异度为70%,曲线下面积为0.747(P<0.05),95%可信区间为0.692~0.802(P<0.05)。
维生素D水平、MHR与DPN相关的可能机制有:(1)维生素D缺乏症可通过损害胰岛细胞功能影响葡萄糖代谢,减少神经营养因子引起的神经功能障碍,减弱抗炎作用导致的血管内皮功能障碍,促进动脉粥样硬化的进展,从而促进DPN的发生和发展[22-24]。(2)1,25(OH)2D3是一种能诱导中枢和外周神经系统维生素D受体表达的神经类固醇,影响运动神经元的兴奋性传导速度,并调节神经生长因子合成[25]。维生素D缺乏会降低神经生长因子水平,使神经纤维易受到毒性因素的影响,维生素D类似物的补充可有效诱导神经生长因子表达[26-28]。有研究发现,DPN大鼠神经生长因子减少,补充神经生长因子可能预防糖尿病大鼠的病理性神经病变[29]。由于长期的高血糖刺激和生理衰老,糖尿病持续时间较长和年龄较大患者的雪旺细胞表现出分泌神经生长因子的能力降低,进一步促进DPN发展,而维生素D在神经损伤修复中作用突出[30],这可能部分解释了本研究中维生素D仅与老年患者DPN相关。(3)微血管障碍在DPN的发病机制中起着非常重要的作用[4],而MHR与2型糖尿病微血管病变之间的关系已被证实[5-6]。
综上所述,老年DPN患者存在25(OH)D3缺乏的现象较为普遍,25(OH)D3、MHR与老年糖尿病患者DPN相关,二者联合检测或可作为预测老年2型糖尿病患者DPN发生的有效生物学标志物,适当补充25(OH)D3可能改善患者自身免疫状态,起到防治DPN的积极作用。
