颈动脉支架置入术与颈动脉内膜剥脱术治疗颈动脉重度狭窄疗效及安全性分析
2022-11-26孔德福关明子周铁楠王晓刚王效增
张 磊, 孔德福, 关明子, 周铁楠, 李 巍, 王晓刚, 王效增
北部战区总医院1.心血管内科;2.神经内科;3.神经外科,辽宁 沈阳 110016
近年来,我国脑卒中发病率、致残率、病死率及复发率均居高不降[1]。颈动脉狭窄为脑卒中发病的重要因素,近三分之一的颈动脉狭窄与缺血性脑卒中密切相关[2]。颈动脉血运重建包括颈动脉支架置入术(carotid artery stenting,CAS)与颈动脉内膜剥脱术(carotid endarterectomy,CEA)。目前,CEA为治疗颈动脉狭窄的“金标准”。Brott等[3]进行的颈动脉血管再通内膜剥脱术对比支架置入试验以死亡、心肌梗死、卒中作为复合终点,研究发现CEA与CAS治疗颈动脉狭窄结果无显著差异。与CEA比较,CAS具有只需局部麻醉、创伤较小、术后易于恢复等优势。本研究旨在探讨CAS与CEA治疗颈动脉重度狭窄的临床疗效及安全性。现报道如下。
1 对象与方法
1.1 研究对象 选取北部战区总医院自2004年2月至2020年12月收治的515例行介入或外科手术治疗的颈动脉重度狭窄患者为研究对象。纳入标准:18~85岁;经数字减影血管造影(digital subtraction angiography,DSA)诊断颈动脉狭窄≥70%;接受CAS或CEA治疗。排除标准:单纯球囊扩张未置入颈动脉支架者; 1年内颅内自发出血者;3个月内进展性脑卒中者;既往脑卒中遗留肢体偏瘫者;存在对比剂过敏者;合并颅内动脉瘤或颅内段颈动脉狭窄者;合并恶性肿瘤者。根据不同的治疗方法将患者分为CAS组(n=245)与CEA组(n=270)。本研究经医院伦理委员会批准。所有患者均签署知情同意书。
1.2 治疗方法 CAS组患者术前1 d给予负荷剂量氯吡格雷300 mg、阿司匹林300 mg。术后给予氯吡格雷75 mg/d,共6个月;阿司匹林100 mg/d,终生。CEA组患者术前给予阿司匹林100 mg/d或氯吡格雷75 mg/d。术后至少单一抗血小板治疗28 d。所有患者术后均监护48 h,观察症状及体征,根据血压水平给予补液及应用升压药,血压稳定后调整降压药物种类。两组患者均长期服用他汀类药物调整血脂、稳定斑块。CAS组患者取平卧位,双侧股动脉术区常规消毒,铺无菌单,局部麻醉下,按标准方法行颈动脉DSA及CAS[4]。患者均应用远端保护装置。术中依据血压及心律变化情况静脉应用间羟胺和(或)阿托品。CEA组患者全身麻醉后,取仰卧位,常规消毒术区,铺无菌单,按照标准方法行纵切式内膜切除术[5]。术后1~2 d拔除引流管。手术成功标准:术终残余狭窄≤20%,围术期无严重并发症,如死亡、脑梗死、支架内血栓形成、肢体缺血等。
1.3 研究终点及随访 临床症状(头晕、头痛、黑朦、肢体活动障碍)和主要不良心脑血管事件(main adverse cardiovascular and cerebrovascular events,MACCE),包括非致死性心肌梗死、新发脑卒中、靶血管再次重建及全因死亡。通过门诊、电话等方法进行出院患者随访。分别于患者出院后1、6、12个月及每隔1年进行复查,记录随访期间患者症状、用药情况、实验室化验结果、颈动脉彩色多普勒超声结果及研究终点发生情况。
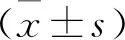
2 结果
2.1 两组患者临床资料比较 CAS组患者年龄、血红蛋白、胆固醇、甘油三酯、低密度脂蛋白胆固醇均高于CEA组,差异均有统计学意义(P<0.05)。两组患者男性比例、症状性颈动脉狭窄、吸烟史、饮酒史、合并症、入院血压及心率、住院用药情况、白细胞、血清肌酐、高密度脂蛋白胆固醇比较,差异均无统计学意义(P>0.05)。见表1。
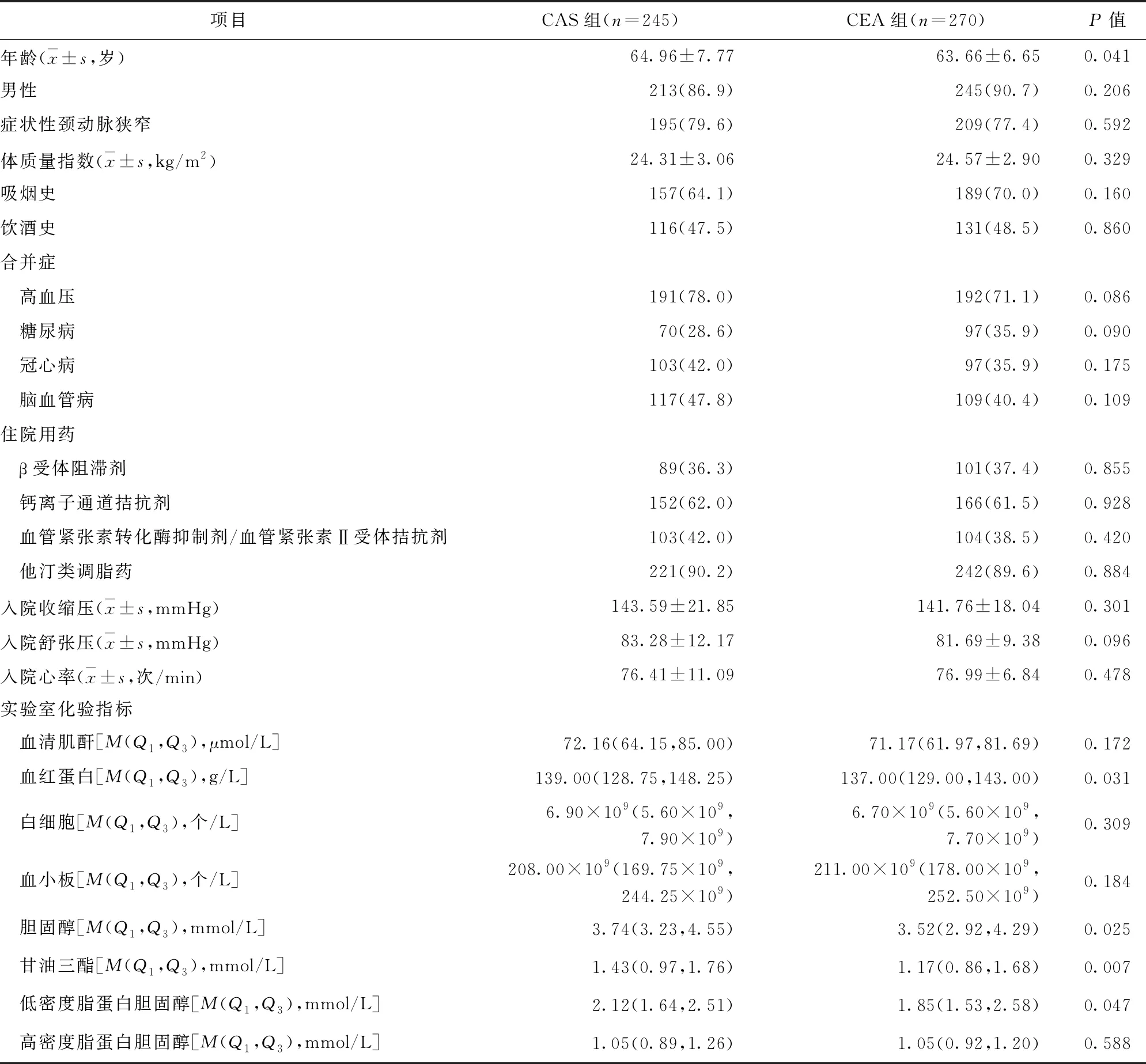
表1 两组患者临床资料比较/例(百分率/%)
2.2 两组患者造影及手术结果比较 CAS组患者颈动脉平均狭窄程度、外周血管疾病比例均高于CEA组,差异均有统计学意义(P<0.05)。两组患者单侧颈动脉狭窄、手术成功率比较,差异均无统计学意义(P>0.05)。见表2。CAS组患者中,46例发生颈动脉次全闭塞及完全闭塞,其中21例应用小球囊低压力预扩后置入远端脑保护装置,术中均未发生卒中,手术均取得成功。CEA组患者中,1例于术后第2天发生心力衰竭,围术期未发生脑梗死、支架内血栓形成、肢体缺血等不良事件。

表2 两组患者造影及手术结果比较/例(百分率/%)
2.3 两组患者术后30 d随访结果比较 术后30 d,两组患者随访率均为100%。两组患者头晕、MACCE、新发脑卒中、全因死亡等发生率比较,差异均无统计学意义(P>0.05)。见表3。
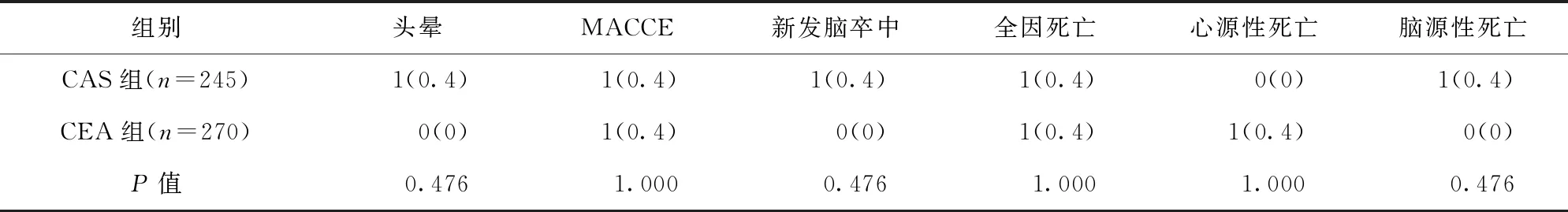
表3 两组患者术后30 d随访结果比较/例(百分率/%)
2.4 两组患者术后1年随访结果比较 术后1年,CAS组、CEA组患者随访率分别为94.3%(231/245)、93.0%(251/270),差异无统计学意义(P>0.05)。两组患者头晕、MACCE、全因死亡等发生率比较,差异均无统计学意义(P>0.05)。见表4。
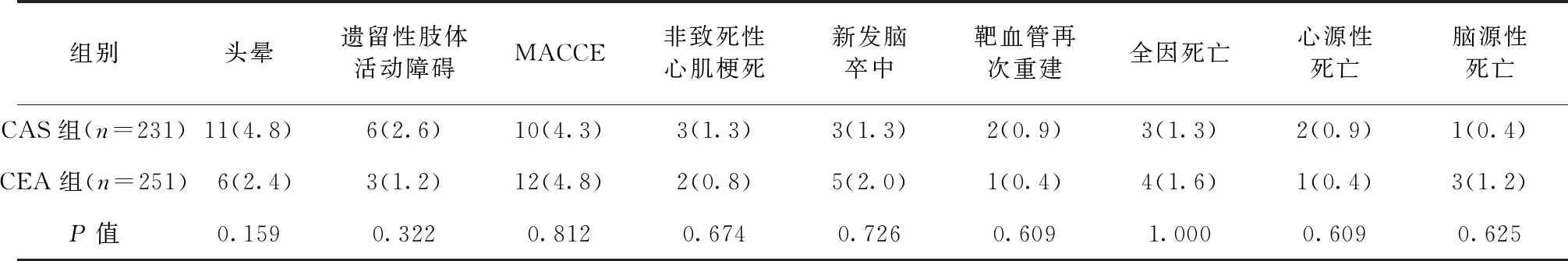
表4 两组患者术后1年随访结果比较/例(百分率/%)
2.5 两组患者术后3年随访结果比较 CAS组、CEA组3年到窗随访例数分别为176例、164例。术后3年,CAS组、CEA组患者随访率分别为93.2%(164/176)、96.3%(158/164),差异无统计学意义(P>0.05)。两组患者头晕、MACCE、全因死亡等发生率比较,差异均无统计学意义(P>0.05)。见表5。

表5 两组患者术后3年随访结果比较/例(百分率/%)
2.6 Kaplan-Meier生存曲线 两组患者累积总生存率、未发生脑卒中率、未发生MACCE率比较,差异均无统计学意义(P>0.05)。见图1~3。
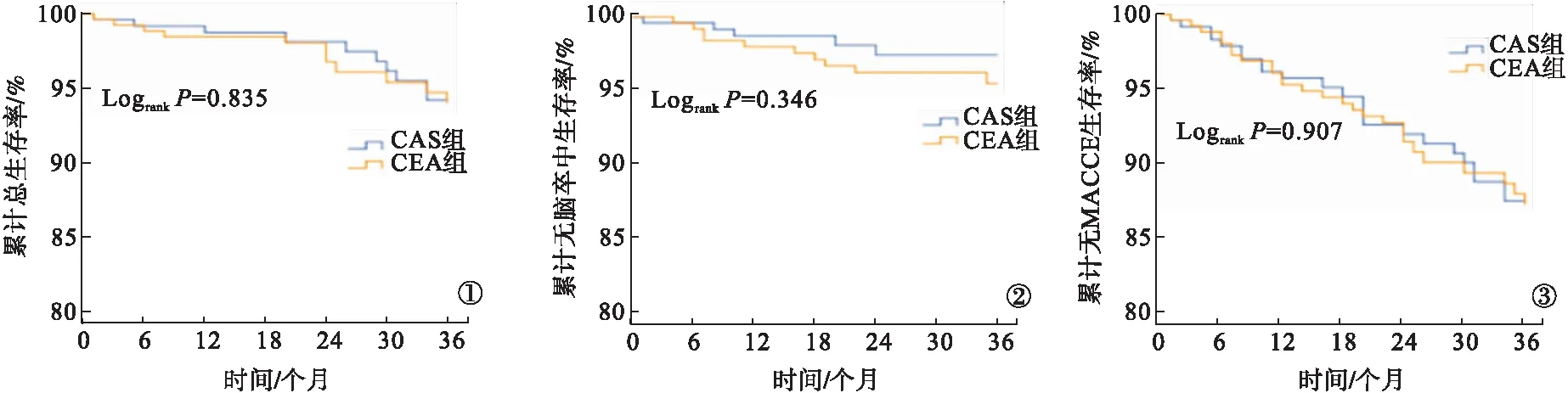
图1 两组患者生存情况Kaplan-Meier生存曲线 图2 两组患者未发生脑卒中Kaplan-Meier生存曲线 图3 两组患者未发生MACCE事件Kaplan-Meier生存曲线
3 讨论
颈动脉狭窄为卒中发作的重要病因[6]。既往研究表明,无论有无脑缺血症状的颈动脉中重度狭窄患者行血运重建术均可获益[7]。有研究提示,CEA具有更好的安全性,但此研究没有把心肌梗死纳入研究终点,且多数CAS患者未应用远端脑保护装置,可能使结果产生偏移[8]。另有研究显示,CAS与CEA在卒中、非手术相关卒中及生存率方面均无显著差异[9]。动脉粥样硬化为我国常见的慢性全身性血管疾病,可涉及全身的大小动脉,尤其是冠状动脉、颈动脉等,所以颈动脉狭窄与冠状动脉狭窄常同时发生[10]。有研究表明,当颈动脉狭窄伴有严重的冠状动脉病变时,行CAS或CEA均会使围术期病死率有所增长[11]。因此,术前冠状动脉检查至关重要。本研究中,CEA组1例患者围术期死于心力衰竭,该患者合并冠心病,考虑CEA术后颈动脉窦受损,导致植物神经功能紊乱。这提示,颈动脉狭窄患者需注重冠状动脉及外周血管的检查,更加全面了解患者的身体状况,降低围术期病死率,给予患者更全面的治疗。
颈动脉血运重建术常见并发症为缺血性脑卒中。国内外指南均建议,颈动脉血管严重钙化,迂曲病变应选择CEA[2,12]。CEA术后发生脑卒中的原因:一是分离颈动脉时斑块脱落致使脑血管堵塞[13];二是血管阻断时间过长,术中低血压等导致脑组织长期血流不足[14]。术者操作要轻柔,阻断血管前适当应用升压药物,阻断时间不宜过长,避免长期脑灌注不足,剥离残存内膜要彻底,以减少术后脑卒中的可能[15-18]。本研究结果显示,CAS组患者颈动脉平均狭窄程度、外周血管疾病比例均高于CEA组,差异均有统计学意义(P<0.05)。这说明,CAS也是颈动脉血运重建的有效方法。本研究结果显示:两组患者术后30 d、术后1年新发脑卒中发生率比较,差异均无统计学意义(P>0.05);CAS组患者术后3年脑卒中发生率低于CEA组(3.0%比6.3%),但差异无统计学意义(P>0.05)。可能原因为CEA组患者术后动脉粥样硬化二级预防用药依从性差,术后需要加强患者用药管理。颈动脉血运重建术最严重的并发症为死亡。有研究显示,CEA术后患者病死率约为1%[2,19-20]。本研究结果显示,两组患者累积总生存率、未发生脑卒中率、未发生MACCE率比较,差异均无统计学意义(P>0.05)。这表明,CAS与CEA治疗颈动脉重度狭窄患者安全性相当,疗效满意。
综上所述,在全面的术前评估、严谨的手术操作及术后管理的前提下,CAS与CEA治疗颈动脉重度狭窄患者可获得同样的手术成功率及临床疗效,两种颈动脉血运重建策略均安全可行。本研究结论尚需要更大规模的临床研究,特别是多中心、随机对照试验、前瞻性队列研究等进一步证实。
