lncRNA-UCA1靶向miR-204调控PI3K/Akt信号通路抑制癫痫模型海马神经元凋亡的作用机制
2022-11-25吕关健潘俊超崔灵运代英杰
吕关健 潘俊超 崔灵运 代英杰
癫痫病是一种因突发性大脑功能异常导致的神经内科疾病,俗称“羊癫风”、“羊角风”,该病发病率较高,频繁发作会导致脑损伤甚至神经精神障碍[1,2]。目前临床上多采用药物治疗控制癫痫病的发作,但对于癫痫持续状态所致的海马神经元凋亡尚无有效治疗方法。有研究表明,长链非编码RNA(lncRNA)-尿路上皮癌胚抗原1(UCA1)调控多种疾病的发生和发展,微小核糖核酸-204(miR-204)参与了疾病的发展进程。沉默lncRNA UCA1调控胶质瘤细胞放射敏感性[3]。lncRNA-UCA1在慢性乙型病毒性肝炎患者、肺癌患者血清中表达量与疾病状态关系密切[4]。miR-204影响癫痫神经元中脑源性神经营养因子(BDNF)/活酪氨酸激酶受体B(TrkB)信号通路[5]。miR-204-5p通过靶基因小窝蛋白1(Cav-1)调节大鼠血管平滑肌细胞增殖[6]。但lncRNA UCA1在癫痫病海马神经元凋亡中的作用,以及lncRNA UCA1对miR-204-5p的表达是否有影响尚不清楚。本实验主要研究lncRNA-UCA1通过靶向miR-204调控PI3K/Akt信号通路抑制癫痫模型海马神经元凋亡的作用机制。
1 材料与方法
1.1 细胞、试剂和仪器
小鼠正常海马神经元细胞和小鼠癫痫模型海马神经元细胞均购自中科院上海细胞库(编号CBP90867、CPB60992);Dulbecco改良Eagle培养基(DMEM)购自美国Hyclone公司(10-014-CV);胎牛血清购自美国Invitrogen公司(A15-101);qRT-PCR试剂盒购自大连宝生物科技有限公司(E0107S);Annexin V-异硫氰酸荧光素(FITC)/碘化丙啶(PI)试剂盒购自上海煊翎生物科技有限公司(CA1020);二辛可宁酸(BCA)试剂购自中国碧云天生物技术研究所(PD-BCA-500);兔抗鼠B淋巴细胞瘤-2(Bcl-2)、Bcl-2相关X(Bax)、磷酸化磷脂酰肌醇3-激酶(p-PI3K)、磷酸化蛋白激酶(p-Akt)一抗、山羊抗兔Bcl-2、Bax、p-PI3K、p-Akt二抗均购自美国BD公司(191001、191214、190507、200322、200217、191104、200603、201102)。5031型酶标仪购自南京华东有限公司,FACSAria Ⅱ型流式细胞仪购自美国BD公司,7300型PCR仪购自美国ABI公司。
1.2 方法
1.2.1 细胞培养和分组: 将癫痫模型海马神经元细胞用含有10%胎牛血清的DMEM培养基于37℃、含5% CO2培养箱内培养,待细胞生长至80%-90%融合度时,用胰蛋白酶消化进行传代。待细胞生长至对数生长期后,更换为不含胎牛血清的DMEM培养基,将细胞分为si-NC组(转染si-NC)、si-UCA1组(转染si-UCA1)、miR-NC组(转染miR-NC)、miR-204组(转染miR-204 mimics)、si-UCA1+anti-miR-NC组(si-UCA1和anti-miR-NC共转染)、si-UCA1+anti-miR-204组(si-UCA1和anti-miR-204共转染),转染过程按照Lipofectamine 2000说明书进行操作。另取未转染小鼠癫痫模型海马神经元细胞、小鼠正常海马神经元细胞分别记为癫痫模型组和正常对照组。将上述细胞在37℃、含5% CO2培养箱内培养48 h后进行后续实验。
1.2.2 qRT-PCR 检测细胞中UCA1和miR-204表达:分别取各组海马神经元细胞,通过TRIzol法提取细胞总RNA,利用逆转率试剂盒将RNA逆转录合成cDNA。严格按照RT-qPCR试剂盒说明书的操作步骤进行扩增。以β-actin为内参基因,按照2-ΔΔCt法计算目标基因相对表达量。
1.2.3 流式细胞术检测细胞凋亡情况: 取1×106个细胞/孔接种到96孔板内,培养48h。加入1ml结合缓冲液于流式管内重悬细胞,分别加入5μl的Annexin V-FITC溶液和PI溶液,避光条件下孵育15min后,采用流式细胞仪检测细胞凋亡情况。
1.2.4 双荧光素酶报告实验验证UCA1和miR-204的靶向关系: 通过LncBase Predicted v.2数据库预测UCA1和miR-204的靶向关系。将双荧光素酶报告载体WT-UCA1、MUT-UCA1分别与miR-NC、miR-204共转染至癫痫模型海马神经元细胞,常规培养48h后,检测细胞的荧光素酶活性。
1.2.5 Western Blotting检测细胞相关蛋白表达:分别取各组海马神经元细胞,提取细胞总蛋白,BCA法检测蛋白浓度。将蛋白样液以20μg/孔上样于凝胶中进行电泳分离,转移到聚偏二氟乙烯(PVDF)膜后,室温封闭1h,加入一抗(稀释比1∶1 000)4℃孵育过夜,加入二抗(稀释比1∶2 000)室温孵育2h,以β-actin为内参蛋白,以目标蛋白与内参蛋白条带灰度值的比值作为目标蛋白的相对表达量。
1.2.6 酶标仪法检测Caspase3活性: 收集各组海马神经元细胞后用0.25%胰蛋白酶消化,4℃条件下3 000r/min转速离心5min,预冷PBS洗涤后加入含蛋白酶抑制的放射免疫沉淀法(RIPA)裂解缓冲液,于冰上裂解30min,BCA法进行蛋白定量,取200μg蛋白加入反应缓冲液与底物混匀后室温避光孵育1h,于405nm波长处检测吸光度值。
1.3 统计学处理
2 结 果
2.1 UCA1和miR-204在癫痫模型海马神经元细胞中的表达
与正常对照组比较,癫痫模型组重海马神经元细胞UCA1表达量显著升高,miR-204表达量显著降低(P<0.01)。见表1。
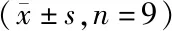
表1 UCA1和miR-204在癫痫模型海马神经元细胞中的表达
2.2 抑制UCA1表达对癫痫模型海马神经元细胞凋亡的影响
各组海马神经元细胞凋亡率及凋亡相关蛋白表达差异均有统计学意义(P<0.01)。与正常对照组比较,si-NC组海马神经元细胞凋亡率和Bax蛋白、Caspase3活性升高,Bcl-2蛋白表达降低;与si-NC组比较,si-UCA1组海马神经元细胞凋亡率和Bax蛋白、Caspase3活性显著升高,Bcl-2蛋白表达显著降低(P<0.01)。见图1、图2和表2。
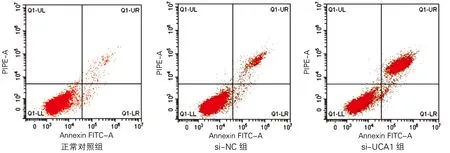
图1 各组海马神经元细胞凋亡(流式细胞术)
2.3 UCA1和miR-204的靶向关系验证
LncBase Predicted v.2数据库预测显示,UCA1与miR-204存在结合位点,见图3。实验结果显示,在转染WT-UCA1细胞中,miR-204组细胞荧光素酶活性显著低于miR-NC组细胞(P<0.01),在转染MUT-UCA1细胞中,miR-204组和miR-NC组荧光素酶活性无显著变化(P>0.05)。见表3。
表2 抑制UCA1表达对癫痫模型海马神经元细胞凋亡的影响
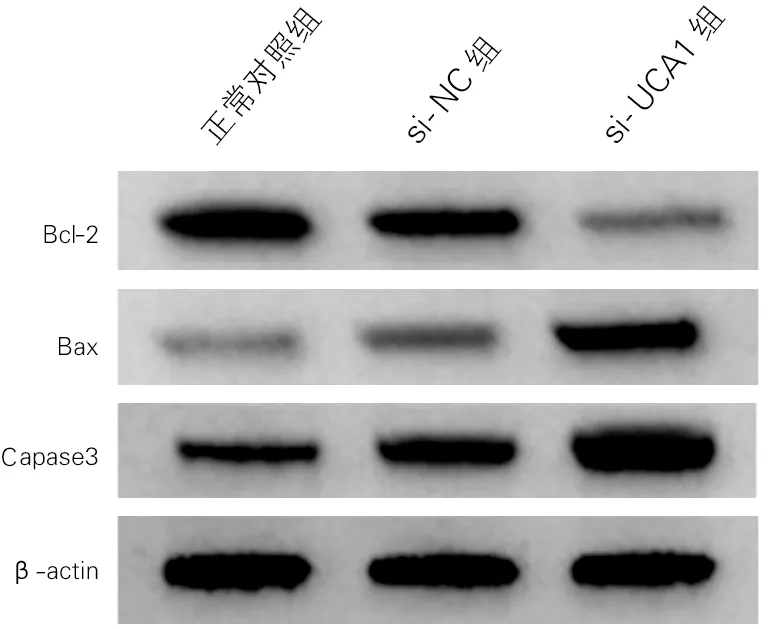
图2 各组海马神经元细胞凋亡相关蛋白表达(Western Blotting)
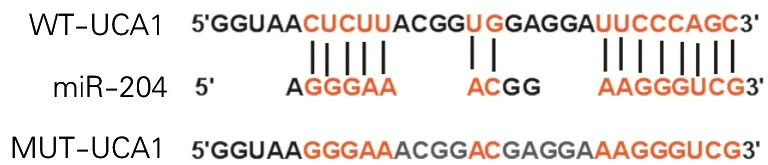
图3 UCA1和miR-204的靶向结合关系
表3 双荧光素酶实验
2.4 干扰miR-204可逆转抑制UCA1对癫痫模型海马神经元细胞凋亡的影响
各组细胞凋亡率及凋亡相关蛋白表达水平差异均有统计学意义(P<0.01)。与正常对照组比较,si-UCA1+anti-miR-NC组细胞凋亡率及Bax蛋白、Caspase3活性均升高,Bcl-2蛋白表达降低;与si-UCA1+anti-miR-NC组比较,si-UCA1+anti-miR-204组细胞凋亡率及Bax蛋白、Caspase3活性显著降低,Bcl-2蛋白表达显著升高,差异均有统计学意义(P<0.01)。见图4、图5和表4。

图4 各组海马神经元细胞凋亡 (流式细胞术)
表4 干扰miR-204可逆转抑制UCA1对癫痫模型海马神经元细胞凋亡的影响
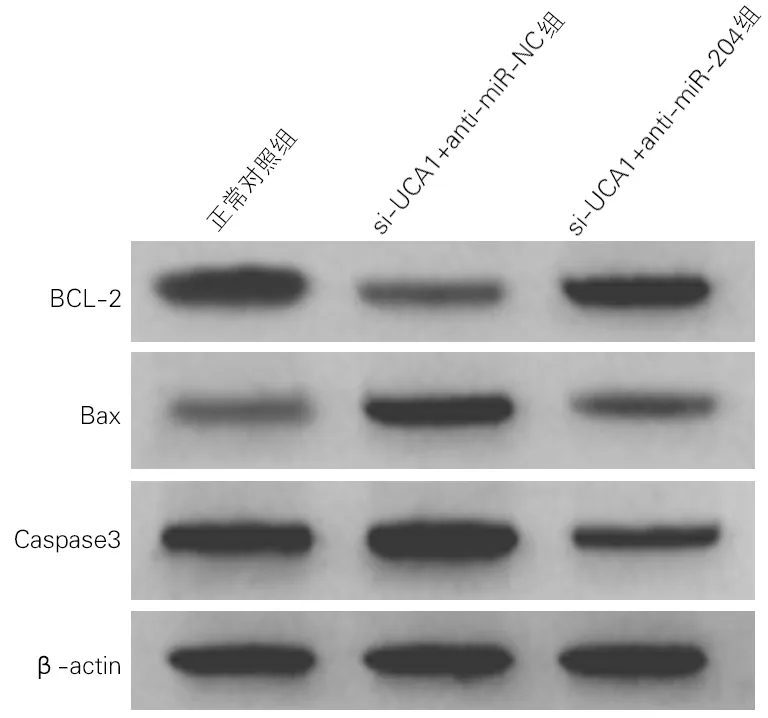
图5 各组海马神经元细胞凋亡相关蛋白表达(Western Blotting)
2.5 信号通路相关蛋白表达
各组p-PI3K蛋白、p-Akt蛋白表达水平差异均有统计学意义(P<0.01)。与si-NC组比较,si-UCA1组细胞p-PI3K、p-Akt蛋白表达显著降低(t=20.871、20.871,P<0.01)。与si-UCA1+anti-miR-NC组比较,si-UCA1+anti-miR-204组细胞p-PI3K、p-Akt蛋白表达显著升高(t=18.341、18.276,P<0.01)。见图6、表5。
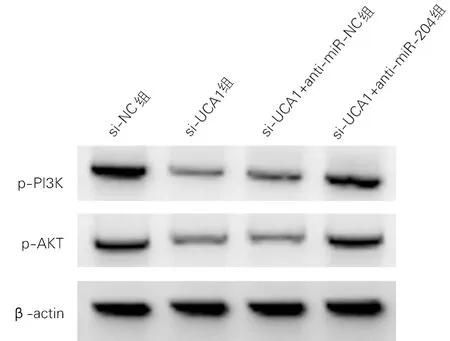
图6 PI3K/Akt信号通路相关蛋白表达(Western Blotting)
表5 PI3K/Akt信号通路相关蛋白表达
3 讨 论
癫痫临床表现为全身强直-阵挛发作,如四肢抽搐,口吐涎沫,意识丧失,大小便失禁等,部分患者出现突然的、短暂的意识障碍,称小发作[7,8]。目前关于癫痫发病机制尚不清楚,寻找其发生机制是当前医学界研究的热点。
lncRNA是长链非编码RNA,与中枢神经系统疾病密切相关,包括癫痫[9]。有研究显示,在小儿癫痫患者中有大量lncRNA被相继报道,如lncRNA H19、lncRNA Peg13等[10]。lncRNA TUG1在小儿癫痫患者血清中高表达,可通过调控miR-199a-3p增强癫痫发作[11]。小儿癫痫患者血清中lncRNA ZFAS1表达水平增加,沉默lncRNA ZFAS1可抑制脂多糖诱导的神经元细胞凋亡和炎症反应[12]。lncRNA-UCA1是应用较为广泛的一种lncRNA,可在胚胎发育早期表达,有研究发现,lncRNA-UCA1在癫痫患儿血清中水平高于正常对照者[13],lncRNA-UCA1通过调节转化生长因子-β1(TGF-β1)保护对海人酸诱导小鼠癫痫[14]。本实验发现,在小鼠癫痫模型海马神经元细胞组中UCA1表达量显著升高,抑制UCA1表达可增高细胞凋亡率、Bax蛋白表达,降低Bcl-2蛋白水平,这与相关研究结果[14]相似,表明lncRNA-UCA1有望成小儿癫痫的标记物。
通过LncBase Predicted v.2预测发现,UCA1与miR-204相互结合,双荧光素酶报告实验显示,过表达miR-204可降低WT-UCA1荧光素酶活性,对MUT-UCA1荧光素酶活性无影响,表明UCA1可靶向调控miR-204。miR-204在癌症、疾病中差异表达[15,16],有研究显示miR-204可通过调控尼克酰胺腺嘌呤二核苷酸磷酸氧化酶4(Nox4)参与阿尔茨海默病小鼠模型的发现和发展[17]。还有研究结果显示,加味柴胡疏肝汤可通过调控miR-204/AKT/雷帕霉素靶蛋白(mTOR)/70 kDa核糖体蛋白S6激酶(P70S6K)通路发挥保护癫痫小鼠海马神经元的作用[18]。本实验研究表明,在癫痫模型海马神经元细胞组中miR-204表达量降低,干扰miR-204表达可减弱UCA1表达对癫痫模型海马神经元细胞凋亡的作用。PI3K/Akt信号通路是细胞内重要信号转导通路,PI3K/Akt通路被激活后可介导调控癫痫发展[19]。本实验研究显示,抑制UCA1表达可降低p-PI3K、p-Akt蛋白表达,干扰miR-204表达可减弱UCA1表达对p-PI3K、p-Akt蛋白表达的抑制作用,表明lncRNA-UCA1可通过调控miR-204/PI3K/Akt信号通路影响癫痫发展。
综上所述,UCA1通过靶向上调miR-204,并抑制PI3K/Akt信号通路降低癫痫模型海马神经元凋亡。关于PI3K/Akt信号通路对癫痫模型海马神经元影响的具体作用机制,仍需后续进行进一步的探究。
◀
本文第一作者简介:
吕关健(1983-),男,汉族,主治医师,研究方向:脑血管病、癫痫、认知功能障碍、帕金森病及睡眠障碍等
