子宫内膜异位症患者腹腔Th17细胞和Th17.1细胞检测及致炎活性分析
2022-11-25蒋艳萍彭亚琴谭爱丽王淑君
汪 璐 蒋艳萍 彭亚琴 秦 健 谭爱丽 王淑君
固有免疫细胞和适应性免疫细胞共同参与子宫内膜异位症的炎症反应,其中中性粒细胞、巨噬细胞、自然杀伤细胞、树突状细胞和T细胞通过分泌一系列生物活性介质促进子宫内膜异位细胞的增殖、侵袭以及病变组织的血管生成等[1, 2]。研究表明辅助性T细胞17(Th17)在子宫内膜异位症的进展中可能发挥重要作用,其分泌的促炎性细胞因子白细胞介素-17A(IL-17A)是引起多种炎症性疾病和自身免疫性疾病的关键因子。Th17细胞具有异质性,能在不同条件下被诱导分化为表达干扰素-γ(IFN-γ)的辅助性T细胞17.1(Th17.1)或表达白介素-10(IL-10)的一类适应性调节T细胞亚群(Tr1),参与不同的病理生理进程[3]。子宫内膜异位症患者血清中Th17细胞的比例增加,其水平与子宫内膜异位症的严重程度有关[4,5]。然而子宫内膜异位症患者腹腔Th17细胞的组成和功能特性尚未明确,是否存在Th17.1细胞和Tr1细胞仍待研究。本文全面分析子宫内膜异位症患者腹腔冲洗液中Th17细胞及其相关亚群的活性和分子特征,并探讨其在腹腔炎症反应中的作用。
本研究根据CD4+T细胞表面趋化因子受体的差异性表达,识别具有Th17和Th17.1功能的细胞,成功从患者腹腔冲洗液中分选出Th17细胞和Th17.1细胞,并探讨这两种细胞对子宫内膜异位症炎症反应的影响。
1 材料与方法
1.1 患者
2018-06-2020-10在武汉大学人民医院行手术治疗的中重型子宫内膜异位症患者(病例纳入标准:符合1985年美国生育协会修订的腹腔镜诊断内异症的评分系统,r-AFS 评分为Ⅲ-Ⅳ期)20例,收集术中腹腔冲洗液,患者资料见表1。病例纳入标准:本研究纳入的患者手术前无自身免疫性疾病,短期内无炎症性疾病或生殖道感染病史,在手术前三个月内未使用任何抗炎药物,术后组织病理学诊断均为子宫内膜异位症。
1.2 试剂和仪器
人外周血淋巴细胞分离液购自北京索莱宝科技有限公司(P8610-200ml)。红细胞裂解缓冲液、乙二胺四乙酸二钠(EDTA,ST1303-50g)、牛血清白蛋白(ST025-20g)、SYBR Green Quantitative RT-PCR试剂盒(D7190S)、佛波酯(PMA,S1819-1mg)、Ionomycin(S1672-250nmol)、Brefeldin A(S1536-5mg)、多聚甲醛(P0099-500ml)购自碧云天。Arcturus PicoPure RNA试剂盒(KIT0204)、胎牛血清(10100147)、RPMI1640培养基(11879020)购自ThermoFisher。Axcel RNA QC Kit v2.0(929104)购自Qiagen。PrimeScript 1st strand cDNA Synthesis 试剂盒(6110A)购自Takara Bio。流式抗体购自BioLegend:APC/Cy7标记的CD3抗体(HIT3a)、FITC标记的CD4抗体(A161A1)、PE标记的CCR4抗体(L291H4)、PE/Cy7标记的CXCR3抗体(G025H7)、PerCP/Cy5.5标记的CCR6抗体(29-2L17)、APC标记的CCR10抗体(6588-5)、Pacific blue标记的IL-17A抗体(BL168)、Pacific blue标记的IFN-γ抗体(4S.B3)、APC标记的T-bet抗体(4B10)、Pacific blue标记的Ki67抗体(Ki-67)均购自BioLegend。FACSCelesta流式细胞仪和FACSAria III流式细胞仪购自BD Biosciences。CFX384 RT-PCR仪购自Bio-Rad。

表1 20例患者一般资料
1.3 腹腔冲洗液细胞的收集
患者在全麻状态下进行腹腔镜检查,从Douglas腔收集不含血液的腹腔冲洗液。将腹腔冲洗液3.0 ml缓慢加入3.0ml人外周血淋巴细胞分离液中,室温400g离心20min,收集腹腔冲洗液-淋巴细胞分离液分界面处的细胞,磷酸盐缓冲液(PBS)离心洗涤一次。将细胞重悬于红细胞裂解缓冲液200μl,室温孵育15min裂解残留的红细胞。PBS缓冲液离心洗涤细胞一次,用含有2.0mM EDTA和0.5%牛血清白蛋白的PBS缓冲液重悬细胞以备流式细胞术检测。
1.4 流式细胞术检测细胞表面抗原和细胞因子
1.4.1 细胞表面抗原检测:将1.3中分离所得的细胞用含有CD3抗体、CD4抗体、CCR6抗体、CCR10抗体、CCR4抗体、CXCR3抗体的溶液(每种抗体浓度为2μg/ml)于冰上孵育30min,1.0ml PBS缓冲液洗涤一次,重悬细胞于0.5ml PBS缓冲液中。使用FACSAria III流式细胞仪检测细胞表面抗原如CD3、CCR6、CXCR3、CCR10和CCR4的表达,依据细胞表面抗原分选腹腔T细胞的不同亚群。
1.4.2 胞内抗原检测(细胞因子或细胞核内蛋白):经表面抗原染色后或分选培养后的细胞用200μl 2%多聚甲醛室温固定20min;90%甲醇-PBS 1ml重悬细胞,冰上孵育30min;PBS缓冲液离心洗涤细胞一次;用含有IL-17A抗体、IFN-γ抗体、T-bet抗体和(或)Ki67抗体的溶液(每种抗体5μg/ml)室温孵育细胞1h;PBS缓冲液离心洗涤一次,将细胞重悬于PBS缓冲液中,FACSCelesta流式细胞仪检测。
1.4.3 RNA提取、cDNA合成和实时定量逆转录聚合酶链反应(qRT-PCR):使用Arcturus PicoPure RNA试剂盒按说明书提取细胞RNA,QIAxcel RNA QC Kit v2.0测量RNA质量和浓度,PrimeScript 1st strand cDNA Synthesis 试剂盒合成cDNA第一链。将RNA样品与SYBR Green Quantitative RT-PCR试剂盒中的试剂按说明书混合,使用CFX384 RT-PCR仪进行PCR反应。PCR反应条件为50℃预热2min、95℃预变性10min、95℃变性15s和60℃退火延伸30s,共40个循环,然后72℃反应10min。以β-肌动蛋白(β-actin)为参考基因,将靶基因的mRNA水平进行标准化,采用2-ΔΔCt法计算RORC、TNF、CSF2、IL1R1基因的相对表达量。PCR引物序列见表2。

表2 引物序列
1.5 体外细胞培养和活化
采用含10%胎牛血清的RPMI 1640培养基将1.4中分选的T细胞调节浓度至1×105/ml,加入 20ng/ml佛波酯、1μg/ml Ionomycin和10μg/ml Brefeldin A刺激IL-17A的表达,37℃培养4h, 然后按1.4中的方法进行细胞因子染色和流式细胞术检测。
1.6 统计学处理

2 结 果
2.1 子宫内膜异位症患者腹腔IL-17A+ T细胞的异质性
IL-17A+T细胞占总腹腔细胞的比例约为3.77%。IL-17A+T细胞可被分为两个亚群:CCR6+CXCR3-细胞和CCR6+CXCR3+细胞。前者在IL-17A+T细胞所占比例显著高于后者[(76.37±6.28)% vs(19.78±6.40)%,t=15.450,P<0.01]。这两个亚群细胞表面均不表达水平CCR10,且CCR6+CXCR3-细胞CCR4表达水平高于CCR6+CXCR3+细胞[(20.22±2.73)% vs(14.12±1.32)%,t=4.924,P<0.01]。
2.2 CCR6和CCR10的表达识别活的IL-17A+ T细胞
上述结果提示趋化因子受体可能是腹腔IL-17A+T细胞及其亚群的表面标志,故可根据不同趋化因子受体的表达水平识别活的腹腔IL-17A+T细胞。结果显示CD3+CD4+T细胞分为a亚群(CCR6+CCR10-)、b亚群(CCR6+CCR10+)、c亚群(CCR6-CCR10+)、d亚群(CCR6-CCR10-)四个亚群。各个亚群RORC mRNA 表达水平及IL-17A+细胞比例见表3。与其它亚群相比,a亚群RORC mRNA表达水平及IL-17A+细胞比例明显升高(t均>3.540,P<0.05或P<0.01),其余3个亚群RORC mRNA表达水平以及IL-17A+细胞比例差异无统计学意义(t均<1.880,P>0.05)。
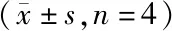
表3 CD3+、CD4+ T细胞各亚群RORC mRNA及IL-17A+细胞水平
2.3 CCR4和CXCR3在IL-17A+ T细胞表面的差异性表达
上述的a亚群根据CCR4和CXCR3的表达进一步区分为两个亚群:CCR4+CXCR3-/lo细胞和CCR4-CXCR3+细胞。前者有(81.53±4.50)%的细胞表达IL-17A,后者仅有(43.83±4.03)% 的细胞表达IL-17A,两者表达差异有统计学意义(t=10.812,P<0.05)。
2.4 依据CCR4和CXCR3的表达差异区分Th17细胞和Th17.1细胞
CCR4+CXCR3-/loT细胞亚群较CCR4-CXCR3+T细胞亚群IFN-γ和T-bet表达明显减少(P<0.01),见表4。因此,可依据CCR4和CXCR3表达的差异区分Th17细胞和Th17.1细胞,子宫内膜异位症患者腹腔冲洗液中Th17细胞和Th17.1细胞在CD4+T细胞中所占比例分别为(18.27±4.93)%和(5.99±2.29)%。

表4 CCR4+CXCR3-/lo细胞和CCR4-CXCR3+细胞亚群 IFN-γ和T-bet比较
2.5 腹腔Th17.1细胞具有更强的促炎活性
与CCR6+CCR10-CCR4+CXCR3-/loT细胞(Th17)相比,CCR6+CCR10-CCR4-CXCR3+T细胞(Th17.1)中TNF-α(基因名TNF)、GM-CSF(基因名CSF2)和IL-1R1(基因名IL1R1)表达水平更高(P<0.05或P<0.01)。Th17细胞和Th17.1细胞的Ki67染色结果无明显差异(P>0.05),见表5。

表5 Th17.1细胞炎症相关基因和Ki67的表达
3 讨 论
既往研究证明,在肿瘤、消化道感染、自身免疫性疾病和艾滋病中,T细胞可根据CXCR3、CCR4、CCR10和CCR6的差异性表达区分Th1、Th2、Th9和Th17细胞[6-9],在多种疾病或病理模型中亦有Th17.1细胞的存在。Th17细胞与Th17.1细胞在表型和功能上存在一系列差异,最显著的差异是Th17细胞表达RORγt但不表达T-bet和IFN-γ,表达CCR4但不表达CXCR3;而Th17.1细胞同时表达RORγt、T-bet和IFN-γ,表达CXCR3但不表达CCR4[3, 10]。相对于Th17细胞,Th17.1细胞可能具有更强烈的致病作用,原因在于Th17.1细胞不仅表达IFN-γ,也产生促炎细胞因子如TNF-α和GM-CSF[11]等。
基于趋化因子受体差异性表达来区分子宫内膜异位症患者腹腔内Th17细胞和Th17.1细胞,目前尚未报道。本研究结果显示,在患者腹腔冲洗液中,根据趋化因子受体的差异性表达来辨别Th17细胞和Th17.1细胞,Th17细胞的表型为CD3+CD4+CCR6+CCR10-CCR4+CXCR3-/lo, Th17.1细胞的表型为CD3+CD4+CCR6+CCR10-CCR4-CXCR3+,并且可以从活化的细胞中分选出Th17细胞和Th17.1细胞。目前对Th17细胞的检测主要依靠流式细胞术分析T细胞内IL-17A的特异性染色,需要对T细胞进行固定和破膜,无法获得存活的Th17细胞。本文研究结果有利于更深入探索Th17细胞和Th17.1细胞的功能特点、分子特征以及基因表达谱。
本研究显示,子宫内膜异位症患者腹腔冲洗液中的Th17细胞和Th17.1细胞均存在于表达RORγt的CD4+CCR6+CCR10-T细胞中。RORγt是决定Th17细胞分化和功能的关键转录因子,介导初始T细胞向Th17细胞的分化[12]。Th17细胞相比,Th17.1细胞上调IFN-γ、TNF-α、GM-CSF和IL-1R1的表达。IFN-γ、TNF-α和GM-CSF均为重要的炎症性细胞因子。Th17细胞通过分泌IFN-γ、TNF-α和GM-CSF活化巨噬细胞、树突细胞、T细胞,促使这些细胞产生更多炎症性介质造成血管通透性升高、炎性细胞浸润和组织破坏[13]。IL-1R1是IL-1的受体,与IL-1结合后活化MAPK p38和NF-κB等信号通路促进Th17细胞的功能[14]。Th17.1细胞上较高的IL-1R1表达说明其可能接受更多的IL-1刺激导致其促炎功能更强。这些因子的高表达提示腹腔Th17.1细胞相对于Th17细胞具有更高的致炎活性。
IL-1β、IL-12、IL-23、前列腺素E2和TNF-α均能诱导Th17细胞分化为Th17.1细胞[3, 15-17],但是子宫内膜异位症患者腹腔内Th17.1细胞的诱导因素目前尚未明确。子宫内膜异位症病灶产生趋化因子,从而募集免疫细胞至病变组织,这些免疫细胞分泌IL-1β和TNF-α等多种炎性细胞因子[18],可能诱导Th17.1细胞的产生。后续研究将进一步明确这些炎性细胞因子及其来源细胞是否在体内外有效诱导Th17.1细胞的出现,同时对腹腔Th17细胞和Th17.1细胞进行转录组测序,比较二者基因表达谱的差异,探索二者的特异性标志、代谢特点、信号分子和功能分子。条件允许时应建立子宫内膜异位症小鼠模型,通过多种细胞和分子生物学手段,比如细胞过继输注、基因敲除、基因过表达等,明确Th17细胞和Th17.1细胞对子宫内膜异位症病理发展的影响。
综上所述,本研究依据趋化因子受体的差异性表达成功从子宫内膜异位症患者腹腔冲洗液中识别和分选了Th17细胞和Th17.1细胞,初步检测了二者的功能特征,为深入探讨Th17细胞和Th17.1细胞在子宫内膜异位症中的作用奠定了坚实基础。
◀
本文第一作者简介:
汪 璐(1986-),女,汉族,博士,研究方向:妇科疾病
