越冬饥饿胁迫对草鱼机体生化组成和糖脂蛋白代谢相关基因转录水平的影响
2022-11-25武文一
武文一 吉 红
(西北农林科技大学动物科技学院, 杨凌 712100)
在水产养殖过程中, 越冬饥饿对于鱼类而言是一个自然存在的重大挑战, 其实质是长期的不进食和低温的双重胁迫[1]。为了应对季节变化、产卵迁徙、繁殖及恶劣环境条件造成的饥饿挑战, 鱼类进化出了一套精准的内环境系统, 包括激素的分泌,与能量平衡维持相关的基因的表达及相对应酶的产生[2]。有研究指出, 饥饿对鱼体的形态学指标、机体组成成分、血清生化参数、能量利用、生理调节、激素调节乃至相关代谢酶的调节等方面会产生显著的影响[3]。也有学者开展了常温情况下草鱼机体蛋白质和脂肪对饥饿胁迫(<60d)的响应的研究[4], 但是对于草鱼越冬饥饿胁迫(>16周)下, 机体糖类、脂类和蛋白代谢对越冬饥饿胁迫响应的研究还未见报道。
多条中间代谢途径参与了鱼体储存能量物质在饥饿期间动员的过程[5]。一些研究评估了鱼类机体血清代谢物, 如葡萄糖、游离脂肪酸和甘油三酯等含量, 进而推断机体适应饥饿的生理生化进程[6]。研究发现, 在饥饿期间不同物种血浆代谢物水平的变化是不同的, 如西伯利亚鲟(Acipenser baerii)饥饿期间血糖水平下降[7], 而真鲷(Pagrus major)饥饿期间的血糖水平保持稳定[8]。饥饿导致大西洋鳕(Gadus morhua)血浆游离脂肪酸显著减少[9], 大口黑鲈(Dicentrarchus labrax)血浆游离脂肪酸则显著增加[10]。这些血浆代谢物谱的差异可能与鱼类种类、年龄、身体状况和饥饿持续时间有关。
饥饿会动员鱼体储存的能量物质, 如糖原、脂肪和蛋白[11]。据报道, 在饥饿的最初阶段, 许多鱼类的肝糖原大量减少, 但大多数鱼类的肝糖原沉积并没有完全耗尽, 表明存在一种使机体保持一定量的糖原以备动员的保护策略[12], 这一策略可能与来自氨基酸和甘油的生糖作用维持肝糖异生有关。相对于肝糖原, 肌糖原在肌肉中含量较少, 在饥饿过程中甚至可以消耗殆尽[13]。脂质是一种重要的能量来源, 在鱼体内有大量累积[14]。饥饿期间, 一般只有当糖原和脂质几乎耗尽时, 蛋白质才会被动员起来。但是有些鱼类在饥饿期间一直利用脂肪作为主要能量物质来源, 而有些鱼类在饥饿期间最初动员肌肉蛋白质而后动员脂肪[15]。鱼类在饥饿期间利用其能量储备(如糖原、脂肪和蛋白质)的策略可能与物种特异性有关。越冬饥饿期间, 草鱼机体能量平衡受到重大挑战, 作为细胞“能量传感器”,AMP活化蛋白激酶(AMPK)可以感知能量状态, 并根据代谢需要调节代谢途径[16]。前期研究表明, 饥饿能够改变机体能量状态从而激活AMPK[17]。越冬饥饿期间, AMPK不同亚型的转录水平也有着不同的变化趋势。这说明AMPK在越冬饥饿过程中通过激活下游代谢途径起着核心调节作用, 但AMPK是具体如何激活和调整下游糖脂蛋白代谢相关基因的分子反应或转录水平层面上研究依然欠缺报道。
草鱼(Ctenopharyngodon idellus)作为我国主要的水产养殖经济淡水鱼之一, 其产量居2019年中国养殖鱼类产量榜首, 达553.3×107kg[18]。草鱼在养殖过程中周期性经历越冬饥饿胁迫, 在我国的北方地区尤其如此。以往的研究多针对草鱼常温饥饿期间生理生化状态进行探讨, 而越冬饥饿期间草鱼的相关研究尚未报道。鉴于此, 为探讨草鱼应对0、1、2、4、8、12和16周的越冬饥饿胁迫, 测定了肌肉常规成分、血清能量代谢物、组织糖原、甘油三酯含量及AMPK通路下糖脂蛋白代谢相关基因转录水平, 旨在为阐明越冬饥饿期间草鱼维持机体稳态的潜在机制提供参考资料。
1 材料与方法
1.1 实验材料
实验鱼取自西北农林科技大学安康水产试验示范站室外培育池塘, 选择同一批次养成的商品规格鱼, 挑选大小整齐和健壮的个体作为实验对象,实验鱼体重(1053.33±16.11) g。同时在室外培育水泥池中驯化2周后开始实验, 驯化期间每日正常投喂商品饲料(粗蛋白28%和粗脂肪6%)。
1.2 实验条件和方法
实验在室外培育水泥池中进行(4 m×4 m×1 m),选取8个实验池, 中间用隔网隔开, 上面架设遮阳网,水深控制0.50 m左右, 水容量8 m3左右。经过2周投饲驯化后, 停食1d进行分组; 随机分为7组, 每组3个重复, 每个重复15尾鱼。当水温自然下降到草鱼停止摄食(水温15℃)时, 实验开始, 实验期间水温最低为4℃, 当水温自然升高到草鱼开始重新觅食(水温15℃)时实验结束, 时间从2017年11月10日至2018年3月3日, 此过程即为越冬饥饿期。温度变化见图 1。实验共计7组, 分别为饥饿0(week 0)、1(week 1)、2(week 2)、4(week 4)、8(week 8)、12(week 12)和16周(week 16)。实验用水为曝气后井水, 流水环境, 每2周清污。每日监测水温和水质,并观察实验鱼体健康状况和死亡状况。实验用水pH 7.8—8.2, 溶解氧5—6 mg/L, 氨氮<0.1 mg/L, 亚硝酸盐<0.01 mg/L, 硫化物<0.05 mg/L。
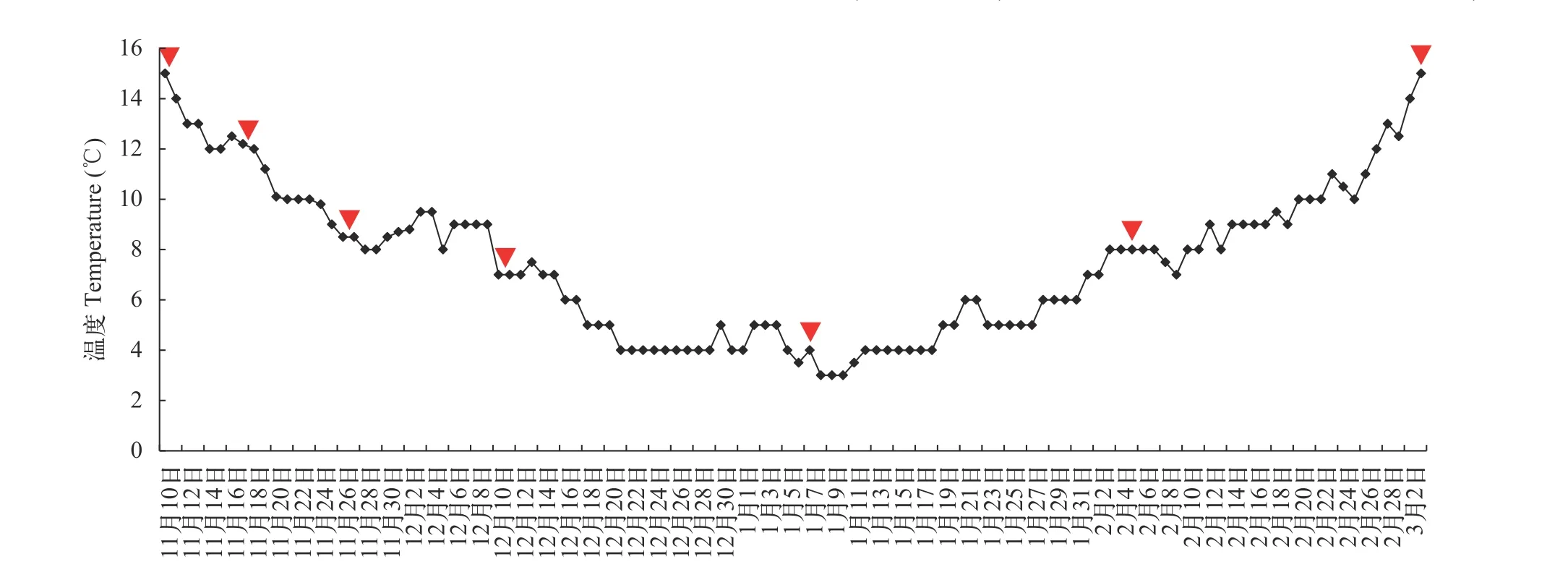
图1 实验过程中水温的变化Fig. 1 The water temperatures during the experiment倒三角为越冬饥饿期间采样时间点The inverted triangles are the sampling times during overwinter starvation
1.3 样品采集
采样程序经西北农林科技大学动物保护与利用委员会批准, 按照动物福利和道德规范执行。在各实验组饥饿处理结束时, 所有鱼用50 mg/L MS222麻醉后再对其进行取样。每个平行随机抽取2尾鱼尾静脉采血, 4℃冰箱静置2h, 4℃离心(3000 r/min,15min), 上层澄清透明淡黄色血清速冻于液氮中, 而后转入−80℃冰箱保存, 用作血清代谢物含量指标测定; 每个平行随机抽取2尾鱼在冰盘上解剖取内脏团, 取部分肝胰脏、肌肉和腹腔脂肪组织速冻于液氮中, 后转−80℃冰箱保存。随后, 在上述分离组织中, 取背部两侧背鳍后肌肉, 去皮、切除红肌后, 在−20℃冰箱保存, 用作肌肉常规成分组成分析。
1.4 测定指标和方法
肌肉常规成分测定包括水分、粗蛋白、粗脂肪和粗灰分, 采用AOAC(1995)方法[19]。肌肉水分采用冷冻干燥法测定, 粗蛋白质的测定为凯氏定氮法, 粗脂肪采用索氏抽提法, 灰分采用马福炉灰化法。
肝胰脏和肌肉中糖原(Glycogen)含量使用南京建成生物工程研究所试剂盒(货号A043)测定, 蛋白质浓度使用考马斯亮蓝染色法试剂盒(货号A045)进行测定。肝胰脏、肌肉、脂肪组织和血清中甘油三酯(TG)含量使用北京普利莱基因技术有限公司试剂盒(货号E1013)进行测定。血清中甘油(Glycerol)含量使用北京普利莱基因技术有限公司试剂盒(货号E1002)进行测定, 游离脂肪酸(Free fatty acids)和葡萄糖(Glucose)使用南京建成生物工程研究所试剂盒(货号A042, 酶法; 货号: F006-1-1)测定。血清中的鱼三磷酸腺苷(ATP)、鱼二磷酸腺苷(ADP)和鱼一磷酸腺苷(AMP)含量采用酶联免疫吸附(ELISA)试剂盒(上海沪峰化工有限公司, 上海市, 中国)进行测定(试剂盒的货号分别是F3805-A, F3808-A和F3806-A)。
1.5 定量聚合酶链反应(RT-qPCR)
实验所需引物序列及Gene Bank序列号见表 1。根据制造商的说明书, 用RNAiso Plus(TaKaRa,Dalian, China)从草鱼的肝胰脏、肌肉和脂肪组织中提取总RNA, 并用琼脂糖凝胶电泳和分光光度计(NanoDrop 1000, Thermo Scientific, Wilmington,USA)在260和280 nm处测定RNA完整性。提取纯化的总RNA经无RNase和DNase处理, 以防止基因组DNA扩增。使用PrimeScript™®RT 试剂盒(TaKaRa, Dalian, China)将总RNA反转录成cDNA。RT-qPCR采用CFX96实时PCR检测系统(Bio-Rad,Hercules, CA, USA)。每20 μL反应含有10 μL 2×SYBR®Premix ExTaq™ Ⅱ (TaKaRa, Dalian,China), 7.8 μL灭菌双蒸馏水(ddH2O), 1 μL 1﹕10稀释cDNA, 10 mmol/L浓度的正向和反向引物0.6 μL。RT-qPCR程序包括95℃下3min的初始激活步骤, 随后38个95℃ 15s反应、60℃下30s反应和65℃下5s反应的循环。β-肌动蛋白用作内参基因。PCR后, 通过熔融曲线分析证实了这些反应产生的单一产物。如前所述, 根据公式Ct法(2–∆∆Ct)用于计算基因表达值[20]。
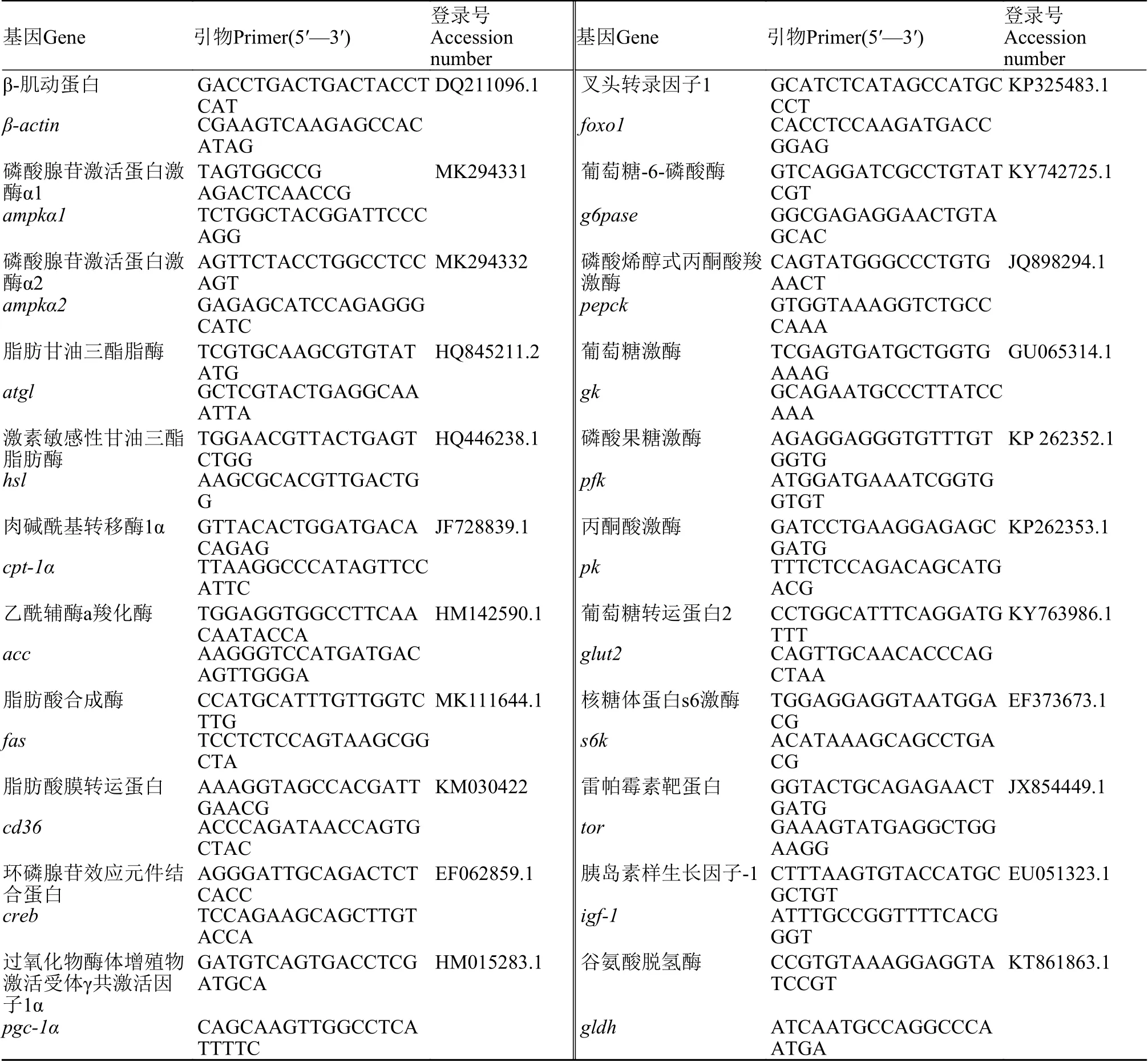
表1 实时定量PCR引物序列Tab. 1 Real time quantitative PCR primer sequence
1.6 数据处理
所有数据均采用SPSS统计软件(19.0版, Chicago, IL, USA)的单因素方差分析和Duncan’s多重比较检验进行分析。所有数据用平均值±标准差(mean±SD)的方式表示。P<0.05为差异显著。柱状图采用Prism 7 软件(Graph Pad Software Inc., San Diego, USA)进行绘制。
2 结果
2.1 不同越冬饥饿时间对草鱼肌肉常规成分的影响
不同越冬饥饿时间对草鱼肌肉常规成分的影响见表 2。肌肉中水分和粗灰分含量随越冬饥饿时间延长显著上升(P<0.05), 粗蛋白含量在越冬饥饿1周后显著降低(P<0.05), 越冬饥饿1周时肌肉粗脂肪含量显著上升(P<0.05), 随后显著下降(P<0.05)。

表2 不同越冬饥饿时间处理对草鱼肌肉常规成分的影响(%)Tab. 2 Effects of different overwinter starvation treatment on the proximate composition in the muscle of grass carp (%)
2.2 不同越冬饥饿时间对草鱼血清代谢物含量变化的影响
如图 2所示, 所有越冬饥饿处理组血清中葡萄糖含量随越冬饥饿时间延长显著降低(P<0.05), 胆固醇含量在越冬饥饿第12周显著降低(P<0.05), 血清蛋白在第4周开始显著降低后(P<0.05), 随着越冬饥饿时间延长, 交替显著上升后下降再上升至第16周。血清中甘油三酯和甘油含量随越冬饥饿时间延长显著降低(P<0.05), 血清游离脂肪酸含量在第2周显著升高后随即显著降低(P<0.05)。
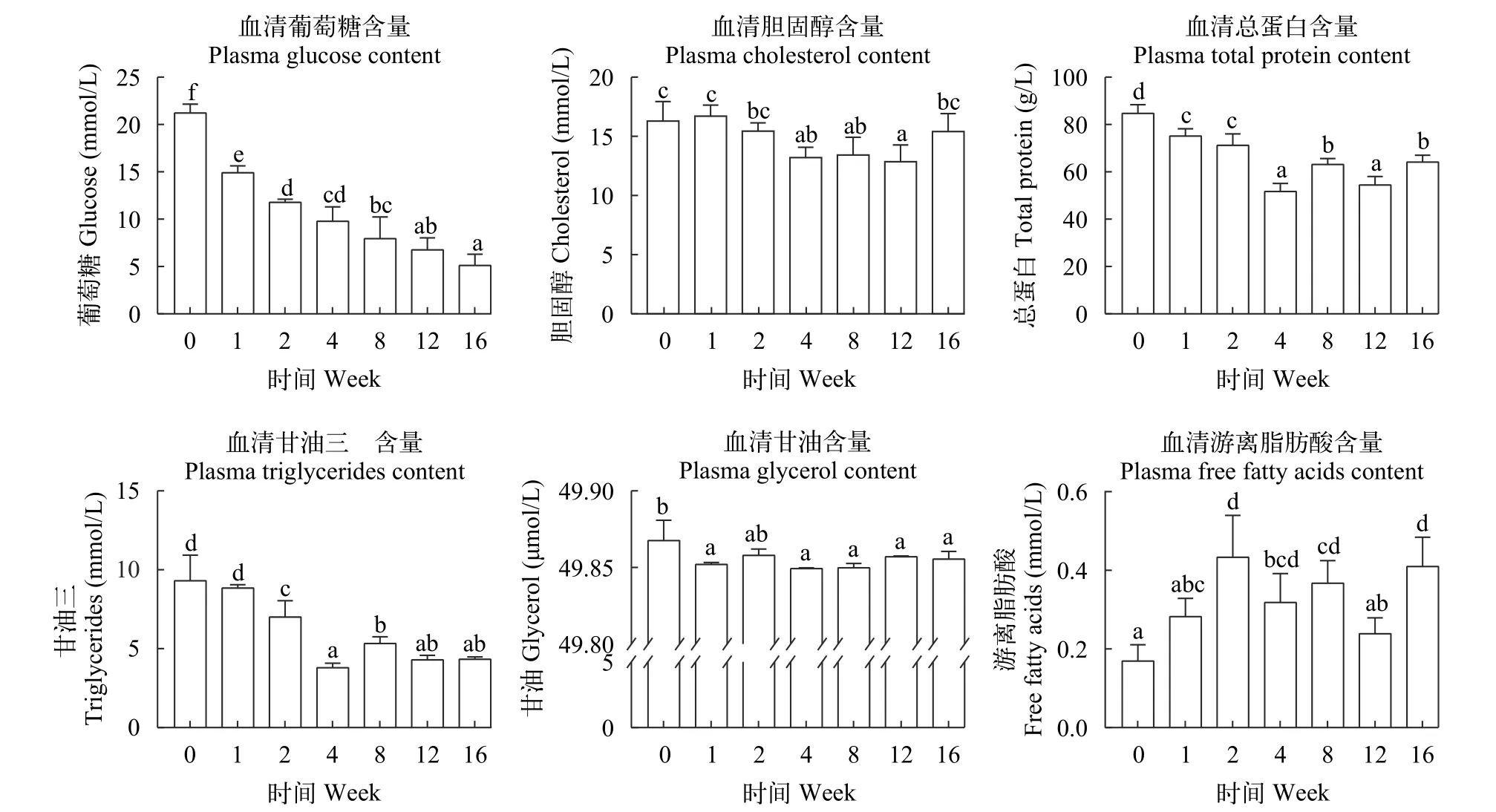
图2 不同越冬饥饿时间处理对草鱼血清代谢物含量变化的影响Fig. 2 Effects of different overwinter starvation treatments on metabolite levels content in serum of grass carp
2.3 不同越冬饥饿时间对草鱼组织中糖原及TG含量变化的影响
如图 3所示, 肝胰脏中糖原含量随越冬饥饿时间延长显著降低(P<0.05), 而肌肉中糖原在越冬饥饿第2周显著降低后(P<0.05)随即到8—16周显著升高, 与对照组无显著差异(P>0.05)。肝胰脏中甘油三酯含量在越冬饥饿4周后显著下降(P<0.05), 在第12周含量最低; 腹腔脂肪组织甘油三酯含量在越冬饥饿1周后显著下降(P<0.05), 第2周开始甘油三酯含量无显著差异变化(P>0.05); 而肌肉甘油三酯含量在越冬饥饿1周显著上升而后显著下降(P<0.05)。
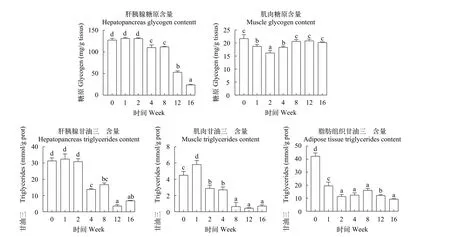
图3 不同越冬饥饿时间处理对草鱼各组织中糖原和TG含量变化的影响Fig. 3 Effects of different overwinter starvation treatments on glycogen and TG contents in tissues of grass carp
2.4 不同越冬饥饿时间处理对草鱼血清中能量分子含量的影响
如图 4所示, 草鱼血清中ATP含量随越冬饥饿时间延长显著降低(P<0.05), ADP和AMP含量随越冬饥饿时间延长显著上升而后下降(P<0.05), ADP+AMP/ATP比值随越冬饥饿时间延长显著上升(P<0.05)后在第12周后显著下降(P<0.05)。
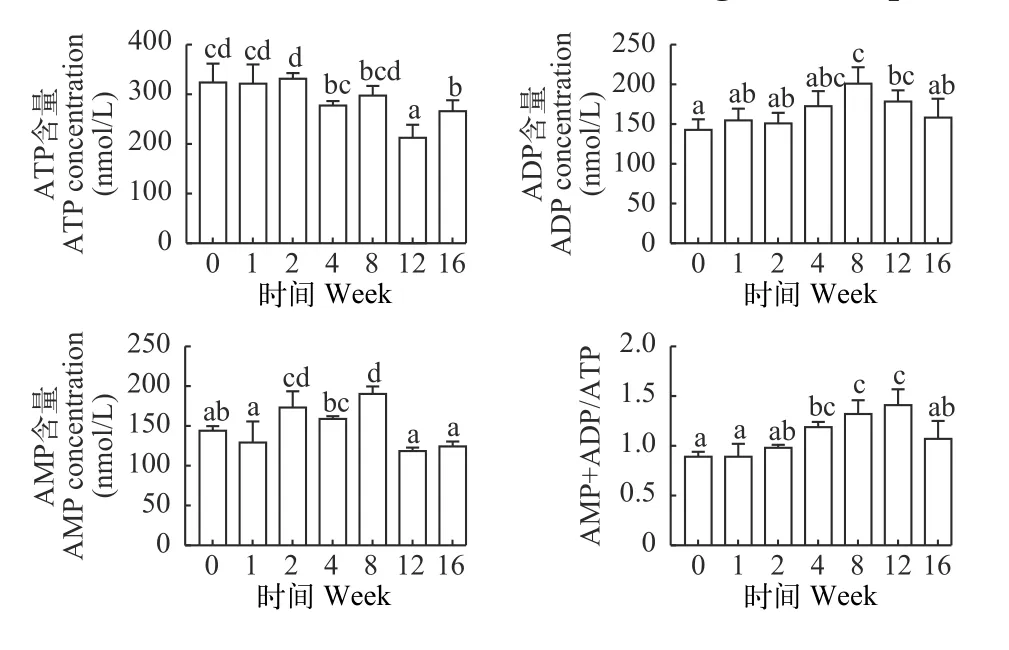
图4 不同越冬饥饿时间处理对草鱼血清中ATP、ADP、AMP含量和ADP+AMP/ATP比值的影响Fig. 4 Effects of different overwinter starvation treatments on ATP,ADP, AMP content and ADP+AMP/ATP in serum of grass carp
2.5 不同越冬饥饿时间处理对草鱼各组织中ampk α基因表达量的影响
如图 5所示, 肝胰脏中ampk α1及ampk α2转录水平在越冬饥饿第1周最高, 显著高于其他越冬饥饿处理组(P<0.05); 肌肉中ampk α1及ampk α2转录水平随越冬饥饿时间延长显著升高(P<0.05), 脂肪组织中ampk α1及ampk α2转录水平第4周最高, 显著高于其他越冬饥饿处理组(P<0.05)。
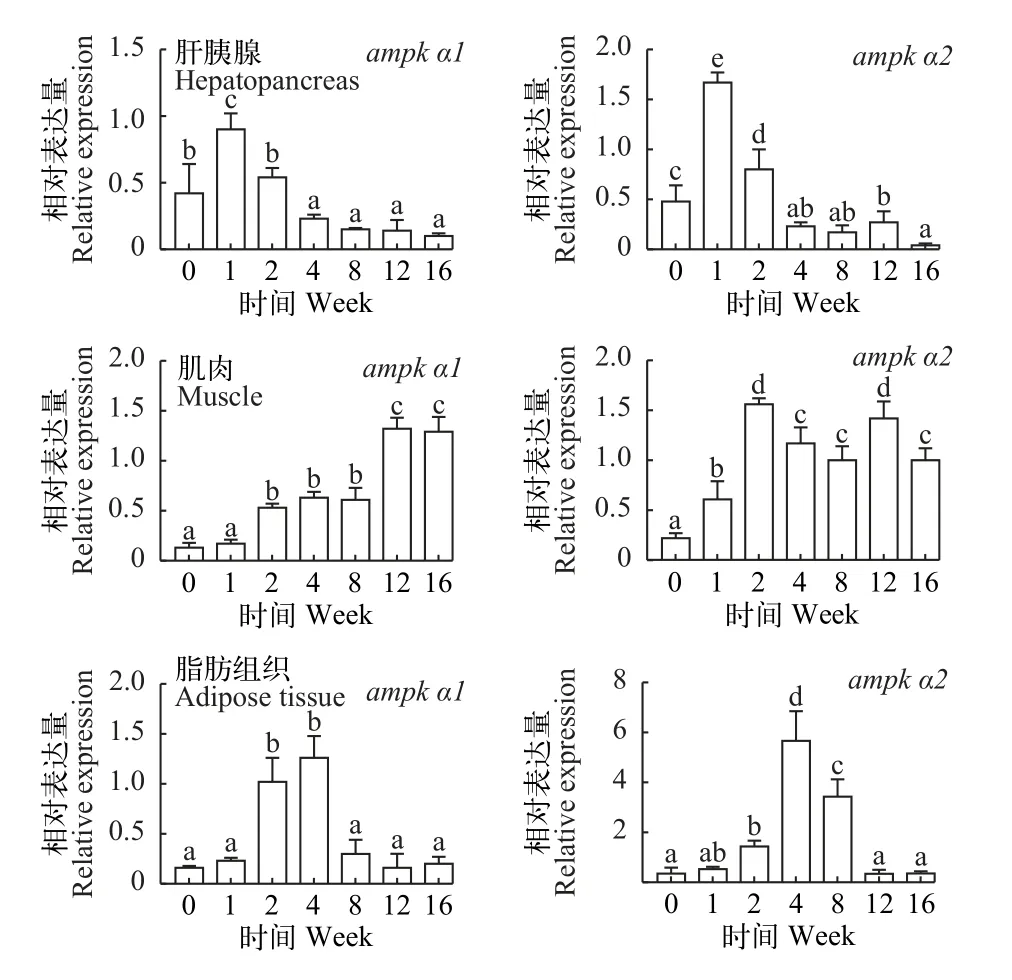
图5 不同越冬饥饿时间处理对草鱼各组织中ampk α基因表达量的影响Fig. 5 Effects of different overwinter starvation treatments on ampk α gene expressions in tissues of grass carp
2.6 不同越冬饥饿时间处理对草鱼肝胰脏脂代谢和糖代谢相关基因表达的影响
如图 6所示, 脂肪分解基因atgl、hsl和cpt1α在越冬饥饿处理第1周和第2周转录水平显著高于对照组及其他处理组(P<0.05), 脂肪合成基因acc和fas转录水平随越冬饥饿时间延长显著下降(P<0.05); 脂肪酸膜转运蛋白cd36基因转录水平随越冬饥饿时间延长显著上升(P<0.05); 糖代谢核转录因子creb、foxo1和pgc1α转录水平随越冬饥饿时间延长显著下降(P<0.05); 糖异生基因pepck和g6pase转录水平随越冬饥饿时间延长显著下降(P<0.05); 葡萄糖转运受体蛋白glut2基因转录水平随越冬饥饿时间延长显著下降(P<0.05); 糖酵解基因gk、pfk和pk转录水平随越冬饥饿时间延长显著上升, 均显著高于对照组(P<0.05)。

图6 不同越冬饥饿时间处理对草鱼肝胰脏脂代谢和糖代谢相关基因表达的影响Fig. 6 Effects of different overwinter starvation treatments on lipid and glucose related gene expressions in hepatopancreas of grass carp
2.7 不同越冬饥饿时间处理对草鱼肌肉脂代谢、糖代谢和蛋白代谢相关基因表达的影响
如图 7所示, 草鱼肌肉脂代谢基因atgl、hsl、cpt1α和cd36转录水平随越冬饥饿时间延长显著上升(P<0.05), 而acc和fas转录水平随越冬饥饿时间延长显著下降(P<0.05); 糖代谢核转录因子creb、foxo1和pgc1α转录水平随越冬饥饿时间延长显著下降(P<0.05); 糖异生基因pepck和g6pase转录水平随越冬饥饿时间延长显著下降(P<0.05); 葡萄糖转运受体蛋白glut2基因转录水平随越冬饥饿时间延长显著下降(P<0.05); 肌肉中蛋白代谢相关基因中,gldh基因转录水平随越冬饥饿时间延长显著上升(P<0.05), 而igf-1、s6k和tor基因转录水平随越冬饥饿时间延长显著下降(P<0.05)。
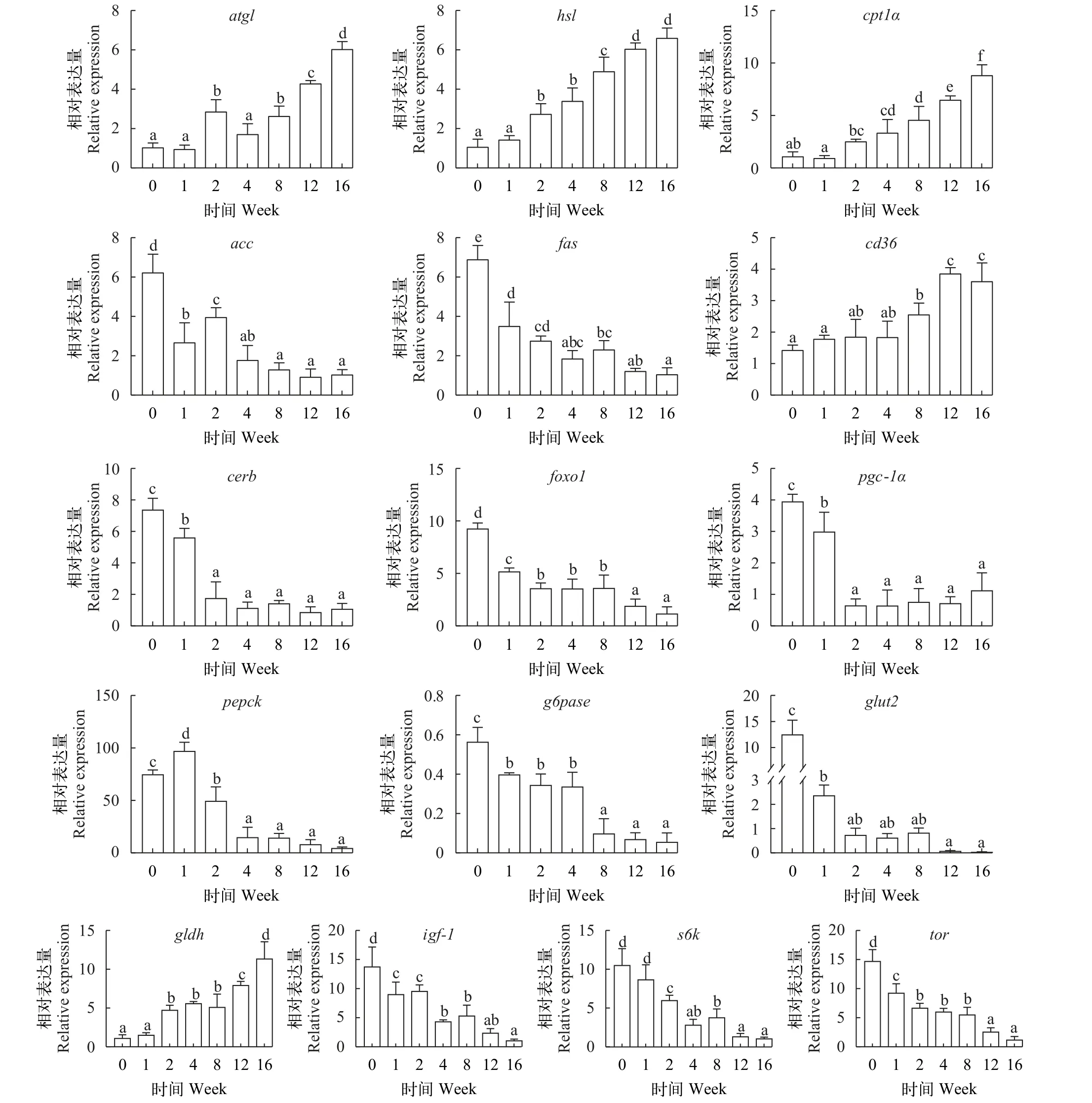
图7 不同越冬饥饿时间处理对草鱼肌肉脂代谢、糖代谢和蛋白代谢相关基因表达的影响Fig. 7 Effects of different overwinter starvation treatmens on lipid, glucose and protein related gene expressions in muscle of grass carp
2.8 不同越冬饥饿时间处理对草鱼脂肪组织脂代谢相关基因表达的影响
如图 8所示, 草鱼脂肪组织脂代谢基因atgl、hsl、cpt1α和cd36转录水平随越冬饥饿时间延长显著上升(P<0.05), 而acc和fas转录水平随越冬饥饿时间延长显著下降(P<0.05)。
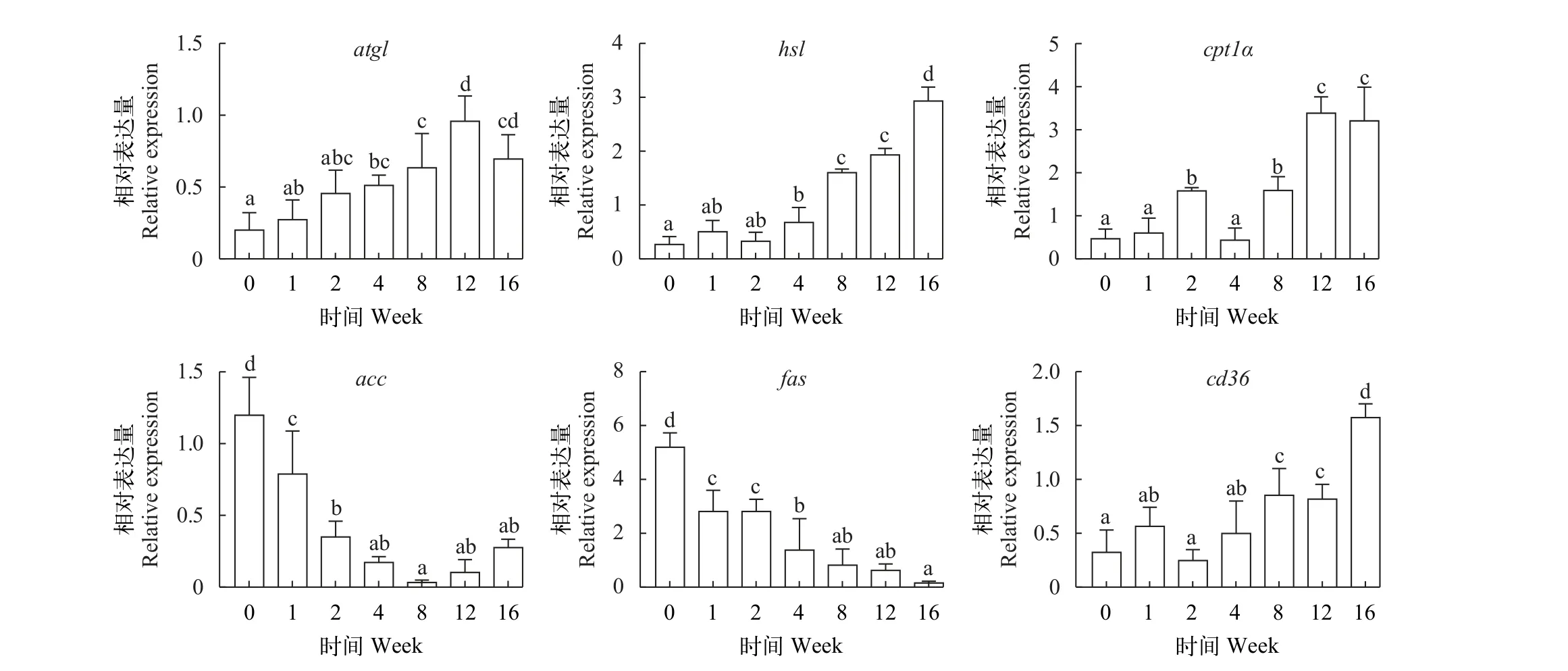
图8 不同越冬饥饿时间处理对草鱼脂肪组织脂代谢相关基因表达的影响Fig. 8 Effects of different overwinter starvation treatments on lipid related gene expressions in adipose tissue of grass carp
3 讨论
3.1 不同越冬饥饿时间对草鱼肌肉常规成分和血清代谢物含量的影响
鱼类在自然界生长过程中, 经常面临饥饿这一种自然生理胁迫[21]。在饥饿胁迫下, 鱼体仅能依靠自身营养物质的消耗来维持机体能量代谢平衡[22]。本研究表明, 随着越冬饥饿时间的增长, 肌肉中粗蛋白和粗灰分含量在第1周后显著下降, 这是因为机体蛋白质的动员与矿物元素的动员有直接关系[23];肌肉水分呈现上升趋势, 可能与越冬饥饿效应有关,因为水分的上升也是能量动员的前提条件[24]; 肌肉粗脂肪含量在越冬饥饿第1周达到最高, 随后降低。同时也观察到肌肉中TG有类似的趋势, 肌肉TG含量在越冬饥饿第1周达到最高, 这可能因为TG累积在肌肉中贮存为脂质的原因[25]。有研究报道, 常温饥饿14d草鱼稚鱼肌肉TG含量持续显著下降, 与本研究结果不同的是并未在饥饿第1周达到最高值而后下降, 这可能与实验鱼规格或者温度变化不一致造成, 而且草鱼稚鱼可能缺乏能从别处调动的脂肪进入肌肉[8]。血清中的甘油和游离脂肪酸是TG分解产物, 随着越冬饥饿时间的增长, 血清中TG的含量降低, 甘油和游离脂肪酸的含量也随着显著下降; 血清TP含量降低表明肝胰脏中蛋白质分解和氨基酸代谢的增强; GLU含量随着越冬饥饿时间增长显著降低, 但未消失, 这可能是肝胰脏和肌肉一直维持糖原合成的重要表现[26], 本研究显示肝胰脏和肌肉糖原含量显著下降后呈现稳定状态, 表明了这一观点, 这与其他作者研究结果类似[10,27]。上述结果表明越冬饥饿1周内草鱼体内可能发生肝胰脏和脂肪组织脂质转运进而增加了肌肉脂质含量, 同时发现草鱼越冬饥饿阶段, 最先动用的能量物质是肌肉糖原, 其次才是肝糖原, 而对脂肪的动员从第1周就开始直到越冬饥饿结束, 但是具有一定的组织特异性, 优先度分别是脂肪组织、肌肉和肝胰脏。肌肉蛋白在越冬饥饿第1周就开始显著下降, 与血清TP变化趋势一致。这表明草鱼肌肉蛋白在越冬饥饿第一周就进行了动员, 这与前人研究结果一致[4]。
葡萄糖是许多组织的必需能源物质[28], 因此,草鱼在饥饿期间必须维持血糖稳态。饥饿胁迫下的血糖水平变化很大。越冬饥饿7d后, 草鱼的血糖水平显著下降, 结果与大口黑鲈(Dicentrarchus labrax)变化一致[29], 这是由于在能量匮乏期间葡萄糖动员进行了供能。此外, 为了在长期饥饿期间满足代谢要求并保持稳定的葡萄糖水平, 还可能激活糖原分解或从头合成葡萄糖(糖异生)[30]。糖原作为维持饥饿期间血糖的来源具有物种特异性[28,31—33]。在本研究中, 肌糖原首先被动员, 越冬饥饿第4周肝糖原才被动员, 这表明, 草鱼在越冬饥饿期间, 肌糖原首先被用作维持葡萄糖水平, 这与大多数鱼类类似[7]。肝糖原在饥饿期是保守的, 在越冬饥饿第4周才观察到显著的下降, 这意味着肝胰脏中的糖原消耗比肌肉中的糖原少, 尽管肝糖原含量要远高于肌糖原。但是在越冬饥饿第8周之后, 肌糖原出现缓慢回升直到正常水平, 肝糖原含量则一直下降, 表明肌糖原作为草鱼越冬饥饿期间主要供能物质作用要强于肝糖原。因此, 草鱼的肝胰脏和肌肉对越冬饥饿的反应策略是不同的。脂肪作为能量密度最高的能源物质[31], 在鱼类长期饥饿过程中, 起主要供能作用[3]。本研究表明在越冬饥饿期间, 脂肪组织首先动员, 其次是肌肉和肝胰脏, 而作为机体重要的运动器官, 肌肉在越冬饥饿第1周粗脂肪含量和TG含量显著上升, 表明肌肉是机体消耗能源的主要部位[34]。肝胰脏中TG含量在越冬饥饿第4周变化趋势与肝糖原一致, 表明作为机体能量动员中转站, 也在发挥着维持机体稳态作用。血清中TG和TCHO含量, 与鱼的营养状况密切相关[35], 其代谢产物如甘油、游离脂肪酸和脂蛋白的含量通常被用来推断饥饿期间的脂质动员。随着饥饿时间的延长, 血清中TP和TG含量显著下降, 甘油和游离脂肪酸含量显著上升, 表明脂质动员水平在持续运行中。
3.2 不同越冬饥饿时间处理对草鱼各组织中AMPK α基因及其下游相关脂代谢、糖代谢和蛋白代谢相关基因表达量的影响
本团队前期研究表明, 越冬饥饿会显著改变草鱼机体肝胰脏、肌肉和脂肪组织ampk的表达水平[36]。为了阐明其在越冬饥饿期间能量调控潜在机制, 本研究系统地分析了血清及肝胰脏、肌肉、脂肪组织代谢产物的同时, 对ampk基因及其相关联的参与中间代谢反应的基因的转录水平也进行了检测, 图 9对上述转录水平的结果进行了过程示意。随着越冬饥饿时间的延长, 血清中ADP+AMP/ATP比值显著上升, 肝胰脏、肌肉和脂肪组织ampk的表达水平均表现了上升的趋势, 随后变化不一, 表明越冬饥饿激活了ampk基因表达[37—39]。在肝胰脏和肌肉中,随着越冬饥饿的进行,ampk基因激活糖酵解相关基因pfk, 同时加速了gk和pk的转录水平的提高, 促进了糖酵解[40]。在肝胰脏和脂肪组织中,ampk基因可直接磷酸化并促进atgl基因表达[41], 进而促进脂解,加速下游脂解基因hsl的表达, 同时磷酸化并促进acc基因表达, 抑制其活性[42], 降低了乙酰CoA转变成丙酰CoA, 间接降低了丙酰CoA对cpt-1α基因表达的抑制, 加速了脂肪酸的β-氧化[43,44], 同时抑制acc下游基因fas的表达, 降低脂质合成[45]。ampk还能够直接激活cd36的表达水平[46], 促进胞外游离脂肪酸进入细胞内[47], 进而促进了脂肪酸的β-氧化。环磷腺苷效应元件结合蛋白(creb), 过氧化物酶体增殖物激活受体γ共激活因子1α(pgc-1α), 叉头转录因子1(foxo1)是ampk调控糖异生关键限速酶g6pase和pepck的重要转录因子,ampk经磷酸化转导蛋白2降低creb的转录水平, 同时降低pgc-1α和foxo1的表达, 进而降低g6pase和pepck的生成, 降低糖异生。同时,ampk对抑制glut2的表达也有报道[48], 进一步降低糖异生的发生。在肌肉中, 激活的ampk可以促进蛋白质分解, 维持机体能量代谢平衡。ampk与tor之间存在负调控关系,ampk基因表达水平提高后抑制tor表达, 进而抑制s6k表达, 降低蛋白质合成, 这与前人报道相类似[49]。然而, 以上结果仅仅依赖于基因转录水平数据是具有局限性的。这些基因最终的功能需要转录翻译后并进行重要修饰, 因此与AMPK通路相关的糖脂蛋白代谢基因的功能需要进一步的研究。
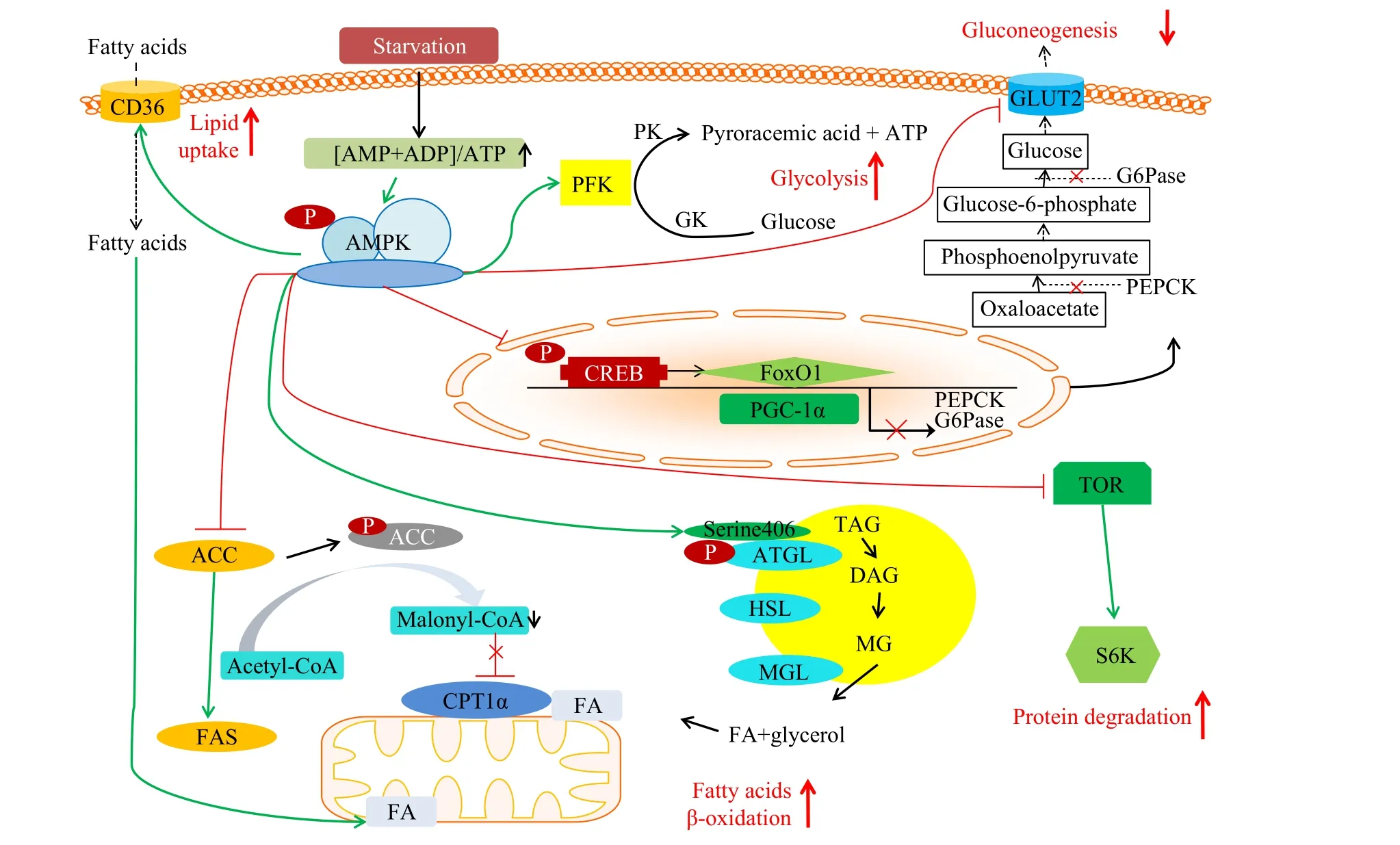
图9 越冬饥饿处理下草鱼能量代谢示意图: 基于AMPK及其下游通路相关基因Fig. 9 Energy metabolism of grass carp under overwintering starvation treatment: based on the AMPK and its downstream pathway related genes乙酰辅酶A. Acetyl-CoA; 丙二酰辅酶A. Malonyl-CoA; 脂肪酸. FA; 三酰基甘油酯. TAG; 二酰基甘油酯. DAG; 单酰基甘油酯. MG; 葡萄糖. Glucose; 丙酮酸. Pyroracemic acid; 草酰乙酸. Oxaloacetate; 磷酸烯醇丙酮酸. Phosphoenolpyruvate; 葡萄糖-6-磷酸. Glucose-6-phosphate; 甘油. Glycerol; 脂质摄取. Lipid uptake; 脂肪酸β-氧化. Fatty acids β-oxidation; 糖酵解. Glycolysis; 糖异生. Gluconeogenesis;蛋白质降解, Protein degradation
4 结论
综上所述, 越冬饥饿对草鱼的糖、脂、蛋白代谢有显著影响。肌糖原和肝糖原的持续消耗, 及糖酵解和糖异生的相互运行, 有助于维持草鱼在越冬饥饿期间的血糖水平; 通过促进脂肪、蛋白质分解和脂肪酸β-氧化过程, 及抑制脂肪酸合成来维持能量平衡。此外, 草鱼在动员能量方面表现出一定的优先次序、敏感性和组织特异性。其中, 通过激活AMPK通路及促进或抑制其下游相关基因表达, 增强能量供应降低能量消耗, 促使越冬饥饿期间机体能量稳态的维持。本研究提供的信息可用于制定有效的草鱼越冬前后投喂策略, 针对草鱼期间能量物质代谢情况, 可在越冬前后投喂饲料中适当调整脂肪作为最重要的供能物质, 同时推动草鱼在越冬养殖期间管理者做出更加适当的决策, 以期改善草鱼越冬前后的存生产效率。
