团头鲂foxO基因家族的序列特征及表达分析
2022-11-25张阿鑫王伟峰王焕岭
张阿鑫 陈 康 王伟峰 刘 红,2 王焕岭,2
(1. 华中农业大学水产学院, 农业农村部淡水生物繁育重点实验室, 武汉 430070;2. 华中农业大学水产养殖实验教学中心, 武汉 430070)
Fox(Forkhead box)蛋白家族是最重要的转录因子家族之一, 其成员包含一个进化上高度保守的约100多个氨基酸组成的DNA结合结构域, 被称为叉头结构域(Forkhead domain, FH)[1,2]。迄今为止, 从原核生物到真核生物中均发现Fox成员的存在, 并将其分为19个亚类(A到S)[1]。其中FoxO是一个非常重要的亚家族, 在哺乳动物中发现4个FoxO同源基因, FoxO1、FoxO3a、FoxO4和FoxO6[3,6,7], 而在一些硬骨鱼类中有7个成员, FoxO1a、FoxO1b、FoxO3a、FoxO3b、FoxO4、FoxO6a和FoxO6b[8],这些成员间具有较高的同源性。
FoxO的活性受磷酸化、乙酰化和泛素化等的调控, 而由于其具有高度保守的苏氨酸和丝氨酸残基的磷酸化位点, 因此磷酸化是FoxO的主要修饰方式[3,4]。FoxO的功能发挥主要受两种进化保守的信号通路调控: 其一是经典的胰岛素信号通路, 即生长因子存在的情况下通过磷脂酰肌醇三激酶(Phosphatidylin-ositol-3-kinase, PI3K)和蛋白激酶B(Protein kinase B, PKB, 也叫AKT)调控; 其二是Jun N-末端激酶(c-Jun N-terminal kinase, JNK)信号通路, 在氧化应激时通过该通路起作用[5]。FoxO作为转录激活因子, 往往通过调控下游靶基因来发挥生物学功能, 在DNA损伤修复、氧化应激、细胞凋亡和自噬、细胞增殖与分化及细胞代谢等方面都发挥重要作用[3]。
团头鲂(Megalobrama amblycephala)又名武昌鱼, 为草食性淡水鱼类, 常见于长江中游地区。自20世纪60年代以来, 团头鲂已被公认为中国淡水鱼混养体系中主要的品种和最受欢迎的养殖品种之一[9—11], 并成为我国最重要的淡水养殖鱼类之一[12,13]。然而, 随着养殖密度的增加, 水体富营养化进程的加重, 水生生态系统的氧气需求量急剧增加[14]。另外, 全球气候变暖的趋势日渐严重也增加了鱼类对氧气的需求[15], 进而导致水体溶解氧的减少[16]。尤其是在淡水环境中, 每天水体的含氧量处于波动的状态中[17], 因此低氧正成为水生生物生存压迫下的普遍问题[18,19]。为了进一步了解鱼类的低氧应激机制, 我们前期对团头鲂低氧胁迫后的生理生化、免疫应答和氧化应激及基因表达等的变化进行了研究[11,20—22], 同时, 也发现低氧会引起团头鲂foxO信号通路显著富集[11]。然而,foxO是否参与团头鲂低氧应激, 其在不同组织和不同发育时期的分布等信息都是不清晰的。因此, 本研究基于组学及PCR鉴定了团头鲂foxO基因, 并对其时空分布及在低氧胁迫下的表达变化进行了分析。这些结果为进一步了解鱼类foxO基因在低氧应答中的作用提供了一定的理论依据。
1 材料与方法
1.1 低氧处理实验及样品采集
本研究所用团头鲂来自湖北省百容水产良种有限公司, 将幼鱼[体重(50±5) g]和成鱼运回实验室后在暂养池中正常饲喂, 2周后用于正式实验。通过向水体中充入氮气的方法对团头鲂幼鱼进行低氧处理, 用保鲜薄膜封闭水槽上方, 使用便携式溶解氧测定仪(JPB-607A)测定溶氧, 急性低氧(DO:1.0 mg/L, T: 25℃)处理0.5h后, 取肝脏、脾脏、肌肉、脑、心脏、鳃、肠、肾脏和血液9个组织, 每组3个重复, 每个重复3尾, 置于加有1 mL TRIzol的离心管中, –80℃保存, 用于总RNA的提取。以常氧[DO: (5.5±1.0) mg/L]作为对照。
用于时空表达分析的样品取自常氧条件下团头鲂成鱼(n=3)的肝脏、脑、肠、鳃、心、肌肉、血液、脾脏和肾脏9个组织, 以及不同发育时期的胚胎和仔稚鱼, 取样后立即放入液氮中速冻, –80℃保存, 用于总RNA的提取。
1.2 总RNA的提取及cDNA的合成
利用TRIzol试剂提取团头鲂不同组织或不同发育时期胚胎的总RNA, 具体按照说明书进行。然后将提取的总RNA反转录成cDNA, 具体为: 1 μg总RNA、5 μL oligo(dT)引物, 加RNase-free水至总体积15 μL, 在70℃孵化5min, 冰上放置2min。然后向混合物中加入1 μL RNA抑制剂、5 μL M-MLV缓冲液(5×)、2 μL dNTPs(10 mmol/L)、1 μL MMLV酶和1 μL RNase-free水, 42℃孵育60min。
1.3 基因的扩增
利用团头鲂基因组[25]和本实验室的转录组数据构建本地Blast数据库, 用斑马鱼的foxO家族基因进行Blastn(E值设定为1×10–5)比对, 从而获得团头鲂7个foxO基因的cDNA序列。以获得的cDNA为模板设计引物通过PCR扩增验证其ORF序列的准确性(引物序列见表 1)。引物的合成和测序由武汉天一辉远生物科技有限公司完成。

表1 实验所需引物Tab. 1 Primers used in the experiment
1.4 序列分析
将cDNA序列与基因组序列进行比对, 并按GT-AG法则确定外显子和内含子的位置, 构建基因结构图; 通过NCBI上的ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/orfig.cgi)预测开放阅读框(Open reading frame, ORF)及相应的氨基酸序列; 使用ExPASy(https://web.expasy.org/compute_pi/)在线工具计算蛋白质的等电点(pI)和相对分子质量(Mw)等参数; 利用DNAMAN(https://www.lynnon.com/)分析氨基酸序列的同源性; SMART(http://smart.embl-heidelberg.de/)预测FoxO蛋白的结构域;用MAGE 6.0软件使用最大似然法构建FoxO蛋白的系统进化树, 并对其进行1000次bootstrap检验。
1.5 荧光定量PCR
利用实时荧光定量PCR(Quantitative real-time PCR, qPCR)分析团头鲂foxO基因的表达(引物序列见表 1), 根据参考文献[22—24]选择ACTB为内参基因。qPCR总反应体系为20 μL, 包含7.4 μL的超纯水, 上、下游引物各0.8 μL, 1 μL cDNA模板, 10 μL SYBR Green mix reagent。采用三步法进行qPCR,具体如下: 预变性95℃ 5min, 接着40个循环包括95℃变性15s, 60℃退火30s及72℃延伸30s, 每个样品3次重复。用2–∆∆Ct方法计算目的基因相对于内参基因ACTB的表达量。
1.6 载体构建
从团头鲂基因组中下载foxO1b基因的启动子序列, 使用软件Primer Premier 5设计引物(引物序列见表 1), 并以团头鲂肌肉组织的DNA为模板进行PCR扩增, 然后将获得的序列经双酶切后定向连接到pGL3-basic载体中, 构建pGL3-foxO1b启动子载体。同时为了验证Hif-1α对foxO1b转录活性的调控, 我们将团头鲂hif-1α基因的cDNA序列与pCMV-myc载体连接, 以构建hif-1α的过表达载体。
1.7 启动子活性分析
Hela细胞生长于DMEM培养基、10%胎牛血清和1%青霉素-链霉素溶液, 置于37℃, 5% CO2培养箱中。将Hela细胞接种于24孔板, LipofectaminTM2000 转染试剂共转染过表达质粒pCMV-myc-Hif-1α或pCMV-myc, 荧光素酶报告基因载体pGL3-foxo1b或pGL3-basic, 内参质粒pRL-TK, 转染24h后,根据Dual-LuciferaseCReporterAssay System说明书测定双荧光素酶活性。
1.8 数据分析
实验数据均使用SPSS19.0软件进行统计分析。数据采用平均数±标准差(mean±SD)来表示, 两组数据分析使用独立样本t检验, 多组数据分析采用单因素方差分析(One-way ANOVA), 两两比较采用Duncan检验, 以P=0.05作为检验标准。
2 结果
2.1 团头鲂foxO家族的序列特征
基因的序列分析基于组学测序及PCR验证, 获得团头鲂foxO1a、foxO1b、foxO3a、foxO3b、foxO4、foxO6a和foxO6b基因序列(GenBank登录号:MW752194-MW752200), 其编码序列在1803—2157 bp, 编码的氨基酸在600—718, 等电点(pI)和相对分子质量分别为4.82—6.86和65.38—78.14 kD(表2)。拷贝数分析发现团头鲂和斑马鱼(Danio rerio)基因组中,foxO1、foxO3和foxO6均有2个拷贝, 而在人类(Homo sapiens)、牛(Bos taurus)、小鼠(Mus musculus)、鸡(Gallus gallus)和蜥蜴(Anolis carolinensis)中每个基因都只有1个拷贝(表3)。
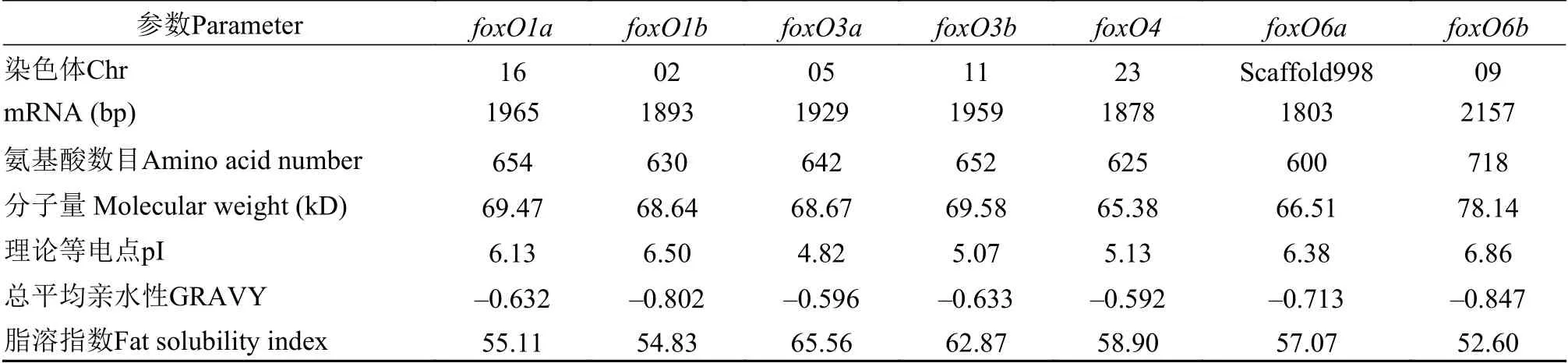
表2 团头鲂foxO家族基因的序列特征Tab. 2 Sequence characteristics of foxO genes in M. amblycephala

表3 脊椎动物中foxO基因拷贝数的比较Tab. 3 Comparison of copy numbers of foxO genes among selected vertebrate species
氨基酸序列的同源性比较及系统进化分析将团头鲂7个FoxO氨基酸序列与其他几种脊椎动物的同源蛋白序列比对, 结果显示, 团头鲂7个FoxO氨基酸序列与斑马鱼的同源性最高, 相似性在77.98%—92.51%。基于最大似然法构建不同物种的FoxO氨基酸序列的系统进化树, 结果显示各物种FoxO蛋白可以分为两大分支, 即FoxO1和FoxO4为一大分支, FoxO3和FoxO6为另一大分支。另外,不同物种间每个FoxO成员各自聚成一支, 且团头鲂每个FoxO都与斑马鱼同源关系最近(图1)。
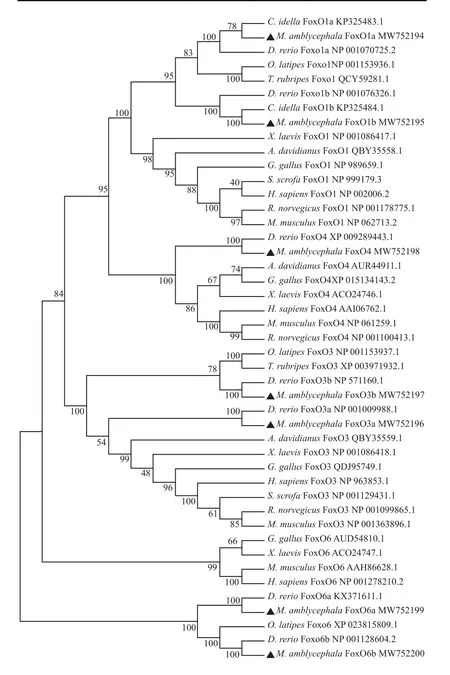
图1 FoxO家族基因的系统进化分析Fig. 1 Phylogenetic tree analysis of FoxO genes带三角形的为团头鲂FoxO蛋白, 每个蛋白后面附上GenBank序列号, 节点上的数值表示bootstrapThe FoxO genes of M. amblycephala were shown in black triangles. Each gene is followed by the GenBank number, the value on the nodes represent the bootstrap
2.2 团头鲂foxO基因的表达分析
foxO基因在不同组织中的表达为了探究foxO基因在团头鲂成鱼各组织中的表达情况, 本研究利用qPCR检测了foxO基因在肝、脑、肠、鳃、心、脾、肾、肌肉和血液9个组织中的表达变化(图2), 团头鲂7个foxO基因在所检测的9个组织中均有表达, 但在不同组织中的表达差异明显, 其中,foxO4在血液中表达量最高,foxO6a在肝脏中表达量最高, 而foxO6b在脑组织中表达量最高。
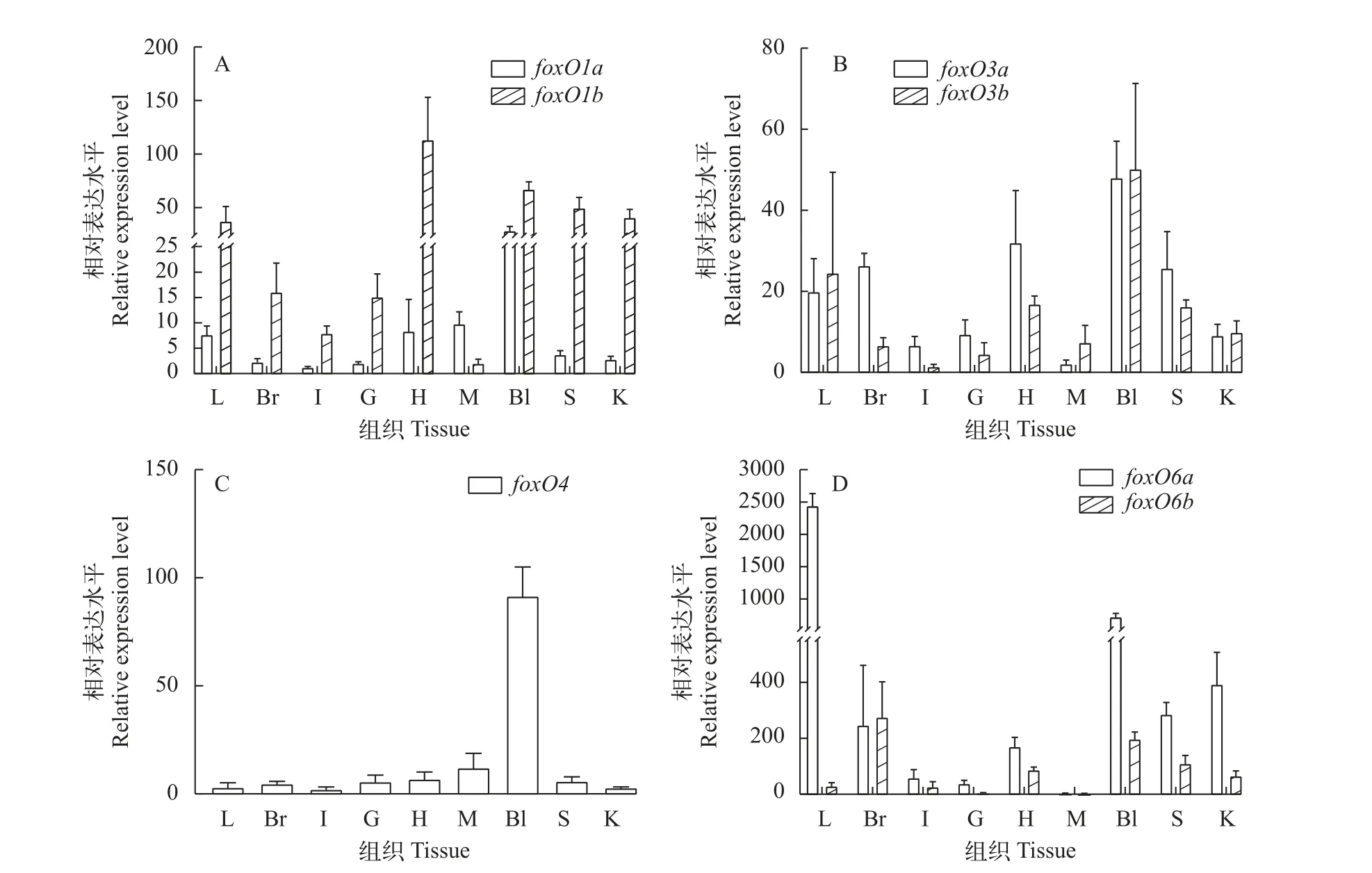
图2 团头鲂foxO在不同组织中的表达Fig. 2 Expression patterns of foxO genes in different tissues of M. amblycephala肝脏(L); 大脑(Br); 肠(I); 鳃(G); 心(H); 肌肉(M); 血液(Bl); 脾脏(S); 肾脏(K); 下同Liver (L); Brain (Br); Intestine (I); Gill (G); Heart (H); Muscle (M); Blood (Bl); Spleen (S); Kidney (K). The same applies below
foxO基因在不同发育时期中的表达如图 3所示,foxO1a和foxO1b的表达模式类似, 即在早期发育过程中(48.4hpf除外)基因的表达呈现逐渐升高的趋势, 直到94.4hpf(体节生成期)达到最大, 随后表达量降低, 并在10 dpf(受精后天数, Days post-fertilization)升高。另外, 结果也发现foxO4、foxO6a和foxO6b的表达模式也比较类似, 即在72.2hpf(眼色素沉淀晚期)、94.4hpf和10dpf表达量较高, 在其他时期的表达量都较低。foxO3a除在94.4hpf存在较高表达外, 在其他大部分时期的表达量都很低。foxO3b在发育早期的表达量逐渐升高, 直到15.4hpf(体节出现期)出现第一个峰值, 随后逐渐下降, 但在72.2hpf表达量达到最高, 而后又呈逐渐降低的趋势。整体来看,foxO基因在团头鲂早期发育过程中虽然呈现不同的表达模式, 但也存在一个共同的特点, 即这几个基因在72.2hpf、94.4hpf和10dpf都有相对较高的表达量。
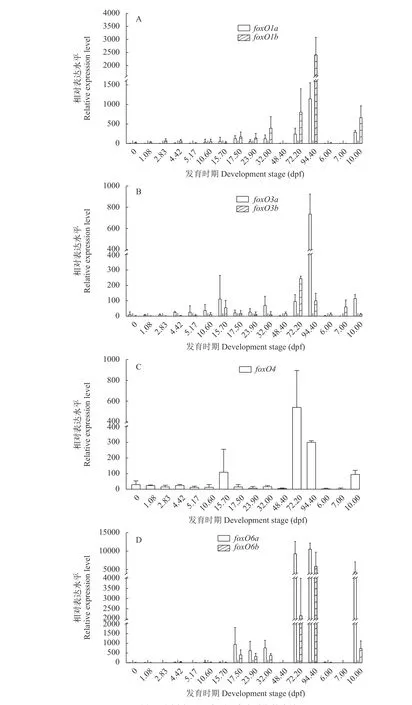
图3 团头鲂foxO在不同发育时期的表达Fig. 3 Expression patterns of foxO genes at different developmental stages of M. amblycephala
低氧对foxO基因表达的影响为了进一步分析低氧对团头鲂7个foxO基因表达的影响, 本研究利用qPCR检测了低氧处理后foxO在不同组织中的表达变化(图4)。结果显示低氧处理后, 7个foxO基因在各组织中的表达变化不同, 其中在肌肉、肠、鳃、脑及肝脏中呈显著上调的趋势, 尤其是在肌肉组织中, 而在肾脏、心脏及血液中呈显著下降的趋势。
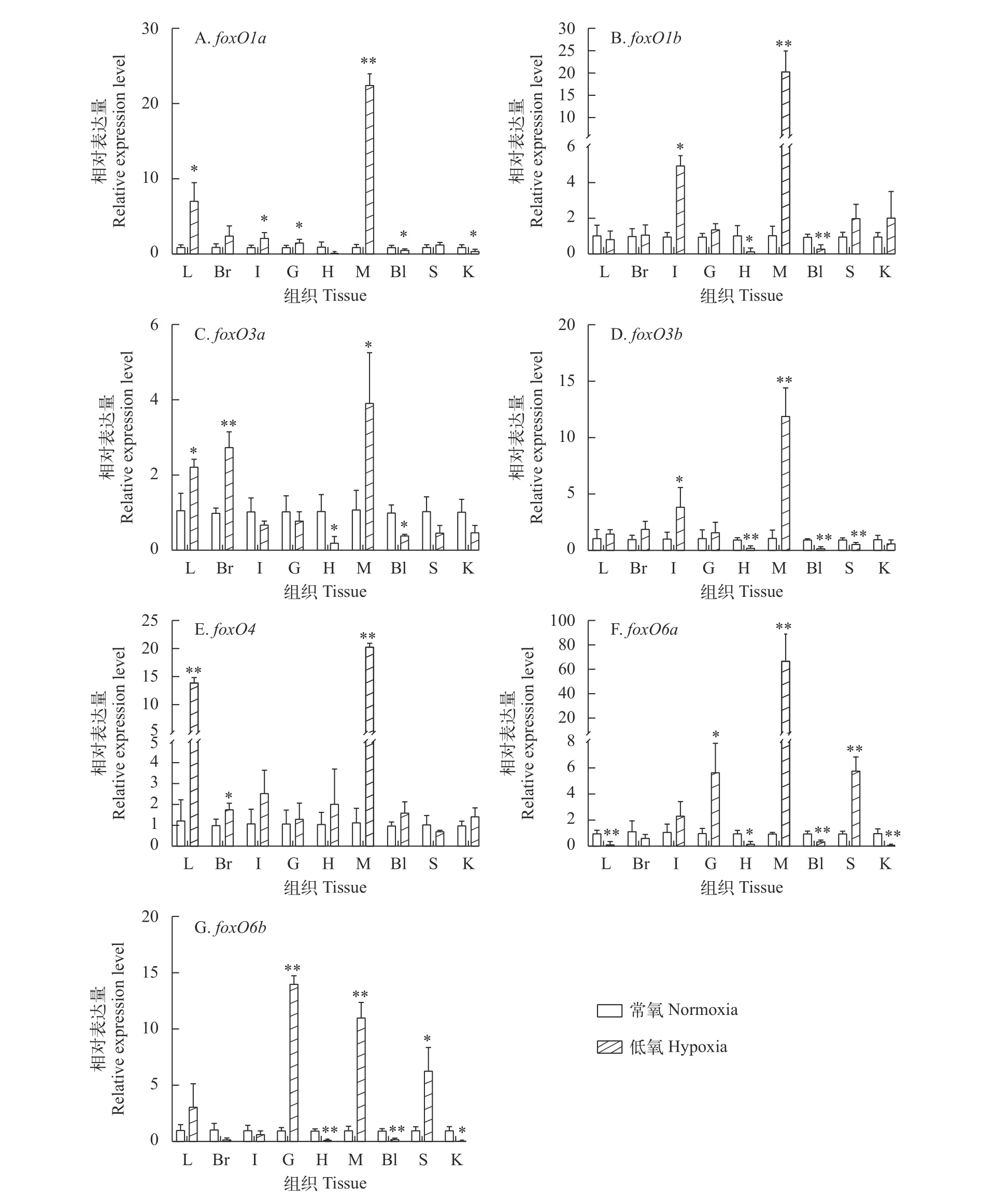
图4 低氧处理后团头鲂foxO基因在不同组织的表达变化Fig. 4 The relative expression of foxO genes in different tissues of M. amblycephala after hypoxia treatment“*”表示P<0.05, “**”表示P<0.01“*” represents P<0.05, “**” represents P<0.01
foxO基因的转录受Hif-1α调控为了进一步探究团头鲂7个foxO基因在低氧应激中的调控机制, 本研究在基于JASPAR2022网站对foxO基因启动子的转录因子进行了分析, 发现7个foxO基因启动子区域均含有多个Hif-1α结合位点(图5A)。利用荧光素酶报告系统检测了foxo1b启动子活性。结果表明, Hif-1α过表达后, pGL3-foxo1b的荧光素活性显著上调, 说明Hif-1α可能通过与foxO1b基因启动子结合影响其转录, 即foxO1b基因受到Hif-1α的转录调控(图5B)。

图5 foxO基因的转录受Hif-1α调控Fig. 5 The foxO gene transcription is regulated by Hif-1αA. foxO基因启动子中Hif-1α结合位点; Hif-1α结合位点是ACGTG和GCGTG; B. Hif-1α过表达对foxO1b转录活性的影响; pCMVmyc作为对照A. Hif-1α binding sites of foxO gene promoters. Hif-1α binding sites are ACGTG and GCGTG; B. Effect of Hif-1α overexpression on foxO1b transcript activity. pCMV-myc is used as the control
3 讨论
3.1 团头鲂foxO基因家族的序列分析
本研究基于团头鲂组学分析及PCR扩增共鉴定出7个foxO基因, 包括2个foxO1(foxO1a和foxO1b)、2个foxO3(foxO3a和foxO3b)、2个foxO6(foxO6a和foxO6b)及foxO4, 这与斑马鱼foxO鉴定的结果一致[26—29]。拷贝数分析发现, 在团头鲂和斑马鱼的基因组中,foxO1、foxO3和foxO6都存在两个拷贝, 而在人类、牛、小鼠、鸡和蜥蜴基因组中都只有一个拷贝, 这可能是由于硬骨鱼类在进化过程中经历了一次特有的基因组加倍, 导致一个基因在鱼类中可能存在多个同源基因[30—32]。SMART蛋白结构域分析显示, 团头鲂7个FoxO蛋白都具有保守的Forkhead(FH)、FOXO_KIX_bdg和FOXO-TAD结构域,这是FoxO蛋白家族特有的结构域[27]。系统进化分析显示FoxO家族的成员几乎都被划分为4个不同的进化分支, 其中团头鲂FoxO家族蛋白成员与鱼类的同源基因进化关系最为紧密, 与其他哺乳动物和两栖动物则相距较远, 这符合传统意义上的进化关系。
3.2 团头鲂foxO基因的时空表达分析
为了分析foxO在团头鲂不同组织及胚胎发育过程中的表达变化, 本研究通过qPCR检测了团头鲂foxO家族基因的时空表达, 结果显示foxO1a/foxO1b在团头鲂各个组织中均有表达。而草鱼foxO1a/foxO1b在各组织中也均有表达, 但在心脏中的表达量最低[33], 与本研究结果存在一定差异, 这可能是由于物种或个体大小等的差异所导致的。研究表明FoxO1敲除的小鼠会由于胚胎血管生成障碍死于胚胎早期[34]。整胚原位杂交发现在36和48hpf时,foxO1a/1b在斑马鱼心脏中都持续表达[35]。团头鲂foxO1a/1b在成鱼心脏和血液中的高表达, 在胚胎不同发育过程中呈现逐渐上升的表达趋势, 说明团头鲂foxO1a/1b可能与心血管的形成有关。团头鲂foxO3a/foxO3b在每个组织都能被检测到, 这与该基因在斑马鱼不同组织中的表达谱相似[36]。在胚胎发育过程中团头鲂foxO3a/foxO3b的表达主要集中在眼色素沉淀晚期(72.2hpf)和体节生成期(94.4hpf)。基于RT-PCR发现斑马鱼foxO3a在8hpf后表达量持续偏低, 而foxO3b在14hpf后表达量持续增加, 并其都参与调节神经系统发育及分化[34—36]。而foxO3a/3b在团头鲂和斑马鱼胚胎发育过程中表达趋势不同, 其功能也尚不确定。团头鲂foxO6a主要表达在肝脏中,foxO6b主要在脑组织中表达, 而哺乳动物的FoxO6只在大脑和肝脏中表达[39], 说明鱼类foxO6与哺乳动物相比出现了功能分化。另外我们也发现在胚胎发育过程中, 团头鲂foxO6a和foxO6b基因在眼色素沉淀前的表达水平都比较低,而斑马鱼整胚原位杂交结果显示,foxO6a和foxO6b基因在1hpf时均未表达, 但在5hpf均能检测到表达,并逐渐增加, 在24—72hpf达最高[37], 说明团头鲂foxO6a和foxO6b基因在胚胎发育期间的功能和斑马鱼的类似, 并可能存在协同作用。
3.3 低氧对团头鲂 foxO基因家族表达的影响
研究发现低氧胁迫后果蝇FoxO转录活性被迅速诱导, 并且在低氧条件下foxO突变体的糖代谢紊乱, 个体存活率降低[40]。另外研究也证实低氧处理后FOXO3a作为HIF-1的下游靶点被激活[39]。斑马鱼中foxO3b的缺失, 可导致低氧耐受能力降低[41]。这些研究表明foxO可能参与低氧调控。为了研究低氧对鱼类foxO表达的影响, 本研究通过qPCR分析了低氧处理后团头鲂不同组织中foxO的表达变化, 结果显示7个foxO基因在许多组织尤其是肌肉中的表达量都显著上调。基于启动子分析显示团头鲂这7个foxO基因启动子序列中都存在Hif-1α的结合位点, 并且通过双荧光素酶实验显示Hif-1α对foxO1b有调控作用, 推测foxO基因可通过Hif-1α介导的途径参与鱼类低氧调控。另有研究表明低氧胁迫会造成团头鲂和鲢的心肌细胞凋亡, 从而导致鱼体心脏损伤甚至死亡[42,43]。Sirtl可能通过抑制Foxo1 mRNA表达, 延迟心肌细胞的细胞周期, 减少细胞凋亡[44]。而黄颡鱼在低氧胁迫中会造成氧化应激损伤, 代谢模式由有氧呼吸至无氧呼吸转变[45]。外源性胰岛素能激活 AKT-FoxO1 磷酸化、上调FoxO1蛋白和转录水平, 进而提高糖酵解和降低糖异生水平来维持大口黑鲈的糖代谢稳态[46]。而FoxO的低表达可促使细胞发挥抗氧化应激和保护的作用[47—50]。本研究发现foxO基因在心脏和血液中主要呈现显著下调的趋势, 推测其基因表达减少可能有助于减少细胞凋亡, 调节糖代谢, 增加了机体的抗氧化能力和心脏的供应能力。
本研究共鉴定出团头鲂7个foxO基因, 包括2个foxO1、2个foxO3、1个foxO4和2个foxO6, 并显示了特异的时空表达模式。另外本研究也发现低氧引起团头鲂foxO基因在大部分组织中的上调表达,受Hif-1α调控, 说明foxO家族可能通过Hif-1α介导的途径参与鱼类低氧应激, 这为进一步研究鱼类低氧的调控机制研究奠定一定的理论基础。
