鞍带石斑鱼精子诱导斜带石斑鱼雌核生殖
2022-11-25张维炜吴廷昌陈猛猛吴光灿
樊 欣 张维炜 吴廷昌 文 鑫 陈猛猛 吴光灿 骆 剑
(海南大学海洋学院, 海南省院士团队创新中心, 海南省水产种业工程研究中心,南海海洋资源利用国家重点实验室, 海口 570228)
数十年来, 人工诱导雌核生殖在理论研究和生产实践中取得了突出的成就[1—6], 已成为鱼类生殖研究与遗传育种工程的重要组成部分[7]。然而, 雌核生殖在淡水鱼[8]中的研究较早、成果丰硕, 而在海水鱼[9—12]中, 由于全人工繁殖技术发展较晚, 雌核生殖的研究与应用少。人工雌核生殖作为一种高效的细胞学育种技术, 在海水鱼养殖产业蓬勃发展的同时, 必然会受到越来越多的重视。
石斑鱼属于名贵暖水性礁栖鱼类, 隶属鲈形目(Perciformes)、鮨科(Serranidae)、石斑鱼属(Epinephaelus), 约有159种[13]。石斑鱼产量逐年递增,据2020年中国渔业年鉴[14]统计, 2019年全国石斑鱼养殖产量为18.3×107kg, 较前一年的15.9×107kg增幅14.76%, 仅次于大黄鱼(Larimichthys crocea),是我国海水养殖产量第二的鱼类, 是一个极具养殖开发潜力的种质资源类群。石斑鱼养殖产业快速发展的同时也面临着病害频发、养殖性状参差不齐等亟待解决的问题, 这与石斑鱼的良种率低的现状密切相关。石斑鱼性成熟时间长达3—5年,传统选育周期长。而人工诱导雌核生殖可以实现优势基因的快速纯合与劣势基因的淘汰[15], 大大提高石斑鱼的选育效率。而且, 作为一种先雌后雄的性反转鱼类, 雌核生殖是研究其性别规律的独特手段。
本研究以斜带石斑鱼为对象, 开展人工诱导雌核生殖的研究, 不仅为良种培育提供理论和技术支持, 也为后续其他热带海水鱼类开展雌核生殖研究提供了参考依据, 同时对于石斑鱼性别决定机制的研究也具有重要价值。
1 材料与方法
1.1 实验材料
本研究所用亲鱼由海南青利水产繁殖有限公司提供, 位于三亚铁路港和陵水新村。选取体表无伤、性腺发育成熟、健康的亲鱼, 亲鱼无需催产,用棉布擦干泄殖孔及腹部, 轻轻挤压腹部即可获得鞍带石斑鱼鲜活精子及斜带石斑鱼成熟卵子, 精子置于4℃保温箱中避光待用, 卵子现取现用。
1.2 实验方法
预实验鲜精取回需对精子活力进行检查,以加入海水10min后仍有超过50%精子具有运动能力为精子质量较好。分别设置100、300和500 lx三组紫外强度灭活实验, 实验后发现, 使用100 lx灭活精子, 一直灭活到10min, 通过与卵子受精进行倍性检测, 仍有较高比率的二倍体, 精子灭活不足, 使用500 lx灭活精子, 仅照射30s后, 与卵子的受精能力便快速下降, 照射剂量难以准确把握。使用300 lx灭活5min与卵子受精直至孵化, 发现较高比例的单倍体综合征, 通过对这些单倍体综合症胚胎/初孵仔鱼随机抽取进行倍性分析检测, 皆为单倍体。
设置受精后5min、15min和25min, 在5℃、10℃和15℃的水温下, 持续冷休克10min、20min、30min和40min对胚胎进行处理, 所有组的胚胎均经倍性分析仪检测倍性, 最终检测到在受精后5min和10℃水温, 冷休克持续10min、20min和30min均存在冷休克加倍二倍体存在。
综上, 对所有预实验条件进行梯度设置, 进行下列实验。
精子遗传物质灭活精子稀释液采用Ts-19[16],精子与稀释液比例为1﹕9, 取1mL稀释的精子平铺在预冷的培养皿中, 缓慢摇动培养皿使稀释精子厚度均匀确保其充分灭活。紫外灯(Philips, G15T8,wavelength of 254 nm)提前10—15min开启使照射强度稳定, 采用照度计(Philips, G15T8, wavelength of 254 nm)测量照射剂量; 强度为250—340 lx, 灯箱中心区域是340 lx, 两端是250 lx, 平均光强为330 lx; 紫外照射过程中保持摇动以确保精子照射均匀。
分别设置精子照射时间对照组(C, 0min)和实验组分别照射2min、4min、6min、8min和10min,锡箔纸包裹EP管收集照射过的精子置于4℃冰箱中遮光保存备用。灭活完的精子需在显微镜观察是否在灭活过程中被激活。用各实验组精子与斜带石斑鱼正常卵子授精, 静水培养, 受精约1.5h后, 显微镜下检查16—32细胞期的受精卵200—300个统计胚胎发育个数, 表观受精率=(卵裂卵子数/卵子总数)×100。随后, 将所计数胚胎转移至烧杯中, 培育至初孵仔鱼, 计算孵化仔鱼总数和表现单倍体综合症(同时采用倍性分析仪鉴定倍性校正)数目, 孵化率=(出苗数/总受精卵数)×100; 用于比较不同照射时长的精子能力, 确定最佳照射剂量。受精卵培养的海水盐度为30‰, 温度为26—28℃, 下同。
最佳冷休克启动时刻实验冷休克处理时刻实验组分别设置为C1(正常二倍体对照组)和C2(单倍体对照组, 使用预实验得到的最佳照射剂量处理得到的精子), 对照组C1用于检测精子和卵子的质量, 而对照组C2用于检测精子紫外灭活环节是否达到要求。分别在受精后3min、4min、5min、6min、10min、15min、20min、25min、30min和35min开始进行冷休克处理, 每组的受精卵约为5—10 g, 根据预实验结果设定冷休克水温保持在4—6℃, 持续时间为30min, 待处理结束后, 立即使受精卵脱离低温环境并用大量26—28℃海水清洗并复温。分别统计受精率, 孵化率和诱导率, 得到最佳处理时刻。
冷休克处理时长和处理水温实验冷休克处理时长时间分别设置为C1、C2、10min、15min、25min、30min和35min, 处理水温分别为1—3℃、4—6℃和7—9℃, 双因子交叉分组, 冷休克启动时刻参照冷休克启动时刻实验中的最佳结果, 对照组C1和C2条件同上, 以上各组分别设2—3次重复。
诱导率=(二倍体胚胎数/检测总胚胎数)×100。
胚胎倍性检测使用Partac倍性分析仪(Sysmex/CyFlowPloidy Analyser)检测胚胎相对DNA含量测定, 以此鉴定雌核生殖子代的倍性状态。取正常二倍体对照组(C1)、单倍体对照组(C2)、雌核生殖二倍体实验组受精后的胚胎/仔鱼10—20个, 破碎细胞, 制成细胞悬液, 将匀浆用50 μm的过滤器过滤样本, 加入1.6 mL DAPI染液染色, 经2—5min孵育后, 上机分析。校准仪器, 电压为551.5V, 使得正常二倍体的峰值设定在30附近。该设置保持恒定,并且测试样品通过其主峰的相对位置来表征。
斜带石斑鱼雌核生殖子代的微卫星鉴定从已发表的研究报道[17]中, 查找石斑鱼属微卫星引物, 从26对中筛选出能够很好鉴定雌核生殖子代的8对微卫星引物, 分别为D316、Mbo061、GAG01、Mbo066、GAA-1、RH_GATA_003、Ec-122、CA-2和GAA-1(表1)。

表1 微卫星引物信息Tab. 1 Microsatellite primer information
分别提取雌核生殖子代14个、正常杂交个体2个、父母本各1个的DNA, 采用微卫星引物行PCR反应, 通过非变性聚丙烯酰胺凝胶检测, 常规PAGE胶银染显带。
1.3 数据处理
采用 Excel 统计各项指标, 所有数据均表示为平均值±标准差表示。采用IBM SPSS Statistics 19软件进行单因素方差分析(ANOVA)和 Duncan氏多重比较。显著性水平用P表示,P<0.05 表示差异显著,P<0.01 表示差异极显著。
2 结果
2.1 最佳精子紫外遗传灭活条件确定
精子灭活条件实验中各组受精率、孵化率及单倍体率情况如图 1。实验结果显示: 实验组中2min、4min与6min组的受精率分别为82%、78.7%和6%, 而8min和10min组的受精率分别为0.5%和0.67%; 2min组胚胎单倍体率为72%, 其余各实验组所检测胚胎的单倍率均为100%; 孵化率方面各组分别为80.3%(对照组)、41.3%、2%、0、0和0;2min组及4min组的大量胚胎在孵化前后出现明显的单倍体综合征。4min组与其他实验组相比, 具有较高的受精率、单倍体率和较低的孵化率, 因此确定照射4min (518 mJ/cm2)为最佳精子紫外照射时间, 后续实验均采用此剂量处理精子。

图1 不同紫外照射时间对鞍带石斑鱼精子的影响Fig. 1 Effect of different times with UV irradiation on sperm0为正常杂交二倍体对照; n=3; xˉ ±SD0. normal hybrid control
2.2 最佳冷休克处理时刻的确定
分别在受精后的3min、4min、5min、6min、10min、15min、20min、25min、30min和35min时刻冷休克处理受精卵, 处理水温为4—6℃, 冷休克持续时间30min。实验结果显示如图 2所示: 各实验组中4min组和20min组显示出较高的受精率; 孵化率从3min组到6min组呈现逐步上升的趋势, 6min组孵化率达到29.7%, 后又逐渐下降; 胚胎倍性检测数据显示, 6min组二倍体诱导率最高(100%), 统计诱导率时发现15min以后的实验组孵化率极低, 因此确定受精后的6min为冷休克最佳处理时刻。

图2 斜带石斑鱼雌核生殖不同受精后启动时刻的比较Fig. 2 Comparison of different post fertilization initiation times of gynogenesis in Epinephelus coioidesC1. 二倍体对照; C2. 单倍体对照组; 同类型柱形图中标有不同小写字母者差异显著; P<0.05; n=3; xˉ ±SD; 下同C1. Hybrid control; C2. Haploid control; Different superscript letters within the same type of column chart significant difference, P<0.05.The same applies below
2.3 冷休克持续时间和水温的确定
分别设定冷休克处理持续时间组为: C1、C2、10min、20min、30min和40min, 处理水温分别设置为1—3℃、4—6℃和7—9℃。Duncan多重比较分析(表2)结果显示, 不同处理时间(P=0.579)和处理水温(P=0.133)在受精率方面差异并不显著,而在孵化率方面不同处理时间组间差异显著(P=0.002), 不同处理水温组差异不显著(P=0.396),从孵化率的角度分析, 处理时间为10min时, 随着处理水温的升高, 孵化率也逐步增加; 20min组, 孵化率随着处理水温的增加而增加, 在4—6℃处达到最大值, 而后下降; 30min、40min组, 随着处理水温的增加, 孵化率表现为下降趋势。如图 3和图 4所示,在4—6℃的水温条件下处理20min可以得到相对较高的受精率和孵化率。
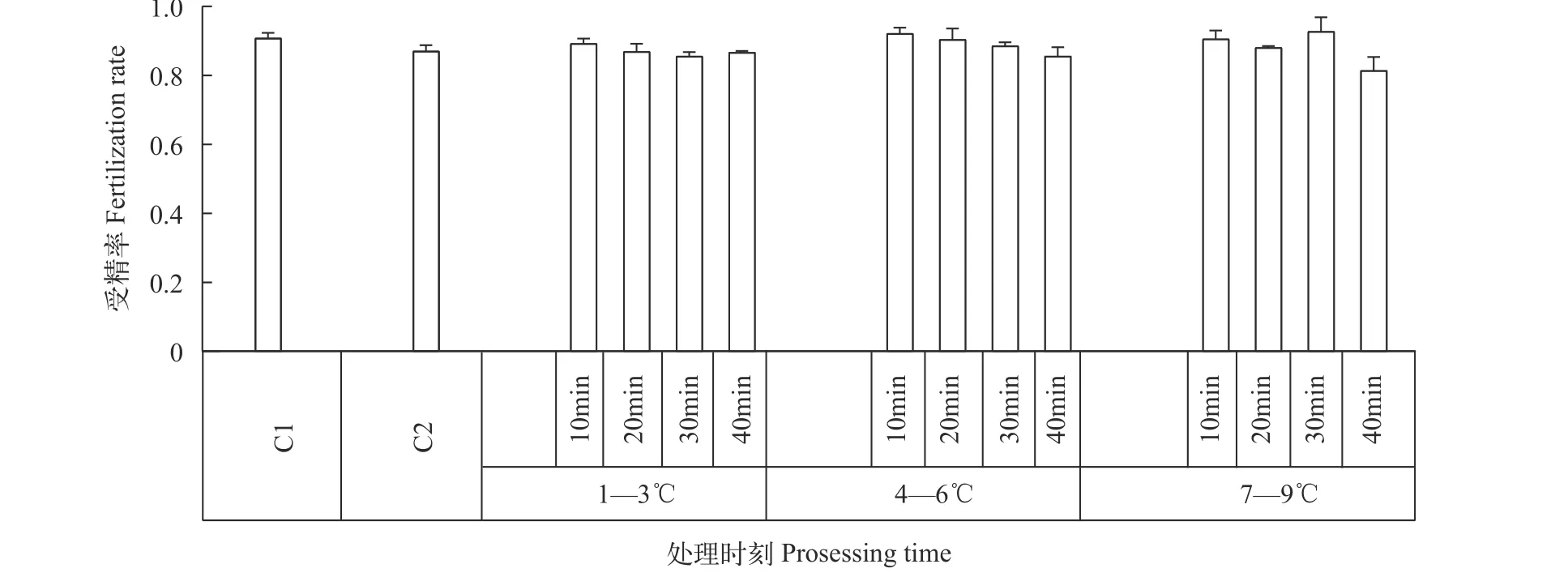
图3 斜带石斑鱼雌核生殖不同处理方式受精率的比较Fig. 3 Fertilization rate of different duration times and temperatures of cold shock on gynogenesis in Epinephelus coioidesC1. 二倍体对照组; C2. 为单倍体对照组C1. hybrid control; C2. haploid control

图4 斜带石斑鱼雌核生殖不同处理孵化率的比较Fig. 4 Hatching rate of different duration times and temperatures of cold shock on gynogenesis in Epinephelus coioidesC1. 二倍体对照组; C2. 单倍体对照组C1. Hybrid control; C2. Haploid control
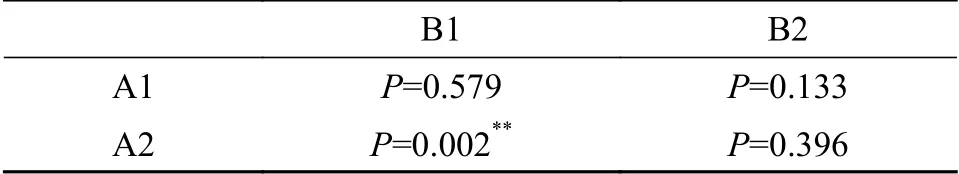
表2 Duncan多重比较分析数据表Tab. 2 Duncan multiple comparative analysis data table
2.4 单倍体、正常二倍体、雌核生殖二倍体倍性鉴定及形态比较
受精后16h测定正常发育二倍体、雌核生殖二倍体、单倍体的DNA相对含量, 正常二倍体DNA峰值设定为30, 则单倍体DNA峰值为15, 倍性检测结果见图 5。

图5 人工雌核生殖各组DNA相对含量Fig. 5 Relative content of DNA in artificial gynogenesisA. 斜带石斑鱼雌核生殖单倍体; B. 正常发育二倍体对照; C. 雌核生殖二倍体A. Haploid; B. Normal diploid control; C. Gynogenetic diploid
发育形态如图 6所示: 杂交二倍体精卵状态良好, 受精后可以正常发育, 具有较高的受精率(90.8%)和孵化率(58.2%)。雌核生殖因为经历了精子灭活处理以及胚胎冷休克处理, 表观受精率(40%)和孵化率(29.7%)相比较杂交二倍体都有所降低, 另雌核生殖胚胎在原肠胚期及神经胚期具有较高的死亡率, 神经胚期之后发育正常。雌核生殖个体和杂交二倍体出膜后活力正常。
单倍体胚胎在各个主要的胚胎发育阶段都有不同程度畸形: 在细胞分裂期时, 单倍体胚胎细胞隆起但是无法正常分裂; 单倍体胚胎囊胚结束后胚胎异常无法下包进入原肠胚期; 神经胚期, 单倍体胚胎分化异常, 不能形成神经管; 器官形成期, 单倍体胚胎围心腔较大, 肌节形成缓慢、尾短, 不能运动, 表现出单倍体综合症, 仅有4.1%的个体发育到出膜, 少量出膜个体表现为卵黄囊为正常二倍体的130%, 同时期雌核生殖个体尾部长度仅为正常二倍体的31%, 也很快死亡。
2.5 微卫星鉴定结果
8对微卫星引物分别为D316、Mbo061、GAG01、Mbo066、GAA-1、RH_GATA_003、Ec-122和CA-2(表3), 对母本斜带石斑鱼、父本鞍带石斑鱼(诱导精子供体)、杂交对照个体和雌核生殖诱导个体均能扩增出稳定的条带。结果显示: 杂交对照样本N1、N2的条带均分别来自于父母本; 人工雌核生殖诱导样本C1—C12中, 11个个体的条带均与母本保持一致, 而C11个体的7个位点的条带既有母本条带也有父本条带, 该个体应该是紫外照射处理中未灭活精子受精导致; 此外C6号个体在Mbo061位点扩增出父本条带相同(图7), 而在其他位点与母本相同, 该个体应为异精效应现象。微卫星结果显示该批样品具有91.29%的雌核生殖诱导率。
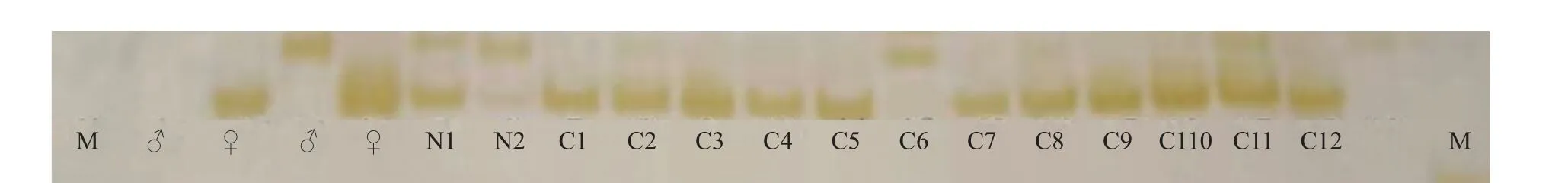
图7 斜带石斑鱼人工雌核生殖诱导样本在微卫星Mbo061位点上的扩增结果Fig. 7 The PAGE gel elctrophpresis figure of primer Mbo061 product♂为父本样品; ♀为母本样品; N1、N2为杂交对照样品; C1—C12为雌核生殖个体样品♂. Male parent; ♀. Female parents; N1 and N2. Controls; C1—C12. Gynogenetic individuals

表3 斜带石斑鱼人工雌核生殖群体微卫星鉴定结果Tab. 3 Microsatellite identification of artificial gynogenesis population of Epinephelus coioides
3 讨论
3.1 异源精子是石斑鱼卵子雌核生殖的良好激活源
人工雌核生殖通常采用异源精子作为刺激源[18—20],一方面便于诱导后的鉴定, 一方面异精效应的存在可能带来新的优良性状[21]。本文选用异源鞍带石斑鱼的精子作为激活源具有两个优势: 其一是鞍带石斑鱼精子量大, 方便获取; 其二是鞍带石斑鱼与斜带石斑鱼具有明显的形态学差异, 可以外观分辨雌核生殖二倍体和杂交二倍体。
本文设置了单倍体对照组对人工诱导雌核生殖进行控制, 单倍体组采用灭活异源精子激活卵子,但不进行二倍化诱导。在正常条件下, 该对照组将出现发育停滞、围心腔扩大和短尾等单倍体综合症(图6)。若单倍体组中出现正常的初孵仔鱼, 则表明该批次灭活的精子存在不彻底的问题, 在胚胎孵化阶段就可以排除掉不符合要求的诱导组, 大大降低诱导的错误率。

图6 斜带石斑鱼人工雌核生殖各组主要胚胎发育阶段Fig. 6 The main embryonic development stages of artificial gynogenesis groups of Epinephelus coioidesa. 雌核生殖卵裂期; b. 雌核生殖原肠胚期; c. 雌核生殖神经胚期; d. 雌核生殖肌节期; e. 单倍体卵裂期; f. 单倍体原肠胚发育停滞;g. 单倍体神经胚发育停滞; h. 单倍体肌节发育异常; i. 正常二倍体初孵仔鱼; j. 雌核生殖二倍体初孵仔鱼; k. 单倍体初孵仔鱼a. Gynogenetic cleavage stage; b. Gynogenetic gastrula stage; c. Gynogenetic neuroembryo stage; d. Gynogenetic sarcomere stage;e. Haploid cleavage stage; f. Haploid gastrula stage; g. Haploid neuroembryo stage; h. Haploid sarcomere stage; i. Haploid control;j. Gynogenetic diploid; k. Normal diploid control
3.2 低温短时间处理是斜带石斑鱼雌核生殖的关键
雌核生殖中另一个关键因素是诱导条件的选择, 本研究得到的斜带石斑鱼人工雌核生殖的诱导条件为: T(冷休克温度), 4—6℃; TA(冷休克开始时间), 6min; D(冷休克持续时间), 20min, 这与牙鲆(Paralichthys olivaceus; T, 0—4℃; TA, 2—5min; D,45—60min)[22], 大菱鲆(Scophthalmus maximus; T,–1—0℃; TA, 6.5min; D, 25min)[23], 漠斑牙鲆(Paralichthys lethostigma; T, 0—2℃; TA, 3—4min; D,45—50min)[24], 大黄鱼(T, 3—4℃; TA, 2min; D,10min)[4], 黄姑鱼(Nibea albiflora; T, 3—4℃; TA,2min; D, 10min)[25], 半滑舌鳎(Cynoglossus semilaevis; T, 5℃, TA, 5min, D, 20—23min)[26]等海水鱼类相比(图8), 处理水温较牙鲆、大菱鲆、漠斑牙鲆高, 而与大黄鱼、黄姑鱼、半滑舌鳎比较接近,这与牙鲆等为冷温性鱼类, 而大黄鱼等为暖温性鱼类的最适生活温度有关。
一般而言, 处理起始时刻是最重要的因素, 对诱导效果的影响最大。本研究中受精后4min得到较高的受精率与诱导率, 但是考虑让受精卵受精过程充分完全, 处理前洗卵所需要的时间, 以及得到更高比例的雌核发育后代群体, 选择6mpf为最适处理起始时刻, 而10mpf后孵化率与诱导率显著下降,这可能是处理时刻较晚导致无法充分抑制第二极体排放所致。斜带石斑鱼雌核生殖启动诱导的时间与欧鲈(Dicentrarchus labrax)受精后的5—6min,以及大菱鲆受精后6.5min较为相近, 不同种鱼类适合处理时刻差别与卵子发育速度、培育水温相关(图9); 持续时间和大菱鲆(25min)、半滑舌鳎(20—23min)较为接近(图8), 与不同鱼类对低温的耐受差异相关。石斑鱼雌核生殖诱导率在处理时间各组中差异很显著, 这反应出其胚胎发育对低温的耐受时间比较敏感相关; 石斑鱼人工诱导雌核生殖条件具有中等低温、短时间处理的特点。

图8 不同海水鱼雌核生殖最佳冷休克温度和时间Fig. 8 Optimal temperature and time of cold shock for gynogenesis of different marine fishes
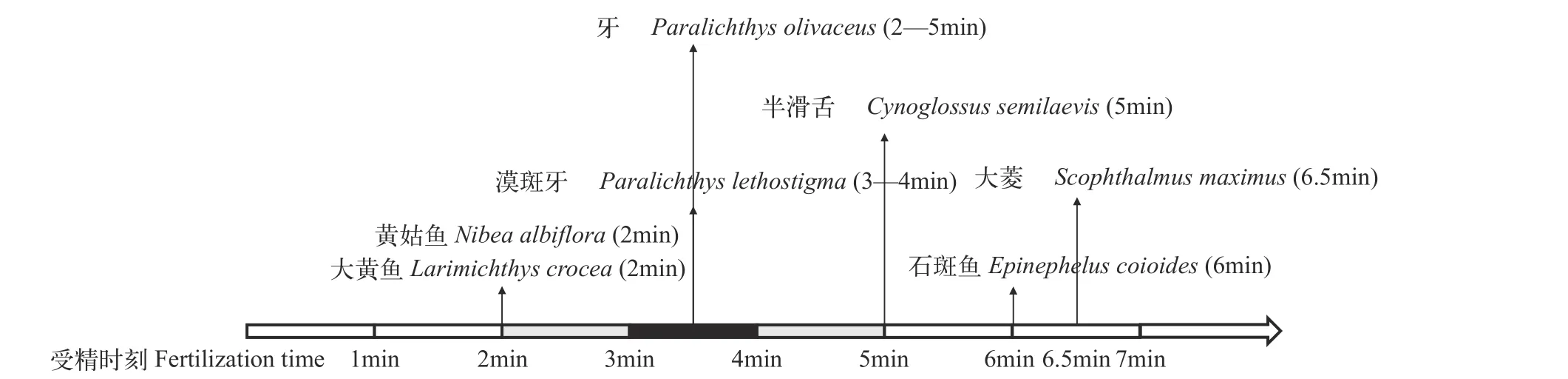
图9 不同海水鱼雌核生殖最佳启动时间Fig. 9 Optimal cold shock start time for gynogenesis of different marine fishes
3.3 斜带石斑鱼雌核生殖后代微卫星鉴定
通常通过染色体核型、子代性状和单倍体效应[27,28], 来鉴定雌核生殖后代, 利用分子标记技术能快速区分雌核生殖子代和杂交子代[29]。为提高人工诱导石斑鱼雌核生殖的成功率, 本研究采用了多组对照条件、倍性鉴定和微卫星标记等手段。单倍体组、雌核诱导组的倍性数据反映出精子灭活的程度; 微卫星鉴定则具有多态性丰富、共显性遗传等优点[30]。本研究雌核生殖样本获得了平均91.7%的诱导率, 可以满足研究和应用的要求。其中6号个体在Mbo061位点上被检测出存在与父本相同的微卫星片段, 这应当是异精效应导致部分鞍带石斑鱼DNA片段整合到雌核生殖后代基因组产生的结果, 这种整合表现可能在子代的生理和代谢方面显现出差异[21], 异精效应也是石斑鱼人工雌核生殖育种关注和利用的重点之一。
人工雌核生殖不仅在提高群体的遗传一致性和性状一致性有着重要作用[31,32], 同时雌核生殖子代基因型的纯合会导致部分个体近交衰退和致死,从而淘汰群体中的劣质基因。本研究在斜带石斑鱼(♀) × 鞍带石斑鱼(♂)受精细胞学基础之上, 确定精子灭活的条件, 成功制备斜带石斑鱼雌核生殖子代, 为斜带石斑鱼及其他石斑鱼遗传育种工作奠定基础。此外, 雌核生殖是研究性别决定机制的重要途径[33]。本文为研究性逆转石斑鱼的性别决定机制, 提供新的思路和材料。
