载阿帕替尼金属有机框架纳米颗粒的制备及其体外抗乳腺癌的作用
2022-11-25庞泓冰周财赋韩创业韩箫何勇飞唐立博农莹丹卢春苗杨子叶罗小玲
庞泓冰 周财赋 韩创业 韩箫 何勇飞 唐立博 农莹丹 卢春苗 杨子叶 罗小玲
作者单位:530021 南宁 1广西医科大学附属肿瘤医院实验研究部;2广西医科大学第一附属医院肝胆外科
乳腺癌是女性常见的恶性肿瘤,也是女性癌症死亡的主要原因。据统计,2020年全球女性乳腺癌发病率为24.5%,死亡率为15.5%[1]。近年来有研究发现针对ER阳性和HER2阳性乳腺癌类型的靶向治疗可减少乳腺癌复发,提高存活率[2]。阿帕替尼作为一种新型口服靶向VEGFR-2细胞内ATP结合位点的小分子酪氨酸激酶抑制剂,能抑制肿瘤血管生成,在多种肿瘤中显示出抗肿瘤作用[3-6]。目前,阿帕替尼在国内已应用于进展期胃癌和肝细胞癌的治疗[7],其在乳腺癌中的应用虽然仍处于临床试验阶段,但是单药阿帕替尼在重度预处理、毒性可控的转移性非三阴性乳腺癌中已表现出了令人鼓舞的疗效[8]。此外,阿帕替尼在乳腺癌体外研究中也展现了良好的应用前景,如通过PI3K/Akt信号通路抑制乳腺癌MCF-7细胞增殖[9],通过ERK/JAK2-STAT3途径抑制三阴性乳腺癌MDA-MB-468细胞荷瘤裸鼠模型的肿瘤生长并促进肿瘤细胞凋亡[10]。然而,临床治疗中患者虽然对阿帕替尼的耐受性良好,但是高剂量且长期使用会导致高血压、蛋白尿和手足口病综合征等药物不良反应,需减少剂量,甚至中断或终止药物治疗[11]。因此,寻找更高效、低毒的新型方法具有重要意义。
近年来,金属有机框架材料纳米颗粒因具有高渗透性和滞留效应能在肿瘤中积累而成为研究热点之一[12]。沸石咪唑酯骨架结构材料(zeolitic imidazolate framework-8,ZIF-8)作为金属有机框架材料纳米颗粒的一个子类,具有热稳定性、化学稳定性[13]和吸附-脱附性能等优势[14]。将药物封装在ZIF-8中可以调整药物在纳米材料内的负载量[15],ZIF-8还能在保护负载药物的前提下于特定肿瘤微环境中崩解释放药物[16],从而最大程度减少用药量和降低药物的毒副作用。阿帕替尼对VEGFR-2具有高选择性亲和力,而乳腺癌4T1细胞具有高转移性和高血管生成的特性[17],因此本研究选择乳腺癌4T1细胞作为研究对象,将阿帕替尼封装入自制的载阿帕替尼的金属有机框架纳米颗粒ZIF-8(apatinib@zeolitic imidazolate framework-8,A@ZIF-8),并探讨其对乳腺癌4T1细胞增殖和凋亡的影响,同时评估其生物安全性,以期为A@ZIF-8应用于乳腺癌治疗提供实验依据。
1 材料和方法
1.1 主要材料和试剂
1.1.1 细胞系 小鼠乳腺癌4T1细胞购自中国科学院上海细胞库。用含有10%胎牛血清和1%青霉素-链霉素混合液的RMPI-1640培养基,于37℃、5% CO2的培养箱中培养,取对数生长期细胞进行后续实验。
1.1.2 实验动物 13只Balb/c雌性小鼠,4~6周龄,体重15~20 g,由广西医科大学动物实验中心提供,饲养于广西医科大学实验动物中心。本实验经实验动物伦理委员会批准。
1.1.3 其他主要试剂 阿帕替尼购自美国MCE公司(批号:12375;纯度:99.57%),六水合硝酸锌[Zn(NO3)2·6H2O]购自西陇科学股份有限公司,二甲基咪唑购自上海阿拉丁生化科技股份有限公司,甲醇购自成都市科隆化学品有限公司,二甲基亚砜(DMSO)购自美国西格玛奥德里奇公司,澳洲胎牛血清及RMPI-1640培养基购自美国Gibco公司,青霉素-链霉素混合液及0.25%胰蛋白酶-EDTA消化液购自以色列Biological Industries生物科技公司,Annexin V-FITC细胞凋亡检测试剂盒购自上海碧云天生物技术有限公司,CCK-8细胞增殖-毒性检测试剂盒购自日本同仁化学研究所,HE染色试剂盒及中性树胶购自北京索莱宝科技有限公司,无水乙醇购自上海泰坦科技股份有限公司,二甲苯购自天津市富宇精细化工有限公司,10%中性福尔马林固定液购自福州飞净生物科技有限公司。
1.2 ZIF-8与A@ZIF-8的制备
1.2.1 ZIF-8 称取0.3 g六水合硝酸锌,用40 mL甲醇溶液溶解后,用涡旋振荡器使其充分溶解(简称A液);另称取0.17 g二甲基咪唑用40 mL甲醇溶解(简称B液)。将A液转移至圆底烧瓶中,在恒温水浴下用磁力转子搅拌1~2 min(150 r/min),随后加入B液,继续搅拌5 min,室温下静置4 h后,以12 000 r/min离心10 min,弃上清液,沉淀物经甲醇、DMSO分别洗涤离心2次后,再用纯水溶解,离心、冷冻干燥,最终所得产物即为金属有机框架纳米颗粒ZIF-8。
1.2.2 A@ZIF-8 称取2.0 mg阿帕替尼,用200µL甲醇溶解制成阿帕替尼溶液。按照上述1.2.1方法配置A液和B液,将A液转至圆底烧瓶中,恒温水浴下磁力搅拌1~2 min(150 r/min),加入B液,磁力搅拌2 min时迅速滴加阿帕替尼溶液,继续搅拌3 min后,按照1.2.1方法静置、洗涤、离心和干燥,即得金属有机框架载药纳米颗粒A@ZIF-8。
1.3 ZIF-8与A@ZIF-8的表征
各称取1 mg ZIF-8和A@ZIF-8,分别用1 mL ddH2O制备成悬液后备用。将铜网放在铺有封口膜的玻璃片上,分别取10 μL ZIF-8和A@ZIF-8悬液滴于铜网上,静置后用滤纸吸去多余液体,待铜网晾干后,用透射电子显微镜(TEM)观察纳米颗粒的形态并拍摄;另分别取ZIF-8和A@ZIF-8悬液,用高分辨场发射扫描电子显微镜(SEM)观察纳米颗粒的形态并拍照,用马尔文激光粒度仪分析纳米颗粒的Zeta电位情况。
1.4 A@ZIF-8的体外抗肿瘤作用
1.4.1 CCK-8法检测A@ZIF-8对4T1细胞增殖的影响 取对数生长期的4T1细胞接种至96孔板(5×103/孔)中,每组设5个复孔,于37℃培养箱中孵育24 h。实验分为对照组、ZIF-8组和A@ZIF-8组。其中,对照组用RMPI-1640完全培养基培养,ZIF-8组和A@ZIF-8组每孔分别加入100µL预先用RMPI-1640完全培养基分别制备的不同浓度(2.5µg/mL、5.0µg/mL、10.0µg/mL、15.0 µg/mL、20.0 µg/mL、30.0 µg/mL、60.0 µg/mL、100.0µg/mL)ZIF-8培养基溶液和A@ZIF-8培养基溶液,于37℃培养箱中孵育24 h后,每孔加入10µL CCK-8试剂,继续孵育2 h,用多功能酶标仪检测450 nm处的光密度(OD)值。细胞存活率(%)=[(实验组OD值-对照组OD值)/对照组OD值]×100%。
1.4.2 流式细胞术检测A@ZIF-8对4T1细胞凋亡的影响 取对数生长期的4T1细胞接种至6孔板(2×105/孔)中,于37℃、5% CO2培养箱中培养24 h。实验分为对照组、ZIF-8组和A@ZIF-8组,其中对照组用无血清RMPI-1640培养基培养,A@ZIF-8组用无血清RMPI-1640培养基制备浓度为IC50的A@ZIF-8培养基溶液培养,ZIF-8组用无血清RMPI-1640培养基制备浓度与A@ZIF-8相同的ZIF-8培养基溶液培养。各组加入相应培养基后,继续孵育2 h;然后收集各组细胞,1 000 g离心5 min,吸除上清液,加入195µL Annexin V-FITC结合液重悬细胞后,加入5µL Annexin V-FITC、10µL碘化丙啶染色液混匀,室温下避光孵育15 min,用流式细胞仪检测细胞凋亡率。
1.5 A@ZIF-8的生物安全性评价
从13只Balb/c雌性小鼠中随机选取1只小鼠用于溶血试验,其余12只小鼠用于体内生物安全性检测。
1.5.1 溶血试验检测A@ZIF-8的血液相容性 小鼠称重后用含1%的戊巴比妥钠生理盐水溶液进行腹腔注射麻醉,采用摘眼球取血法收集约2 mL新鲜全血,加入PBS重悬,3 500 r/min离心5 min后弃上清液,重复操作3次;再次向沉淀中加入20 mL PBS重悬红细胞,即得红细胞悬液。实验分为对照组和不同浓度A@ZIF-8组,每组设立3个复孔。对照组用800µL PBS+200µL红细胞悬液处理,A@ZIF-8组用800µL PBS+不同浓度(25µg/mL、50µg/mL、100µg/mL、150µg/mL、250µg/mL、500µg/mL)A@ZIF-8溶液+200µL红细胞悬液处理。各组溶液均于37℃水浴箱中孵育4 h后,3 500 r/min离心5 min,取上清液,用多功能酶标仪检测540 nm处的OD值。
1.5.2 血常规及血液生化分析A@ZIF-8的体内安全性 12只小鼠随机分为对照组(n=6)和A@ZIF-8组(n=6)。其中,A@ZIF-8组在尾静脉注射200µL用生理盐水溶解的浓度为IC50的A@ZIF-8纳米颗粒溶液,每隔2 d注射1次,共注射3次;对照组在尾静脉注射等体积的生理盐水。于首次注射14 d后,称重小鼠并用含1%的戊巴比妥钠生理盐水溶液(80 mg/kg)进行腹腔注射麻醉,收集血液并上机检测获得红细胞计数(RBC)、白细胞计数(WBC)、血小板计数(PLT)、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)等数据。
1.5.3 HE染色检测A@ZIF-8对重要器官的影响 采血后脱颈处死小鼠,取出心、肝、脾、肺、肾器官,用0.9%生理盐水冲洗,10%中性福尔马林固定,常规脱水、透明、浸蜡、包埋并切成2~4µm厚度的薄片,二甲苯脱蜡2次,再用梯度无水乙醇脱水,苏木素染液染色5 min,酒精伊红染色液染色5 min,滴上中性树胶,盖上盖玻片封固后,于显微镜下观察细胞形态特征并拍照。
1.6 统计学方法
所有数据均经Excel处理,采用 SPSS 25.0和GraphPad Prism 8.0软件对数据进行分析。计量资料以均数±标准差表示,两组均数比较采用独立样本t检验,多组均数比较采用单因素方差分析,若组间差异有统计学意义,采用Bonferroni检验进行多重比较。以双侧P<0.05为差异具有统计学意义。
2 结果
2.1 ZIF-8和A@ZIF-8的形态特征及Zeta电位情况
TEM观察结果显示,ZIF-8和A@ZIF-8形态相似,均表现为颗粒大小均一,分散性较好,呈多面体球形,但A@ZIF-8直径较ZIF-8明显增加[(206.63±21.83)nm vs(151.23± 14.10)nm,P<0.001],见 图1A~B。SEM观察结果显示,ZIF-8和A@ZIF-8形态相似,均呈十二面立方体状,但A@ZIF-8粒径较ZIF-8明显增加[(235.32±27.82)nm vs(115.04±10.32)nm,P<0.001],见图1C~D。马尔文激光粒度仪检测纳米颗粒的电位值,结果显示,ZIF-8封装药物阿帕替尼后的Zeta电位明显高于ZIF-8[(28.87±0.40)mV vs(18.90±0.95)mV,P<0.001]。以上结果表明,阿帕替尼成功封装入ZIF-8,即A@ZIF-8制备成功。

图1 ZIF-8和A@ZIF-8的形态特征Fig.1 Morphological characteristics of ZIF-8 and A@ZIF-8
2.2 A@ZIF-8对乳腺癌4T1细胞增殖和凋亡的影响
CCK-8法检测结果显示,与对照组比较,ZIF-8浓度小于60.0µg/mL时4T1细胞的增殖能力变化不明显(均P>0.05),当浓度到达100.0µg/mL时其对4T1细胞的增殖抑制作用显著增强(P<0.001);A@ZIF-8浓度小于30.0µg/mL时,4T1细胞的增殖能力与对照组比较差异无统计学意义(均P>0.05);从30.0µg/mL浓度开始,4T1细胞的增殖能力随着A@ZIF-8浓度增加而逐渐下降(均P<0.001),IC50值为27.69µg/mL。见图2。
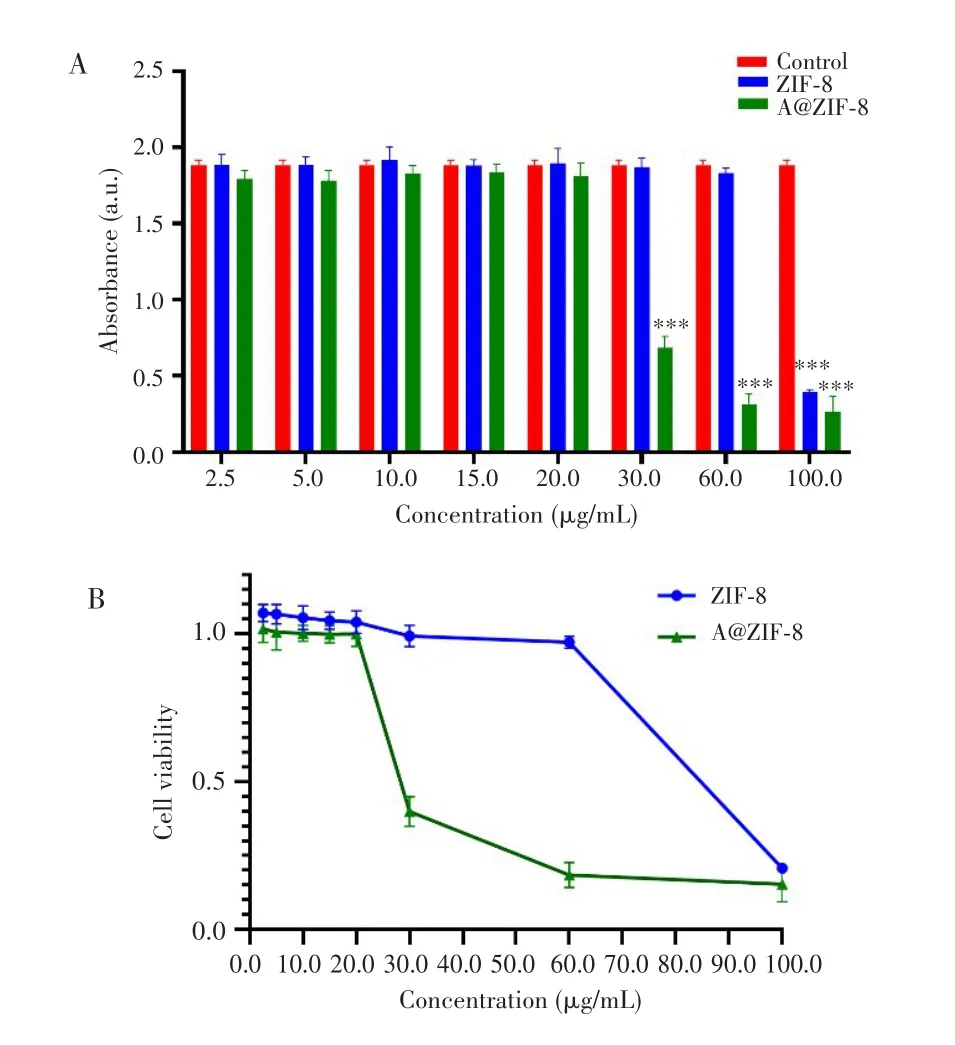
图2 不同浓度A@ZIF-8对乳腺癌4T1细胞增殖的影响Fig.2 Effects of different concentrations of A@ZIF-8 on the proliferation of breast cancer 4T1 cells
流式细胞术检测结果显示,27.69 μg/mL ZIF-8处理后4T1细胞凋亡率与对照组比较差异无统计学意义(P>0.05),但27.69 μg/mL A@ZIF-8处理后4T1细胞凋亡率较对照组明显升高(P<0.001),见图3。
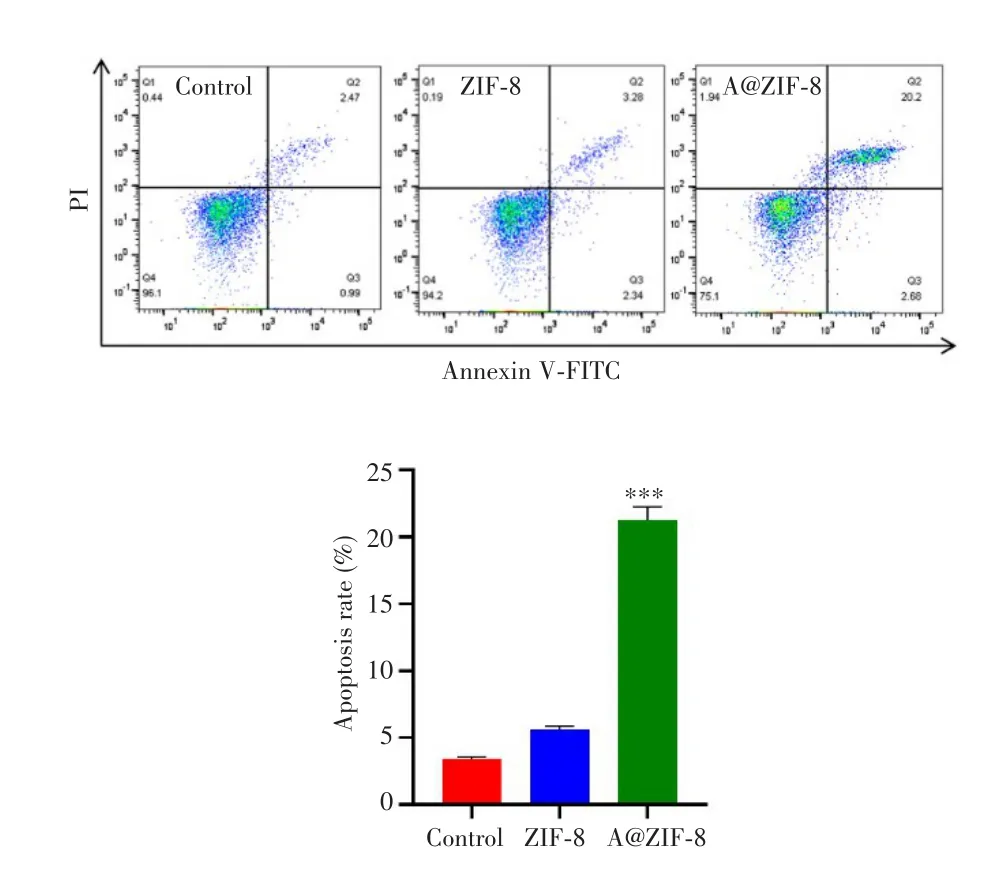
图3 A@ZIF-8对乳腺癌4T1细胞凋亡的影响Fig.3 Effects of A@ZIF-8 on the apoptosis of breast cancer 4T1 cells
2.3 A@ZIF-8的血液相容性
溶血试验结果显示,对照组及各浓度A@ZIF-8组小鼠红细胞悬液离心后,管中上清液均清澈透明,未出现明显溶血现象,见图4;各浓度A@ZIF-8组小鼠的OD值与对照组比较差异均无统计学意义(均P>0.05),表明A@ZIF-8在小鼠体内未破坏血红细胞膜,不易发生溶血。

图4 不同浓度A@ZIF-8作用后小鼠红细胞悬液的溶血情况Fig.4 Hemolysis of mouse erythrocyte suspension treated with different concentrations of A@ZIF-8
2.4 A@ZIF-8的体内安全性
对照组及A@ZIF-8组小鼠处理14 d后,饮食、活动、毛色均无明显变化,未发生疾病或死亡。实验室检查结果显示,A@ZIF-8组小鼠的WBC、RBC、PLT、ALT、AST等指标均在正常值范围,见表1。HE染色结果显示,A@ZIF-8组小鼠心、肝、脾、肺、肾等均未发现细胞损伤,细胞结构清晰,细胞核形态正常,见图5。以上结果表明,A@ZIF-8具有较好的体内安全性。

表1 A@ZIF-8对小鼠RBC、WBC、PLT、ALT、AST的影响Tab.1 Effects of A@ZIF-8 on RBC,WBC,PLT,ALT,AST in mice

图5 A@ZIF-8处理14 d后小鼠重要器官的HE染色结果(×400)Fig.5 HE staining results of vital organs of Balb/c female mice on day 14 after injection of A@ZIF-8 solution(×400)
3 讨论
近年来,纳米医学的快速发展为癌症治疗开辟了新的领域,也为提高抗癌治疗效果和降低毒副作用带来了巨大希望,特别是载药纳米的使用为准确诊断和有效治疗肿瘤提供了更多的可能性[18]。与其他纳米颗粒相比,ZIF-8具有特殊的化学和热稳定性[13],且在酸性(pH 5.0~6.0)条件下容易分解[19]。既往研究显示,肿瘤微环境pH值一般为5.5~6.0,而ZIF-8因咪唑的质子化,载药后能够在酸性条件下降解并释放药物,可作为天然pH响应性靶向药物载体[20],这意味着载药的ZIF-8可以在特定肿瘤微环境中崩解释放药物,最大程度减少用药量和降低药物的毒副作用。已有不少研究证实ZIF-8的作用,如ZHUANG等[21]发现ZIF-8在乳腺癌MCF-7细胞中表现出较小的细胞毒性;CHENG等[22]制备了装载阿霉素(DOX)和四氧化三铁(Fe3O4)的纳米颗粒DOX@Fe3O4-ZIF-8作为肝癌细胞靶向药物传递系统,发现该载体有较高的载药能力且具有良好的药物缓释性能,且其对肿瘤细胞的杀伤作用较游离DOX强。YU等[23]将姜黄素载入ZIF-8中构建载药纳米颗粒并证明该载药纳米颗粒对小鼠乳腺癌4T1细胞有增殖抑制作用,能引起更多的细胞周期阻滞和诱导细胞凋亡。阿帕替尼作为VEGFR-2的一种小分子抑制剂,在乳腺癌的临床试验阶段已表现出良好的抗癌效果[8]。为了观察载阿帕替尼ZIF-8的抗乳腺癌作用,本研究首先将阿帕替尼装载入ZIF-8构建载药纳米颗粒A@ZIF-8,结果发现ZIF-8载入阿帕替尼后颗粒形态与未载药形态相同,但粒径和Zeta电位明显增加,表明A@ZIF-8制备成功。然后,进一步在乳腺癌4T1细胞中观察A@ZIF-8对细胞增殖和凋亡的影响,结果发现经不同浓度A@ZIF-8处理后4T1细胞的增殖能力均受到抑制,且从30.0µg/mL开始,抑制作用明显增强,这与A@ZIF-8的IC50为27.69µg/mL相符。后续用27.69µg/mL A@ZIF-8处理4T1细胞,发现细胞凋亡率亦明显升高,说明A@ZIF-8能抑制4T1细胞增殖并诱导细胞凋亡,在乳腺癌治疗中具有应用前景。
溶血试验和重要器官的毒性实验是评价纳米材料安全性的重要方法[24]。为进一步评价A@ZIF-8的安全性,本研究同时构建小鼠模型,并检测A@ZIF-8作用于小鼠后体外溶血、相关血液生化指标及重要器官等的变化情况,结果发现A@ZIF-8不易破坏血红细胞膜,也未发生溶血,且注射A@ZIF-8溶液后小鼠血常规、肝功能、肾功能等指标均在正常范围内,重要器官HE染色在镜下亦未发现细胞结构损伤,表明A@ZIF-8具有良好的生物安全性。关于ZIF-8药物装载量和释放率,既往研究已证实ZIF-8药物装载量良好,且在酸性条件下的释放效果更佳[25-27]。但本研究尚未计算阿帕替尼在ZIF-8中的载药量和释放率,后续将继续完善关于A@ZIF-8的载药和释放实验,以提供更直观和全面的数据。
综上所述,本研究构建的载药纳米颗粒A@ZIF-8能够抑制4T1细胞增殖并诱导其凋亡,且具有良好的生物安全性。该结果拓展了乳腺癌治疗的思路,同时有助于推动载药纳米给药系统向临床转化的发展。
