复方中草药制剂对天府麻鸭生长、免疫及肠道微生物区系的影响
2022-11-24海思娆陈佳雯贺卫华冯士彬王希春
海思娆,陈佳雯,马 立,汪 洋,王 正,金 鑫,吴 倩,贺卫华,冯士彬,王希春*
复方中草药制剂对天府麻鸭生长、免疫及肠道微生物区系的影响
海思娆1,陈佳雯1,马 立1,汪 洋1,王 正1,金 鑫1,吴 倩1,贺卫华2,冯士彬1,王希春1*
(1.安徽农业大学动物科技学院,合肥 230036;2.江苏农牧科技职业学院,泰州 225300)
为了研究复方中药制剂对天府麻鸭的生长性能、免疫机能、抗氧化能力和肠道微生物区系的影响,选取120只1日龄天府麻鸭随机分成4组,每组5个重复,每个重复6只,预饲7 d。试验Ⅰ组为对照组,饲喂基础饲粮,在对照组基础上分别加入0.5%(Ⅱ组)、1%(Ⅲ组)和1.5%(Ⅳ组)的复方中药制剂,试验期20 d。各试验组分别于0 、10 和20 d取样,分别测定天府麻鸭的生长性能、免疫性能力、血清氧化与抗氧化指数及其肠道菌群的变化。结果表明,与对照组相比,Ⅲ、Ⅳ组的平均体增重和平均日增重极显著增加(< 0.01),料重比极显著降低(< 0.01),各组间平均日采食量差异不显著(> 0.05);Ⅲ、Ⅳ组胸腺指数,Ⅳ组脾脏指数,Ⅲ组C3含量,Ⅱ组IgA浓度和Ⅳ组IFN-γ浓度均有改善(< 0.05),Ⅳ组C3、C4含量,Ⅲ、Ⅳ组IgA、IgM含量,Ⅳ组IgG含量和Ⅲ、Ⅳ组IL-4含量极显著增加(< 0.01);试验Ⅲ组SOD活性与Ⅳ组T-AOC活性均明显增加(< 0.05),Ⅲ、Ⅳ组GSH-Px活性极显著升高(< 0.01),Ⅲ组MDA含量显著降低(< 0.05),Ⅳ组MDA含量极显著降低(< 0.01);Ⅱ组盲肠内细菌丰富度下降(< 0.05),Ⅲ、Ⅳ组微生物多样性极显著降低(< 0.01),其中包括了变形菌门、厚壁菌门和放线菌门的相对丰度逐渐下降,拟杆菌门的相对丰度上升,拟杆菌属、丁醋丝膜菌属和巴恩斯氏菌属的相对丰度逐渐上升,另枝菌属和嗜胆菌属的相对丰度则逐渐减少。试验表明,复方中草药制剂能够促进天府麻鸭的生长,提高免疫机能和抗氧化性能,并改善肠道菌群结构。
天府麻鸭;复方中草药制剂;生长性能;免疫功能;抗氧化性能;肠道菌群
农业农村部已发出194号通知,从2020年7月1日开始,全国饲料产品中将全面禁止添加抗生素[1]。如今畜禽养殖业发展主流是绿色无抗养殖,在此环境背景下,养殖业中控制兽药残留的呼吁声音渐响,而中草药制剂与抗生素相比,是一种成本低、副作用小、疾病预防效果更好,并且逐渐有取代抗生素趋势的新型绿色饲料添加剂[2]。复方中草药制剂是指在中医的理论基础上,以充足的中草药资源为原料,用一定的工艺加工制成的一类饲料添加剂[3]。复方中草药制剂也是一类能够提高畜禽生长性能、增强动物自身免疫力、改善肠道内环境的新型饲料添加剂[4]。复方中草药制剂,因为具有原料的纯天然性和对畜禽毒副作用较少,不易形成耐药性以及在动物身上的残留药品量极少等优点,已显现出了很大的应用发展潜力,并受到世界的广泛关注[5]。因此,复方中草药制剂在畜禽动物饲养业上有着广阔的前景。已有研究表明,饲料中添加适量由黄芪、黄连等组成的中草药制剂能够降低淋巴细胞凋亡率,增强动物机体免疫力[6]。研究发现,党参等中药在机体免疫应答的过程中发挥了重要的调控作用,是调节机体免疫功能的重要因素,可显著提高抗病性[7]。中草药制剂在养殖业中的运用还不成熟。由于中草药来源不同且缺乏毒性及安全研究,也没有一致的质量标准和配方标准等问题,且同种中草药制剂对不同种类动物的作用效果也不一致,因此对中草药制剂作出确切的效果评价和质量检测是有一定难度的。本试验拟在天府麻鸭基础饲粮中添加复方中草药制剂(党参、黄芪、大青叶和板蓝根等),探究该复方中草药制剂对天府麻鸭生长性能、免疫功能和肠道菌群的影响,以期为复方中草药制剂在肉鸭健康养殖领域的应用提供参考。
1 材料与方法
1.1 试验材料与仪器
1日龄健康且体重相近的天府麻鸭120只,购于合肥市明航养殖有限公司;党参、黄芪、大青叶和板蓝根等13味中草药饮片,购于合肥市国缘大药房,研磨粉碎后按比例混合制备成复方中草药制剂。主药为党参、黄芪、大青叶和板蓝根,辅药为甘草、茯苓、白术、女贞子、苦参、当归、白芍、山楂和麦芽;鸭IgA、IgG、IgM检测试剂盒、鸭C3、C4补体检测试剂盒、鸭IL-2、IL-4、IL-6检测试剂盒、鸭IFN-γ检测试剂盒、鸭SIgA检测试剂盒、鸭T-AOC检测试剂盒、鸭SOD检测试剂盒、鸭GSH-Px检测试剂盒、鸭MDA检测试剂盒,购于上海晶抗生物工程有限公司;细菌基因组提取试剂盒,购于美国Illumina公司;Infinite M200 PRO 酶标仪,购于澳大利亚帝肯TECAN公司;LEGEND MICRO 21R 台式高速冷冻离心机,购于美国Thermo仪器设备有限公司;NovaSeq6000测序平台,购于美国Illumina公司。
1.2 方法
1.2.1 试验动物的分组与管理 采取厚垫料地面平养的饲养方式,试验前对场地进行全面消毒,在场地内安装保温灯,注意通风、湿度和自然光照,为天府麻鸭提供适宜的生存条件。把120只天府麻鸭随机分成4个处理组,每组30只,每次在处理组内设置5个重复,每个重复6只天府麻鸭。在试验前预饲喂7 d,试验期后为20 d。试验Ⅰ组为对照组,均饲喂基础日粮,但试验中Ⅱ、Ⅲ、Ⅳ组分别加入了0.5%、1.0%和1.5%的复方中药制剂,具体分组情况如表1所示。
每组放置两个料桶和两个饮水壶,每天饲喂两次,自由采食饮水,4组的基础饲料相同,基础饲料由淮南远大饲料有限责任公司提供,其基本成分和营养水平如表2所示,符合肉鸭饲料标准。

表1 试验分组

表2 基础日粮组成及营养水平
* 预混料可为平均每千克饲料提供了以下的饮食: VA 8 000 IU,VD 3 000 IU,VE 25 IU,VK 4 mg,VB 12.5 mg,Fe 30 mg,Cu 10 mg,I 0.4 mg,Se 0.30 mg,抗氧化剂 100 mg。代谢能为计算值, 其余为实测值。
1.2.2 样品的采集 在试验组第0、第10和第20 天,从每个试验组中抽取5个重复,在每个重复里选择一只空腹的天府麻鸭,在颈静脉处采样血液,在常温下静置1 h后以3 000 r·min-1的速度离心10 min,再把分离出来的新鲜血清收集在离心管中,做好标记后将其放入–20 ℃冰箱保存。
于试验第20 天,每个试验组分别抽取5个重复,每个重复抽取1只空腹的天府麻鸭,用电子秤称完活体重量后剖杀,立即取下鸭腹腔内胸腺、脾脏和法氏囊称重。取3 cm左右的十二指肠、空肠和回肠,用生理盐水冲洗干净后再用玻璃片刮下肠道黏膜收集于冻存管中并做好标记。采集2 mL盲肠内容物于冻存管中并做好标记。先于液氮中保存采集到的样品,后转到–80℃冰箱里存放。
1.2.3 生长性能指标的测定 在试验第0、第10和第20 天上午对每组空腹的天府麻鸭进行称重并记录。对每天每个试验组的给料量、余料量和死淘只数进行记录,计算试验第0 天的平均体重以及试验0~10 d、10~20 d的平均日增重、平均日采食量和料重比。
1.2.4 免疫器官指数的测定 胸腺指数(g·kg-1)=胸腺重量(g)/鸭空腹活体重量(kg)
脾脏指数(g·kg-1)=脾脏重量(g)/鸭空腹活体重量(kg)
法氏囊指数(g·kg-1)=法氏囊重量(g)/鸭空腹活体重量(kg)
1.2.5 血清免疫指标的测定 采用酶联免疫吸附法(ELISA)试剂盒检测天府麻鸭血清中免疫球蛋白A(IgA)、免疫球蛋白G(IgG)、免疫球蛋白M(IgM)、补体C3、C4、白介素2(IL-2)、白介素4(IL-4)、白介素6(IL-6)以及γ干扰素(IFN-γ)的含量。
1.2.6 肠道黏膜免疫指标的测定 采用酶联免疫吸附法(ELISA)试剂盒检测天府麻鸭十二指肠、空肠和回肠这3段肠道的肠道黏膜中分泌型免疫球蛋A(SIgA)、白介素2(IL-2)、γ干扰素(IFN-γ)的含量。
1.2.7 血清氧化及抗氧化指标的测定 使用酶联免疫吸附法(ELISA)试剂盒检测天府麻鸭血清中总抗氧化能力(T-AOC)活性、超氧化物歧化酶(SOD)活性以及谷胱甘肽过氧化物酶(GSH-Px)活性和丙二醛(MDA)含量。
1.2.8 肠道高通量测序 基因组DNA采用CTAB方法提取,稀释后作为模板,PCR扩增和测序16SrRNA基因的V3-V4高变区。对PCR产物进行混样和纯化,由北京诺禾致源公司完成文库构建和上机测序。对有用物种数据进行OTUs聚类,采用Wilcoxon rank-sum Test进行不同组间Alpha多样性比较。
1.2.9 数据处理 对试验数据处理先通过使用Excel软件进行初步的数据汇总与试验统计数据分析,然后通过使用SPSS Statistics 26软件对已统计好的各项试验数值处理进行统计分析,结果以“平均数±标准差(Mean±SD)”表示。
2 结果与分析
2.1 天府麻鸭生长性能指标
由表3可知,第0 天时4组之间平均体重的差异不显著(> 0.05)。第10 天时,试验Ⅱ组、试验Ⅲ组之间的平均体重有增加的趋势,试验Ⅳ组平均体重与试验Ⅰ组相比极显著增长(< 0.01)。第20 天时,试验Ⅲ组和试验Ⅳ组平均体重与试验Ⅰ组相比极显著上升(< 0.01)。在0~10 d,和对照组相比,试验Ⅱ、Ⅲ、Ⅳ组的平均日采食量和平均日增重差异不显著(> 0.05);试验Ⅱ、Ⅲ组料重比与对照组相比无显著差异(> 0.05),试验Ⅳ组料重比极显著高于对照组(<0.01)。在10~20 d,4组间平均日采食量无显著差异(> 0.05);试验Ⅲ、Ⅳ组平均日增重极显著增加(< 0.01);试验Ⅲ组和试验Ⅳ组料重比相比对照组极显著降低(< 0.01)。

表3 复方中草药制剂对天府麻鸭生长性能指标的影响
注:同一行比较,上标字母相同或不标者表示差异不显著(>0.05),小写字母不同者表示差异显著(<0.05),大写字母不同者表示差异极显著(<0.01)。下同。
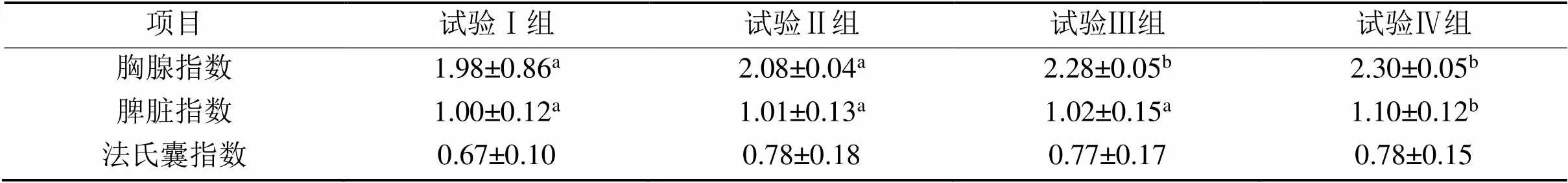
表4 复方中草药制剂对天府麻鸭免疫器官指数的影响
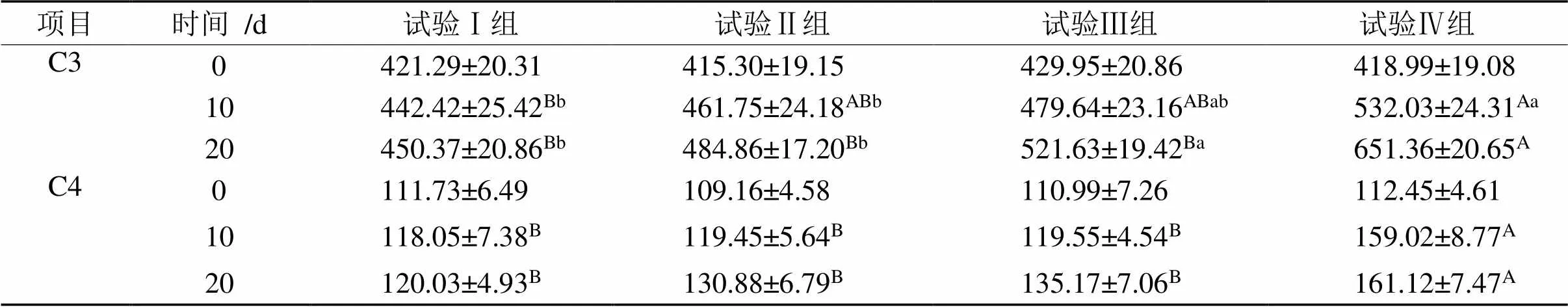
表5 复方中草药制剂对天府麻鸭血清中补体C3、C4含量的影响

表6 复方中草药制剂对天府麻鸭血清中免疫球蛋白含量的影响
2.2 天府麻鸭免疫器官指数
由表4可知,试验Ⅲ、Ⅳ组的胸腺指数与对照组相比显著升高(< 0.05);试验Ⅳ组的脾脏指数与对照组相比显著升高(< 0.05);4个试验处理组的法氏囊指数差异不显著(> 0.05)。
2.3 天府麻鸭血清免疫指标
2.3.1 补体C3、C4含量 由表5可知,在第0 天,4组间C3、C4含量差异不显著(>0.05)。在第10 天,试验Ⅱ、Ⅲ和Ⅳ组C3、C4含量与对照组相比有升高趋势,其中试验Ⅳ组C3、C4含量极显著升高(< 0.01)。在第20 天,试验Ⅲ组的C3含量显著升高 (< 0.05),试验Ⅳ组的C3极显著升高(< 0.01),试验Ⅳ组的C4含量极显著升高(< 0.01)。
2.3.2 免疫球蛋白含量 由表6可知,在试验第0 天,4组间IgA、IgG和IgM含量差异不显著(> 0.05)。在试验第10 天,试验Ⅲ、Ⅳ组的IgA含量极显著升高(< 0.01),试验Ⅳ组的IgG含量显著升高(< 0.05),试验Ⅲ、Ⅳ组的IgM含量极显著升高(< 0.01)。在试验第20 天,与对照组相比,试验Ⅱ组的IgA含量显著升高(< 0.05),试验Ⅲ、Ⅳ组IgA、IgM含量和试验Ⅳ组的IgG含量都极显著升高(< 0.01)。
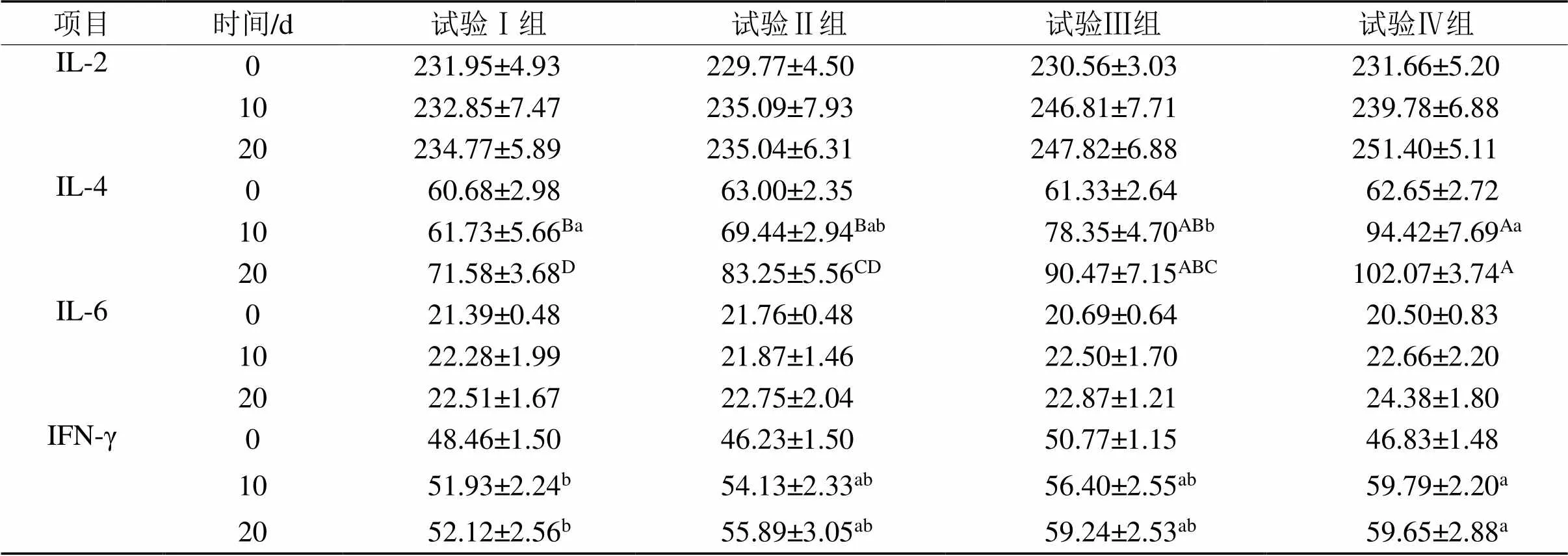
表7 复方中草药制剂对天府麻鸭血清中细胞因子含量的影响
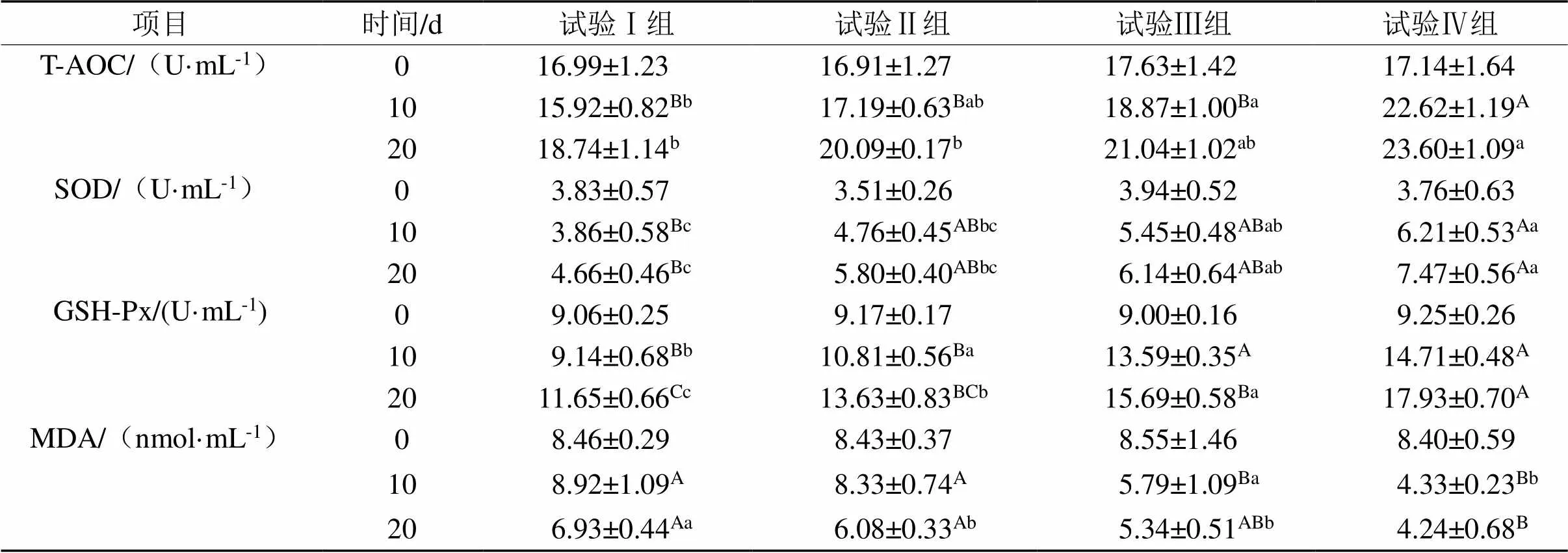
表8 复方中草药制剂对天府麻鸭血清氧化及抗氧化指标的影响
2.3.3 细胞因子含量 由表7可知,在第0 天,4组间IL-2、IL-4、IL-6和IFN-γ含量无显著性差异(> 0.05)。在第10天,与对照组相比,IL-2、IL-6呈现上升的趋势,试验Ⅲ组IL-4含量显著增长 (<0.05),试验Ⅳ组IL-4含量极显著增长(<0.01),试验Ⅳ组IFN-γ含量显著增长(<0.05)。在第20 天,与对照组相比,IL-2、IL-6呈现上升的趋势,试验Ⅲ、Ⅳ组IL-4含量极显著增长(<0.01),试验Ⅳ组IFN-γ含量显著增长(<0.05)。
2.4 天府麻鸭血清氧化及抗氧化指标
由表8可知,在第0 天,4组间T-AOC活性、SOD活性、GSH-Px活性和MDA含量差异不显著(>0.05)。在第10 天,试验Ⅲ组T-AOC、SOD活性显著升高(0.05),试验Ⅳ组T-AOC、SOD活性极显著升高(0.01),试验Ⅲ、Ⅳ组GSH-Px活性极显著升高(0.01),试验Ⅳ组MDA含量极显著降低(0.01)。在第20 天,试验Ⅳ组T-AOC活性显著升高(0.05),试验Ⅲ组SOD活性显著升高(0.05),试验Ⅳ组SOD活性极显著升高 (0.01),试验Ⅲ、Ⅳ组GSH-Px活性极显著升高(0.01),试验Ⅲ组MDA含量显著降低(0.05),试验Ⅳ组MDA含量极显著减少(0.01)。

图1 稀释曲线
Figure 1 Dilution curve
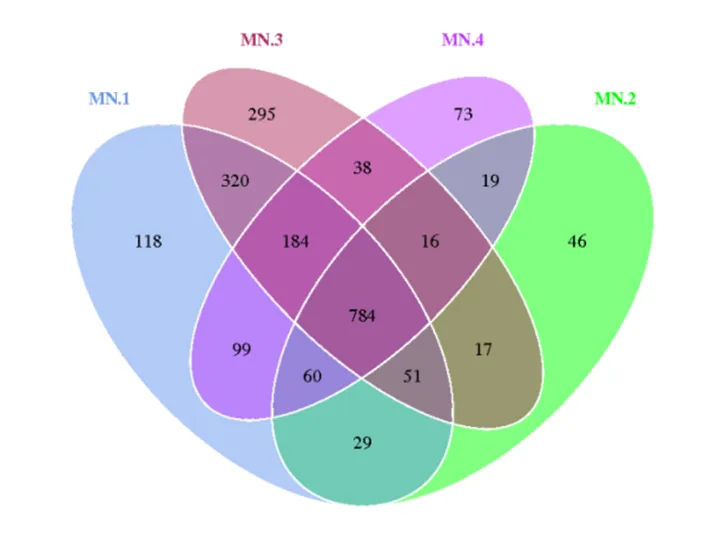
图2 OTU venn图
Figure 2 OTU venn diagram
2.5 天府麻鸭盲肠微生物区系检测
2.5.1 高通量测序数据 稀释曲线是任意从样本中抽选出一定测序量的数据,计算它们所代表的物种数目(即OTUs数目),用根据提取的测序数据和相应物种数形成的曲线。稀释曲线可以对测序数据的合理性直接体现,对样品中物种的丰富度间接表明,当曲线趋近平缓时,说明测序数据量逐渐合理化,更多的数据只代表出现少量的新物种(OTUs)。由图1可知,observed species指数的稀释曲线均趋向平坦,说明测序数量充足。图2表明,测序数据一共检测2 149个OTUs,其中试验Ⅰ组、试验Ⅱ组、试验Ⅲ组和试验Ⅳ组各有1 645、1 022、1 705和1 273个OTUs,共有784个OTUs是共有的。
2.5.2 天府麻鸭盲肠菌群组成 天府麻鸭盲肠肠道菌群在门水平上共鉴定出19个门,图3展示了丰度最高10个菌门,其中厚壁菌门()、拟杆菌门()的丰度较高,这些微生物占据了盲肠微生物的 91.89%以上,是天府麻鸭肠道内的优势菌群。天府麻鸭盲肠肠道菌群在属水平上共鉴定出235个属,图4展示了相对丰度最高 10个菌属,相对丰度在前五位的菌属为拟杆菌属()、丁醋球菌属()、巴恩斯氏菌属()、另枝菌属()、副杆菌属(),相对丰度分别为 21.70%、8.70%、8.00%、6.60%和 5.00%。

图3 门分类水平上各样品菌群物种分类
Figure 3 Species classification of each sample flora at phylum level

图4 属分类水平上各样品菌群物种分类
Figure 4 Species classification of each sample flora at the genus level
2.5.3 Alpha多样性分析 Alpha多样性分析是对单个样品中的物种进行的多样性分析。微生物群落的物种丰富度可以由Observed species指数、chao1指数和ACE指数表明,指数与样品中物种丰富度呈正相关。微生物群落中物种的多样性可由Shannon指数反映,指数与群落中物种多样性呈正相关。由表9可知,试验Ⅰ组的微生物群落丰富度显著高于试验Ⅱ组(<0.05),试验Ⅰ组的微生物群落多样性极显著高于试验Ⅱ组和试验Ⅳ组(<0.01)。
2.5.4 在门水平上的物种丰度差异 各试验组天府麻鸭盲肠菌群共鉴定出19个门,其中拟杆菌门()、厚壁菌门()、放线菌门()和变形菌门()的丰度较高,占据了盲肠微生物的98%以上。由表10可知,试验Ⅱ、Ⅲ和Ⅳ组变形菌门、厚壁菌门、放线菌门的相对丰度相比对照组降低,拟杆菌门呈现上涨趋势,其中试验Ⅱ、Ⅳ组变形菌门丰度显著降低(<0.05),试验Ⅱ组厚壁菌门的丰度显著降低(<0.05),试验Ⅲ组放线菌门的丰度极显著降低(<0.01),试验Ⅳ组拟杆菌门的丰度显著升高(<0.05)。

表9 Alpha多样性分析

表10 门水平盲肠菌群丰度比较
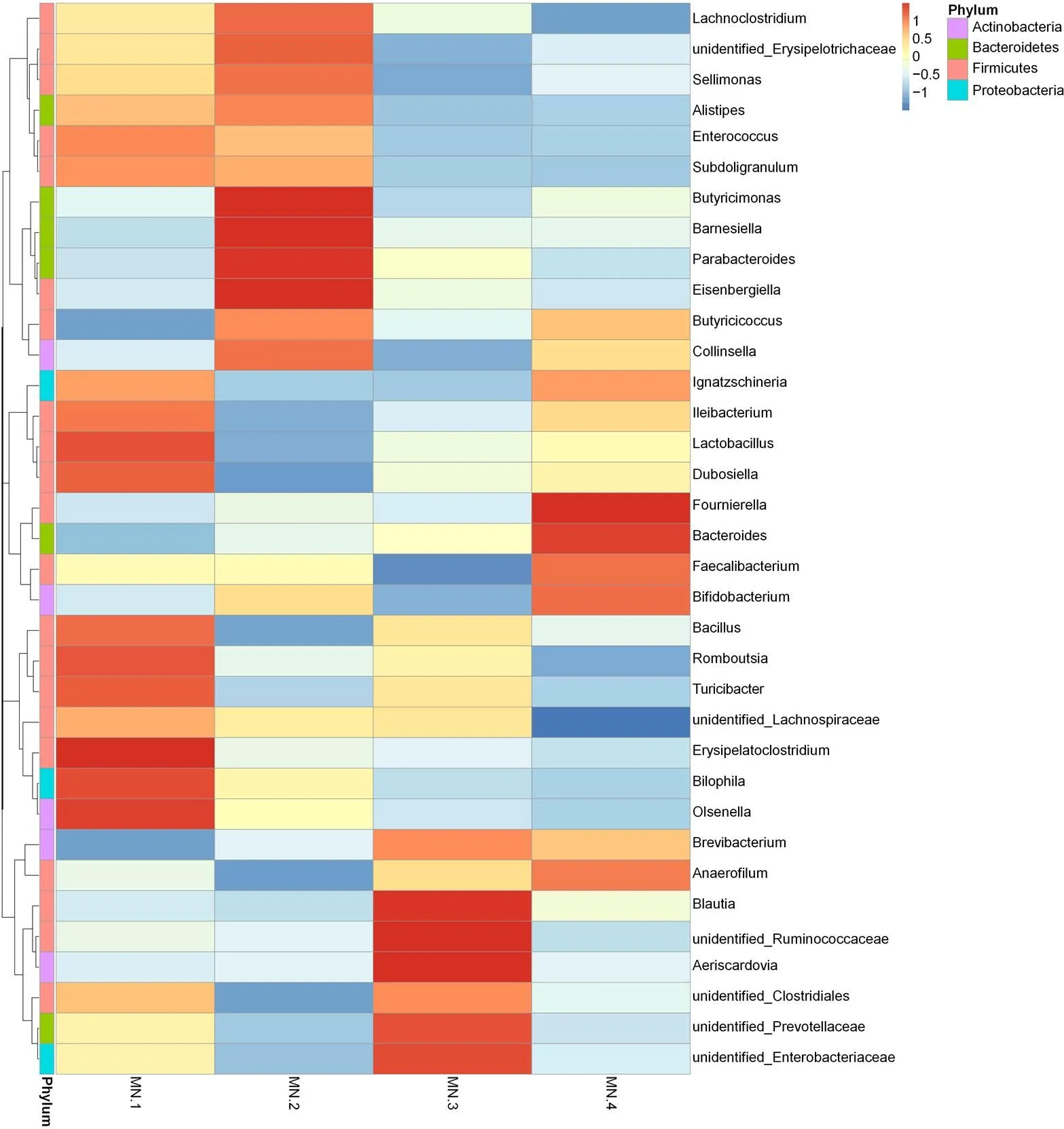
图5 属水平物种组成统计热图
Figure 5 Heatmap of intestinal microflora at the genus level
2.5.5 在属水平上的物种丰度差 为了进一步研究复方中草药制剂对天府麻鸭盲肠肠道菌群多样性的影响,本试验更深入的研究了盲肠菌群在属分类水平上的组成与变化情况。在属分类水平上,经过样本的筛选及序列比对共得到235个菌属,共有35个菌属的相对丰度超过 0.01%,这35个菌属在4组天府麻鸭盲肠菌群中分别占 74.91%、84.12%、73.55%和79.88%。拟杆菌属()是4组天府麻鸭肠道菌群中丰度最高的菌属,随着添加剂量的增加,复方中草药制剂组拟杆菌属的丰度从18.69%上升至32.81%。丁醋球菌属()是4组天府麻鸭盲肠菌群中丰度第二的菌属,添加复方中草药制剂后,试验Ⅱ、Ⅲ、Ⅳ组天府麻鸭盲肠菌群丁醋球菌属相对丰度分别上升至 10.48%、7.93%和 9.92%。巴恩斯氏菌属()是天府麻鸭盲肠菌群中丰度第3的菌属,复方中草药制剂组的巴恩斯氏菌属丰度相对于对照组均上升。随着复方中草药制剂剂量的增加,另枝菌属()、嗜胆菌属()的相对丰度逐渐降低(图5)。
3 讨论与结论
大多动物生长所必需的营养物质在中草药里存在,如蛋白质、糖类、维生素、脂肪以及微量元素等。截至目前已经有相当多的研究证实了中草药制剂对生长性能具有改善和提升的作用,所以说,复方中草药饲料制剂是非常具有潜力的非抗生素生长促进剂[8]。在饲料中添加复方中草药制剂中不仅可以促进动物机体的消化还可以丰富饲粮中的营养成分,从而可以加强动物自身的营养,对畜禽的生长有促进作用[9]。本试验日粮中加入复方中草药制剂后显著提高了天府麻鸭的平均体重及日均增重,并降低了料重比,这与刘砚涵等[10]研究结果相似。
胸腺、脾脏和法氏囊是家禽非常重要的免疫器官,可通过这些器官的指数判断家禽的免疫功能好坏。有研究证明,免疫器官重量影响免疫功能[11]。彭彦淳等[12]研究发现,在肉鸡饲料中添加灵芝液体发酵物可显著提高肉鸡的胸腺指数和脾脏指数,对法氏囊指数无明显影响。在本试验中,复方中草药制剂可以提升天府麻鸭的胸腺指数、脾脏指数,试验结果与前人的研究大体相一致,但这4组的法氏囊指数无显著差异,可能是因为法氏囊随着天府麻鸭的长大在逐步退化,以致于作用表现不显著。补体是存在于血清且具有酶活性的一类球蛋白,它还是免疫功能的一种非特异性辅助要素,不但可以协助抗体溶解细胞和杀灭病菌,而且还有调节免疫反应的作用[13]。补体C3和补体C4在血清中的占比要高于其他补体分子的含量,并且它们在补体系统的多种功能中有着无可取代的作用地位,在动物免疫功能中有着重要的生物学意义。姜卫星等[14]试验结果表明,育肥猪血清中补体C3、C4的含量会随着在猪饲粮中添加中草药制剂量的增多而增长。张健等[15]试验结果说明饲料中添加复方中草药可使云南武定雏鸡血清中补体C3、C4含量显著增高。本试验表明,复方中草药制剂有明显提升天府麻鸭血清中补体C3以及C4含量的趋势,且以添加1.5%复方中草药制剂效果最佳。
免疫球蛋白是指可以特异性结合并识别入侵病原体,介导补体激活和免疫调节,并在抵御病原体入侵,增强动物免疫力,激活补体,中和毒素和杀灭肿瘤细胞等多方面表现作用的一类球蛋白,是反映畜禽机体免疫情况的关键指标,主要包含IgA、IgG和IgM[16]。林秋敏等[17]试验结果显示饲料中添加复方中草药在一定程度上可提高血清中IgM、IgG含量。武洪志等[18]试验结果表明添加发酵复方中草药的仔猪血清中IgA、IgG和IgM水平显著增加。本试验结果表明,复方中草药制剂组天府麻鸭血清中IgA、IgG、IgM含量均表现增长的趋势,且含量随着复方中草药制剂剂量的增加而上升,此现象的原因可能是复方中草药制剂中含有大量的氨基酸物质,为效应B淋巴细胞创造更好的条件,使其产生免疫球蛋白,推动抗体的形成,从而使动物机体的免疫力增强。
细胞因子是活化的细胞所合成分泌的一类小分子蛋白质,其功能主要是调节和改善免疫表达过程。Katayama等[19]研究表明,在猪饲粮中添加海藻和甘草,能提升猪血清中细胞因子IL-2的含量,从而改善猪的免疫性能。王娅等[20]研究表明,在断奶仔猪基础饲料中添加复方中药制剂能提升仔猪血清中IL-2、IL-6和IFN-γ的分泌量。在本试验中,复方中草药制剂组天府麻鸭血清中IL-4和IFN-γ的含量和对照组相比有了明显提升。随着饲喂复方中草药制剂时间的延长,复方中草药制剂组天府麻鸭血清中IL-2和IL-6含量上升趋势愈加明显,但和对照组间无显著性差异,这可能有两方面原因,其一可能是试验周期短暂,所以复方中草药制剂组天府麻鸭血清中IL-2和IL-6含量和对照组相比暂时不表现出显著性差异;其二,如果天府麻鸭血清中IL-2和IL-6的含量过高,可能代表着机体内有炎症,所以IL-2和IL-6含量表现出增长的趋势,但数值不会过高。
T-AOC、SOD和GSH-Px是动物体内非常关键的抗氧化酶,这3个抗氧化酶的协同作用可以很大程度地消除动物机体内活性氧的产生,让细胞能维持正常的生物活性,从而保证动物机体抗氧化系统的平衡,降低外界因素对动物机体的损害。动物机体内MDA的含量可以间接反映出过氧化损伤的强度,畜禽体内MDA水平越高则表示对畜禽机体细胞的损伤越大。吕慧源等[21]发现,在肉鸡的日粮中添加复方中草药制剂能使肉鸡血清中CAT含量升高并伴随着MDA浓度降低,从而提高肉鸡机体的抗氧化性能。Bai等[22]发现在日粮中添加1%的复方中草药制剂可升高猪血清中GSH-Px活性并降低MDA含量,使应激猪应激时的抗氧化能力得到提高。在本试验中,随着饲喂复方中草药制剂时间的延长,复方中草药制剂组T-AOC、SOD以及GSH-Px活性均上升且MDA含量也表现下降的趋势,此结果与上述观点基本相同。
鸭子的健康、疾病和生产力与其胃肠道微生物区系密切相关[23]。事实上,胃肠道被大量细菌物种定居,这些细菌已被证明在饲料消化、免疫调节、病原体排除和内分泌活动中发挥关键作用[24]。家禽中胃肠道微生物群的紊乱将导致家禽对病原体和传染病的易感性增加,这可能给养殖户造成严重损失,并可能导致家禽产品受到食源性病原体的污染[25]。在本试验中,复方中草药制剂组的微生物群落多样性要低于对照组,临床实践证明很多中草药具有杀菌的作用,所以可能是复方中草药制剂发挥了杀菌作用从而降低了微生物群落多样性。在门的分类水平上,复方中草药制剂组和对照组相比,拟杆菌门的比例表现为升高的趋势,厚壁菌门、放线菌门和变形菌门的比例表现为降低的趋势。动物体内酵解碳水化合物主要由拟杆菌门进行,部分放线菌门会引起动植物危害,动物体重的调节与肠道内的细菌有关,特别是厚壁菌门以及变形菌门中包含许多细菌种类,其中包括霍乱弧菌、大肠杆菌、幽门螺杆菌等较多常见的致病菌[26]。在属的分类水平上,复方中草药制剂组和对照组相比,嗜胆菌属、另枝菌属的比例下降,拟杆菌属的比例上升。因此,复方中草药制剂对有害菌群的生长繁殖有抑制作用,对盲肠内有益菌群数量有促进增加趋势,从而改善天府麻鸭的肠道菌群结构。
复方中草药制剂可以提高天府麻鸭的生长性能、免疫性能、抗氧化能力,添加1.5%剂量的复方中草药制剂效果最为显著。复方中草药制剂还可以抑制天府麻鸭肠道内有害菌群的生长繁殖并促进有益菌群的增长,从而对天府麻鸭肠道菌群起到积极的调节作用。
[1] 高铎, 孙鹏. 中草药添加剂在畜禽养殖中的应用潜力及挑战[J]. 家畜生态学报, 2021, 42(4): 7-12.
[2] 韩战强, 杨继远. 中草药复方制剂在规模化养猪生产中的应用[J]. 畜牧与兽医, 2019, 51(12): 130-134.
[3] 李云鑫, 熊春霞, 黄云, 等. 中草药饲料添加剂在鸡养殖生产上的应用[J]. 畜禽业, 2020, 31(4): 8-12, 14.
[4] 靳二辉, 陈耀星, 周金星, 等. 黄芪、枸杞、金银花等中草药复方制剂对肉鸡免疫器官发育及免疫功能的影响[J]. 畜牧兽医学报, 2017, 48(6): 1128-1139.
[5] 刘银兰, 李国勤, 卢立志. 功能性饲料在动物生产中的应用研究进展与展望[J]. 饲料工业, 2020, 41(6): 11-13.
[6] 胡永灵, 叶世莉, 罗佳捷. 中草药制剂对热应激奶牛泌乳性能、抗氧化能力及免疫功能的影响[J]. 草业学报, 2015, 24(1): 132-140.
[7] 孙雨豪, 邓在双, 熊宪献, 等. 中草药复方制剂对IBDV感染青脚麻鸡脾脏结构和功能的影响[J]. 安徽农业大学学报, 2020, 47(6): 906-915.
[8] LIU H W, TONG J M, ZHOU D W. Utilization of Chinese herbal feed additives in animal production[J]. Agric Sci China, 2011, 10(8): 1262-1272.
[9] 李美发, 陈作栋, 梁欢, 等. 添加复方中草药对育肥猪生长性能、营养物质表观消化率和血液指标的影响[J]. 中国畜牧兽医, 2019, 46(6): 1636-1643.
[10] 刘砚涵, 宫晓玮, 李复煌, 等. 中草药饲料添加剂对北京鸭生长性能、免疫指标及肉品质的影响[J]. 中国农业大学学报, 2020, 25(2): 77-84.
[11] 李任军, 王海梅, 倪兴维, 等. 中药对鸡免疫调节作用的研究进展[J]. 国外畜牧学(猪与禽), 2020, 40(9): 59-61.
[12] 彭彦淳, 范思远, 李晓慧, 等. 灵芝液体发酵物对肉鸡生产性能、免疫功能和抗氧化性能的影响[J]. 黑龙江畜牧兽医, 2021(2): 107-112.
[13] 邓亦宁, 张云科, 王朋朋, 等. 金黄色葡萄球菌SSL7蛋白对补体系统的作用分析[J]. 中国农业大学学报, 2021, 26(9): 146-153.
[14] 姜卫星, 袁文军, 李伟, 等. 中草药添加剂对育肥猪生长性能和免疫功能的影响[J]. 中国畜牧兽医, 2011, 38(5): 15-19.
[15] 张健, 杨亮宇, 白文顺. 复方中草药添加剂对云南武定雏鸡生长性能及免疫功能的影响[J]. 黑龙江畜牧兽医, 2015(5): 79-81.
[16] 李天丽. 复方中草药超微粉对断奶仔猪生长性能及免疫指标的影响[J]. 黑龙江畜牧兽医, 2018(12): 26-28.
[17] 林秋敏, 赖宝色, 林伯全, 等. 复方中草药对仔猪免疫功能的效果影响[J]. 黑龙江畜牧兽医, 2015(24): 144-146.
[18] 武洪志, 宋玉卓, 王志龙, 等. 发酵复方中草药对断奶仔猪生长性能、免疫和生化指标的影响[J]. 东北农业大学学报, 2017, 48(8): 15-24.
[19] KATAYAMA M, FUKUDA T, OKAMURA T, et al. Effect of dietary addition of seaweed and licorice on the immune performance of pigs[J]. Anim Sci J, 2011, 82(2): 274-281.
[20] 王娅, 邓俊良, 左之才, 等. 复方中药“猪康散”对断奶仔猪血清中细胞因子水平的影响[J]. 中国兽医学报, 2014, 34(2): 302-306.
[21] 吕慧源, 李漠, 王志明, 等. 山银花和黄芩提取物对肉鸡生长性能、免疫器官发育及抗氧化机能的影响[J]. 中国畜牧杂志, 2021, 57(1): 175-179.
[22] BAI X M, YAN X, XIE L Q, et al. Effects of pre-slaughter stressor and feeding preventative Chinese medicinal herbs on glycolysis and oxidative stability in pigs[J]. Anim Sci J, 2016, 87(8): 1028-1033.
[23] DAI S J, ZHANG K Y, DING X M, et al. Effect of dietary non-phytate phosphorus levels on the diversity and structure of cecal microbiota in meat duck from 1 to 21 d of age[J]. Poult Sci, 2018, 97(7): 2441-2450.
[24] LI M, ZHOU H L, PAN X Y, et al. Cassava foliage affects the microbial diversity of Chinese indigenous geese Caecum using 16S rRNA sequencing[J]. Sci Rep, 2017, 7: 45697.
[25] CORRIGAN A, DE LEEUW M, PENAUD-FRÉZET S, et al. Phylogenetic and functional alterations in bacterial community compositions in broiler ceca as a result of mannan oligosaccharide supplementation[J]. Appl Environ Microbiol, 2015, 81(10): 3460-3470.
[26] 于佳楠, 王晶, 陈贝妮, 等. 复方中草药添加剂对芦花鸡生长性能及肠道菌群结构的影响[J]. 中国兽医学报, 2020, 40(9): 1832-1835.
Effects of compound Chinese herbal medicine preparation on growth, immunity and intestinal microflora of Tianfu sheldrake
HAI Sirao1, CHEN Jiawen1, MA Li1, WANG Yang1, WANG Zheng1, JIN Xin1, WU Qian1, HE Weihua2, FENG Shibin1, WANG Xichun1
(1. School of Animal Science and Technology, Anhui Agricultural University, Hefei 230036;2. Jiangsu Agri-animal Husbandry Vocational College, Taizhou 225300)
In order to explore the effects of compound Chinese herbal medicine preparation on the growth performance, immune function, antioxidant capacity and intestinal microflora of Tianfu sheldrake,120 one-day-old Tianfu sheldrakes were randomly divided into 4 groups with 5 replicates in each group and 6 sheldrakes in each replicate, and preliminary fed for 7 days. Sheldrakes in the control group (group Ⅰ) were fed with a basal diet, and 0.5% (group Ⅱ), 1.0% (group Ⅲ) and 1.5% (group Ⅳ) of compound Chinese herbal medicine preparation were added to the basal diet.The trial was conducted for 20 days. The samples in the experimental groups were collected at 0,10 and 20 days, and the growth performance, immune capacity, serum oxidation, antioxidant indexes and intestinal microflora of Tianfu sheldrake were determined, respectively. The results indicated that compared with the control group, average weight gain(AWG) and average daily gain(ADG) in Ⅲ and Ⅳ groups were significantly increased (< 0.01), while the ratio of feed to gain(F/G) was significantly decreased (<0.01), but there was no significant difference in average daily feed intake (ADFI) among the experimental groups (> 0.05). The thymus index of sheldrakes of group Ⅲ and Ⅳ, spleen index of group Ⅳ, C3 content in group Ⅲ, IgA content in group Ⅱ and IFN-γ content in group Ⅳ were improved (<0.05), the C3 and C4 contents in group Ⅳ, IgA and IgM contents in group Ⅲ and Ⅳ, IgG content in group IV, and IL-4 contents in groups Ⅲ and IV were significantly increased (<0.01); the SOD activity in group Ⅲ and T-AOC activity in group IV were increased (< 0.05), the GSH-Px activities in group Ⅲ and IV were significantly increased (<0.01); the MDA content in group Ⅲ was decreased (< 0.05), and MDA content in group IV was significantly decreased (< 0.01). The bacterial richness in cecum of group Ⅱ was decreased (<0.05), and the microbial diversity of groups Ⅲ and IV significantly was significantly decreased (< 0.01), including the relative abundance of,andwere gradually decreased, while the relative abundance ofwere increased, and the relative abundance of,andwere gradually increased. The relative abundance ofanddecreased gradually. The experiment results showed that compound Chinese herbal medicine preparations can enhance the growth performance of Tianfu sheldrake, increase the immune functionand antioxidant level, and improve the structure of intestinal microbiota.
Tianfu sheldrake; compound Chinese herbal medicine preparation; growth performance; immune function; antioxidant activity; intestinal microbiota
S834.83
A
1672-352X (2022)05-0755-09
10.13610/j.cnki.1672-352x.20221111.011
2022-11-14 9:27:27
[URL] https://kns.cnki.net/kcms/detail/34.1162.S.20221111.1112.022.html
2021-09-05
国家重点研发计划项目(2016YFD0501205)资助。
海思娆,硕士研究生。E-mail:1326290429@qq.com
王希春,博士,教授。E-mail:wangxichun@ahau.edu.cn
