特基拉芽孢杆菌液态发酵制备菜籽多肽的工艺研究
2022-11-24钟晓霞刘志云周晓容黄金秀
钟晓霞, 刘志云,2, 周晓容,2, 黄金秀,2
(重庆市畜牧科学院1,重庆 402460) (农业部养猪科学重点实验室2,重庆 402460)
菜籽粕是油菜籽榨油之后的副产物,其粗蛋白质量分数可达35%~45%,富含矿物质元素、维生素和氨基酸,是一种优质的植物蛋白资源[1]。但菜籽在热榨或溶剂提取制油过程中,菜籽蛋白严重变性,导致消化吸收率低[2],制约了菜籽粕的深度利用,造成蛋白资源的浪费。研究表明,菜籽蛋白经蛋白酶作用,可得到许多分子链长度不等的、易溶解、易吸收的低分子小肽混合物[3],且具有抗氧化[4]、提高免疫力[5]、降血压[6]、抗肿瘤[7]等功能活性。近年来,研究人员发现通过微生物发酵菜籽蛋白可获得功能性菜籽多肽,而且与酶水解法制备相比,可以节省大量昂贵的酶制剂,降低生产成本[8],已成为菜籽粕高值化利用的新途径之一。何荣海等[9]以枯草芽孢杆菌液态发酵菜籽粕得到具有抗氧化活性的菜籽肽,金晶[10]以枯草芽孢杆菌液态发酵菜籽粕得到具有ACE抑制活性的菜籽肽。
本研究实验室从土壤中分离筛选到一株产碱性蛋白酶和中性蛋白酶的特基拉芽孢杆菌(Bacillustequilensis),能够在菜粕平板上良好生长,具有分解菜籽蛋白的潜力。影响菜粕发酵获得菜籽肽的因素包括发酵基质的pH值、料水比、KH2PO4添加量、葡萄糖添加量[11];发酵的温度、时间、菌种接种量、转速等[9]。由于菌株的特异性,不同菌株发挥作用所需条件不尽相同[12]。因此本研究拟以筛选到的特基拉芽孢杆菌为发酵菌株,以多肽得率为筛选条件,采用单因素和正交分析法对发酵基质的组成和发酵工艺进行优化,获得最佳发酵基质组成和发酵工艺,提高菜籽多肽得率。以期为菜籽粕的深度利用提供参考。
1 材料与方法
1.1 材料
原料与试剂:菜籽粕,粗蛋白质量分数36.89%,含水量7.54%;2,2-二苯甲基苦味酰基苯肼基(DPPH)、2,4,6-三吡啶基三嗪(TPTZ)、2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ATBS),分析纯;Gly-Gly-Tyr-Arg,色谱纯。
营养琼脂培养基:牛肉膏3 g,蛋白胨10 g,NaCl 5 g,蒸馏水1 000 mL,琼脂20 g,pH 7.2,121 ℃灭菌20 min,不加琼脂作液体培养基使用。
1.2 实验方法
1.2.1 特基拉芽孢杆菌液态发酵制备菜籽多肽的工艺优化
初始发酵基质:准确称取2 g过60目菜籽饼(发酵底物),加入30 mL蒸馏水,121 ℃高温高压21 min。冷却至室温,备用。发酵条件为0.25 mL/g发酵底物的接种量,37 ℃,150 r/min发酵36 h。
1.2.1.1 发酵基质的优化
通过单因素实验考察发酵料水比(1∶10、1∶15、1∶20、1∶25),KH2PO4添加量(0、1、3,5、7、9 mg/mL),葡萄糖添加量(0、1、3、5、7、9 mg/mL),发酵初始pH(4、5、6、7、8、9、10)对菜籽多肽得率的影响,考察某一单因素时,其他发酵条件不变。
1.2.1.2 发酵条件的优化
在发酵基质优化的基础上,通过单因素实验考察转速(120、150、180、210、240 r/min),接种量(0.05、0.15、0.25、0.35、0.45 mL/g发酵底物),发酵温度(33、35、37、39、41 ℃),发酵时间(12、24、36、48、60 h)对多肽得率的影响,考察某一单因素时,其他发酵条件不变。选取各因素的最优实验范围,采用正交分析法进行优化。
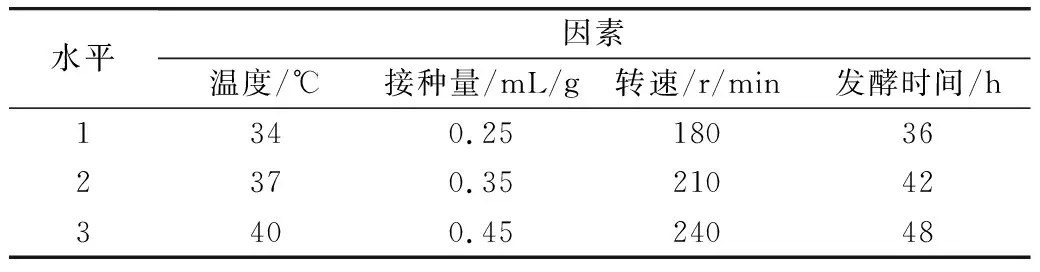
表1 L9(43)正交实验设计
1.2.2 最优条件下发酵制备菜籽肽
在最优的发酵条件下开展验证试验,以未接种菌液在相同条件下发酵的样品作为对照组,每组设置4个重复。发酵结束后检测多肽得率、发酵上清液的氨基酸含量和体外氧化活性。
1.2.3 发酵液处理
将培养好的发酵产物取出,2~4 ℃条件下8 000 r/min离心10 min,上清液定容至50 mL,用0.45 μm微孔滤膜过滤上清液,除去不溶物和细菌,备用。
1.2.4 多肽得率的测定
根据所报道的文献[13],配置试剂。多肽标准曲线的建立:将Gly-Gly-Tyr-Arg用5% TCA分别配制成0、0.312 5、0.625、1.25、2.5和5 mg/mL浓度的标准溶液,取0.9 mL不同稀释梯度的溶液置于5 mL离心管中,加入双缩脲试剂3.6 mL,混匀,静置10 min,2 000 r/min离心10 min,于波长540 nm处测定OD值。在0~5 mg/mL的浓度范围内,多肽的标准曲线为Y=19.042x+0.021 9(x为吸光值,Y为多肽浓度,mg/mL),R2=0.999 9,线性关系良好。
取0.75 mL定容后的发酵液,加入0.75 mL 10%的三氯乙酸水溶液,旋涡混匀,静置30 min,然后在10 000 r/min离心10 min。将上清液全部转移到10 mL比色管中,用5%三氯乙酸定容至10 mL,摇匀,取0.9 mL上述溶液置于5 mL离心管中,加入双缩脲试剂3.6 mL,混匀,静置10 min,2 000 r/min离心10 min,取上清液于540 nm下检测OD值。
多肽得率=(待测液中肽含量×发酵液定容体积)/发酵底物总质量×100%
1.2.5 菜籽多肽体外抗氧化活性研究1.2.5.1 DPPH清除率的测定
根据所报道的文献[14, 15],用无水乙醇将DPPH配制成0.12 mmol/L的溶液,并避光保存。将待测样品配制成不同梯度浓度的溶液;分别与DPPH溶液按1∶1的比例混合均匀,放置于常温下避光反应30 min。最后,反应结束后在 517 nm下检测样品的吸光值。实验中同时还需要设置空白组和对照组,每组设置3个平行。
DPPH清除率=(1-(AS-AC)/A0)×100%
式中:As表示样品组(样品和DPPH)吸光值;Ac表示对照组(样品和无水乙醇)吸光值;A0表示空白组(DPPH和样品溶解液)吸光值。
1.2.5.2 ABTS 自由基清除活性测定
根据所报道的文献[16, 17],室温下,在黑暗环境中用2.45 mmol/L的K2S2O8水溶液与7.0 mmol/L的 ABTS水溶液反应12~16 h产生ABTS自由基溶液。使用前,用pH 7.4的0.2 mol/L PBS 缓冲液稀释 ABTS母液,使其在波长734 nm处的吸光值为 0.7±0.02。移取50 μL不同浓度的稀释样品与150 μL ABTS 溶液于96孔酶标板上混匀,室温下避光反应6 min后,于波长734 nm处测定吸光值
ABTS自由基清除率=[1-(A1-A3)/(A2-A4)]×100%
式中:A1表示样品组(样品和ATBS);A2表示控制组(超纯水);A3表示样品空白组(样品+PBS溶液);A4为空白组(超纯水+PBS)。
1.2.5.3 铁还原抗氧化能力(FRAP)测定
根据所报道的文献[18],配置FRAP检测试剂,标准曲线建立:将1 mL不同浓度的FeSO4溶液加入到10 mL比色管中,加入5.0 mL FRAP 工作液,37 ℃下避光反应20 min,在593 nm处测定反应混合物的吸光度。在0~1 mmol/L的浓度范围内FeSO4还原力标曲回归方程为:Y=3.549 1x+0.007(x为FeSO4浓度,mmol/L;Y为吸光度),R2=0.999 9,线性关系良好。
样品测定:按照建立标准曲线的方法进行测定。结果表示:基于标准曲线的0~1 mmol/L的浓度范围内,以1 mmol/L的FeSO4为标准,计算FRAR值。
1.2.5.4 还原力测定
根据所报道的文献配制试剂[19],在5 mL离心管中依次加入0.2 mL不同浓度的稀释样品,在依次加入1 mL 0.2 mol/L PBS磷酸缓冲液(pH 6.6)和1 mL 1%铁氰化钾,迅速混匀,50 ℃水浴中反应20 min,冷却并加1 mL 10% 三氯乙酸(TCA),混匀后以3 000 r/min离心10 min。取2.5 mL上清液,加0.5 mL 0.1%三氯化铁,混匀,测定各样品在700 nm波长处的吸光度。用蒸馏水作为无还原能力对照。
1.2.6 数据处理
用GraphPad Prism 8作图,SPSS 20.0软件处理数据,以平均数±标准差(Mean±SD)表示,用T-检验比较分析法进行显著性检验(P<0.05)。
2 结果与分析
2.1 特基拉芽孢杆菌发酵制备菜籽多肽的优化
2.1.1 发酵基质的优化
对发酵基质的料液比、pH值、KH2PO4添加量、葡萄糖添加量进行优化,由图1所示,随着料液比的提高,多肽得率也随之显著提高,在料液比为1∶25时多肽得率较高;随着发酵基质pH的提高,发酵上清液多肽得率先升高后略微降低,在pH 8时多肽得率较高;随着KH2PO4添加量的提高,多肽得率持续降低,对菜籽多肽得率起到反向作用,故发酵基质中不添加KH2PO4;随着葡萄糖的添加量的提高,多肽得率先下降后提高,但相较于不添加,多肽得率提高不显著,考虑生产成本等问题,故在发酵基质中不添加葡萄糖。
最终以料水比为1∶25,初始pH为8,不添加KH2PO4缓冲盐和葡萄糖的发酵基质进行发酵条件的优化。

图1 发酵基质对菜籽多肽得率的影响
2.2.2 发酵条件的优化2.2.2.1 发酵条件单因素优化
在优化发酵基质的基础上,对菜籽粕的发酵条件进行优化,由图2所示,随着接种量的增加,多肽得率先增加后降低,接种量为0.35 mL/g发酵底物时,多肽得率最高;随着温度的增加,多肽得率先增加后降低,发酵温度为37 ℃时,多肽得率最高;随着转速的增加,多肽得率增加,转速为240 r/min时,多肽得率较高;随着发酵时间的增加,多肽得率增加,发酵时间为48 h时,多肽得率较高。
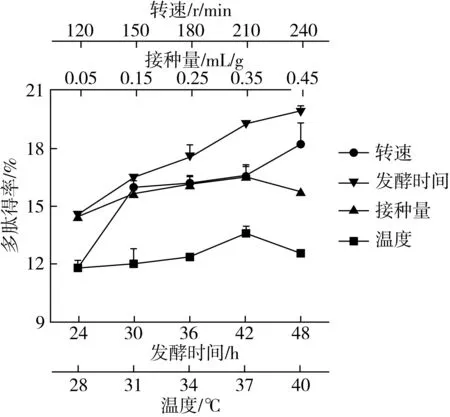
图2 发酵条件对菜籽多肽得率的影响
2.2.2.2 发酵条件的正交优化
由表2可知,最佳发酵条件0.35 mL/g的接种量、37 ℃、240 r/min,发酵42 h。各因素对多肽得率的影响时间>温度>转速>接种量。

表2 发酵条件正交优化结果
2.2.3 最优条件下发酵制备菜籽肽
在最优发酵条件下进行4组平行实验,对照组的多肽得率分别为2.9%、2.1%、2.1%、2.15%,平均值为2.3%;菜籽多肽得率分别为21.00%、22.15%、20.75%、21.5%,平均值为21.4%,较对照组提高了9.3倍。由表3可知,发酵上清液中氨基酸含量较对照组显著提高9.55倍,必需氨基酸提高13.68倍,非必需氨基酸提高8.13倍,其中异亮氨酸、赖氨酸和组氨酸分别提高了18.24、20.46、30.98倍。

表3 发酵产物氨基酸含量/mg/100 mL
由图3可知,在同一稀释浓度下,发酵后上清液DPPH自由基和ATBS自由基清除活性、铁总抗氧化能力、还原力均显著高于对照组(P<0.05)。在试验浓度范围,随着菜籽多肽浓度的增大,其抗氧化活性显著增强,且具有一定的量效关系,经计算,菜籽多肽的50% DPPH自由基清除率为0.053 mg/mL,50% ATBS自由基清除率为0.087 mg/mL,发酵上清液稀释20倍后的铁总抗氧化活性为FRAR值为0.25±0.01。
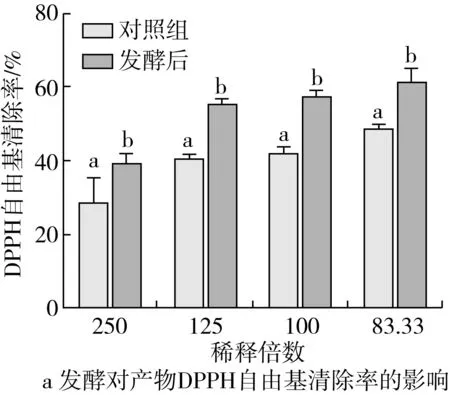
图3 发酵对产物抗氧化活性的影响
3 讨论
3.1 发酵基质对菜籽多肽得率的影响
发酵基质的料水比、KH2PO4添加量、葡萄糖添加量、初始pH均能对菜籽多肽得率产生影响。料水比决定发酵培养基中的菜籽粕添加量和含水量,在本试验中随着料水比的提高,菜籽多肽得率也随之提高,这与金晶[10]的研究结果相似。合理的料水比一方面有助于菌体吸收培养基的营养物质和氧传递,另一方面有利于微生物代谢产物阻遏削减,促进新陈代谢,从而促进菌体的生长繁殖[20]。
KH2PO4作为微生物培养基中常用的无机盐之一,可以提供微生物生长所需的矿物元素,缓冲发酵基质pH的快速变化,但浓度过高也会抑制菌种的生长和产酶[11]。在本实验中,添加KH2PO4降低了菜籽多肽得率,可能是因为KH2PO4本身呈弱酸性,对于发酵产物中的乙酸等酸性代谢物的积累未起到缓解作用,从而抑制了菌株生长。发酵基质初始pH值影响菌种对环境的适应速度、生长繁殖速度、细胞内酶的活性以及蛋白质的积累[21]。在本实验中发酵基质呈弱碱性时菜籽多肽得率较高,适宜菌株和代谢产物的生成。
葡萄糖作为易于吸收的碳源,可以在菌种发酵初期提供大量碳源,维持其生长势头,从而产生大量的蛋白水解酶。在本实验中随着葡萄糖添加量的增加先降低后提高,可能是菜籽粕自身的碳源也能满足菌株的前期生长,再加入过多的葡萄糖一方面会加速菌体呼吸,使培养基中的溶氧不能满足菌体的需要,另一方面加速了一些酸性中间代谢物如乳酸、丙酮酸、乙酸等的累积,导致培养基pH值降低,从而抑制细菌的生长和水解酶类的合成。
3.2 发酵条件对菜籽多肽得率的影响
接种量的大小会直接影响发酵周期和产物的累积速度,在本实验中随着接种量的增加,多肽得率先增加后减少。随着接种量的提高,可以缩短菌株的延滞期,加快酶的积累;但接种量过大,细菌繁殖迅速,培养液粘度增加,溶氧不足,细胞自溶加快,反而不利于产物合成[22]。温度影响微生物生长及产酶,过高或过低都不利于发酵过程[23]。本实验中,多肽得率的变化与酶促反应的动力学结果相似,即随着温度的升高,反应速度加快,导致细菌的生长繁殖加快;但随着温度的上升,酶失活的速度也越大[24]。
在摇瓶中进行优化时,转速直接影响到培养基中的溶氧量,本试验中随着转速的提高,多肽得率随之提高。可能是较高的转速,提高了培养基中的溶氧量和菌体与营养物质的充分接触,有利于细菌快速繁殖增长及代谢产物的合成[25]。发酵时间影响微生物的生长和酶的作用,在本实验中,随着发酵时间的延长,多肽得率持续提高。发酵时间太短,菌的浓度低,产酶少,不能完全发挥,而发酵时间过长,大量代谢产物的积累抑制酶的活性,并可能将多肽进一步分解为游离氨基酸,导致多肽得率降低。
在本实验中,正交实验的发酵时间较单因素实验中的最佳时间有所缩短,说明各因素之间存在正向交互作用。合适的接种量,减少了菌株适应新环境的时间,适宜的温度加速了菌株的生长繁殖;而较高的转数提高了发酵基质中的溶氧量和氧的传递,为特基拉芽孢杆菌提供了更好的生长环境,也更有利于菌株产酶分解大蛋白分子成小蛋白,从而缩短了发酵时间,节约了时间成本。
3.3 最优发酵条件对菜籽多肽得率及其体外抗氧化活性的影响
通过对发酵基质和发酵条件的优化,特基拉芽孢杆菌液态发酵菜籽粕的多肽得率为21.4%,与何荣海等[9]利用枯草芽孢杆菌发酵制备菜籽多肽的得率为20.19%、金晶[10]利用枯草芽孢杆菌发酵制备菜籽多肽的得率为23.85%的研究结果相近。与对照组相比,用特基拉芽孢杆菌发酵菜粕后,发酵产物氨基酸含量大幅度提高。有研究表明,特基拉芽孢杆菌的基因能够编码可编码蛋白酶、果胶酶、纤维素酶、淀粉酶等多种酶系[26],本实验所用的特基拉芽孢杆菌能够分泌中性蛋白酶和碱性蛋白酶,这些蛋白酶将不溶于水的菜籽大蛋白分解成可溶于水的小分子蛋白和肽,使得发酵产物中氨基酸和多肽含量大幅度提高,其中组氨酸含量提高了30.98倍。
与对照组相比,经特基拉芽孢杆菌发酵菜粕后,发酵产物的DPPH自由基清除率、ATBS自由基清除率、总抗氧化能力和还原力均显著提高,与RONG H等[27]利用枯草芽孢杆菌固态发酵获得菜籽肽的研究结果类似。其中50% DPPH自由基清除率所需菜籽多肽浓度低于何荣海等[9]的报道。发酵产物抗氧化活性的大幅度提高,可能与发酵产物氨基酸和多肽含量大幅提高有关。有研究表明,组氨酸、酪氨酸、甲硫氨酸和胱氨酸等具有抗氧化活性,特别是组氨酸由于其咪唑环的分解而表现出很强的自由基清除活性[28, 29]。
4 结论
特基拉芽孢杆菌液态发酵制备菜籽多肽的最佳发酵条件是发酵基质pH为8,料水比为1∶25,接种量为0.35 mL/g,发酵温度为37 ℃,转速为240 r/min,发酵时间为42 h。此条件下,菜籽多肽得率为21.4%,发酵上清液氨基酸含量大幅提高,体外抗氧化活性显著提高。
