新生儿B族链球菌定植菌株与侵袭性感染菌株血清型、α样蛋白基因及菌毛岛基因特征分析*
2022-11-24刘建瑜陈继昌傅锦坚
刘建瑜,陈继昌,傅锦坚△
1.桂平市人民医院检验科,广西贵港 537200;2.柳州市妇幼保健院预防保健科,广西柳州 545001
B族链球菌(GBS)是革兰阳性球菌,约15%~30%的健康女性生殖道或胃肠道中有GBS定植[1-2]。GBS可由孕产妇垂直传播给新生儿,导致新生儿发生GBS侵袭性感染[3-4]。新生儿GBS侵袭性感染一直备受关注,因为GBS一旦入侵到新生儿无菌体液后,可导致患儿发生危及生命的脑膜炎、肺炎和败血症[5-6]。也有研究表明,一旦新生儿发生GBS侵袭性感染,其长期结局不容乐观,可增加包括死亡和慢性病(如脑瘫、癫痫病和各种神经系统后遗症)的发病风险[7-9]。多糖荚膜是GBS最重要的毒力因子,基于表面多糖结构的差异,目前的分子方法已鉴定出10种公认的荚膜多糖血清型,即血清型Ⅰa、Ⅰb、Ⅱ至Ⅸ[10]。由于GBS血清型分布和携带率存在地理区域差异性,因而获取本地GBS菌株的分子流行病学关键信息可为开发GBS疫苗及实施GBS预防策略的模型算法提供依据。本研究回顾性收集桂平市人民医院分娩的新生儿以及外地转诊的感染性新生儿的GBS标本,并对GBS菌株抗菌药物敏感性、血清型和分子特征进行分析,现将结果报道如下。
1 资料与方法
1.1一般资料 选取2017年1月至2020年6月在桂平市人民医院出生或由外院转诊至桂平市人民医院的新生儿,出生时立刻采集标本(涂抹新生儿的耳朵、口腔和脐带后放入转运培养基中)。经外院转诊的新生儿,到本院新生儿科后,马上使用无菌拭子采集咽部标本放入转运培养基中,送至检验科微生物实验室进行培养。若出生后/经由外院转诊至桂平市人民医院进行救治的新生儿出现了气促、呻吟、发绀或肤色苍白等感染性症状,或体温≥37.3 ℃,对此类患儿抽取2 mL血液进行培养,对出现神经系统症状体征的患儿抽取脑脊液(床旁接种)进行培养,并将上述患儿转到新生儿重症监护室(NICU)中进行治疗。对分离鉴定为GBS的菌株,进一步分为定植菌株(定植组)和侵袭性感染菌株(感染组),即从血液、脑脊液等无菌体液中分离培养出的GBS菌株纳入感染组[11],从非无菌体液(新生儿的耳朵、口腔和脐带)中检出GBS菌株,且新生儿本身无感染症状、体征,该菌株纳入定植组。本研究已经得到桂平市人民医院伦理委员会的审批(批文20170010)。
1.2GBS标本的分离鉴定 标本送至桂平市人民医院医学检验科临床微生物学检验室后,半小时内将标本接种于肉汤增菌培养基,在含有5% CO2培养箱内、37 ℃培养18~24 h,再转种至GBS显色培养基中,经37 ℃培养18~24 h之后,挑选粉色、紫色、红色等可疑阳性菌落至VITECK Compact 2鉴定仪(仪器购自法国生物梅里埃公司)中进行鉴定,确定分离株为GBS。对于脑脊液和血液等无菌体液的标本,放置血培养箱(仪器购自法国生物梅里埃公司)内培养,报阳后抽出标本进行革兰染色并转种至哥伦比亚血平板,进一步进行分离鉴定,过程同上。
1.3抗菌药物敏感性试验和耐药基因检测 K-B纸片法用于GBS的抗菌药物敏感性试验,药敏纸片的选择和折点的判读参照美国临床与实验室标准化协会提出的标准[12]。选择青霉素、头孢曲松、左氧氟沙星、克林霉素、红霉素、氯霉素、利奈唑胺和万古霉素进行抗菌药物敏感性试验。多重耐药的判定标准为菌株对≥3种不同类别的抗菌药物产生耐药。此外,四环素耐药基因型(tetM、tetO、tetL、tetK、tetT和tetS),大环内酯类耐药基因型(ermA、ermB、ermC和mefA/E)和林可酰胺耐药基因型(linB)的检测使用聚合酶链反应(PCR),操作程序和引物的设计方法等参考文献[3]。
1.4GBS的分子特征分析 采用多重PCR方法检测GBS的血清型,α样蛋白基因[Alpha-C蛋白(alphaC)基因、rib基因、epsilon基因、α样蛋白2/3(alp2/3)基因和α样蛋白4(alp4)基因]和菌毛岛基因(PI1、PI2a和PI2b),引物的设计见参考文献[3],选择生工生物工程(上海)股份有限公司合成上述基因引物后,根据文献[3]的PCR扩增步骤,对目的基因进行扩增。
1.5统计学处理 采用IBM23.0软件进行数据处理及统计分析。不符合正态分布的计量资料以M(P25,P75)表示,组间比较采用非参数检验;计数资料采用频数或百分率表示,组间比较采用χ2检验。对血清型与α样蛋白基因、菌毛岛基因之间的关系,采用对应分析比较两者之间的分布差异性。以P<0.05为差异有统计学意义。
2 结 果
2.1感染组和定植组的人口学和临床特征分析 共从44例新生儿标本中分离出GBS,经分析其临床症状和特征,其中12例(27.3%)被纳入感染组,其余32例(72.7%)被纳入定植组。对上述两组新生儿的人口学特征和临床特征进行分析,结果显示,感染组早产儿比例高于定植组(P=0.004)。见表1。
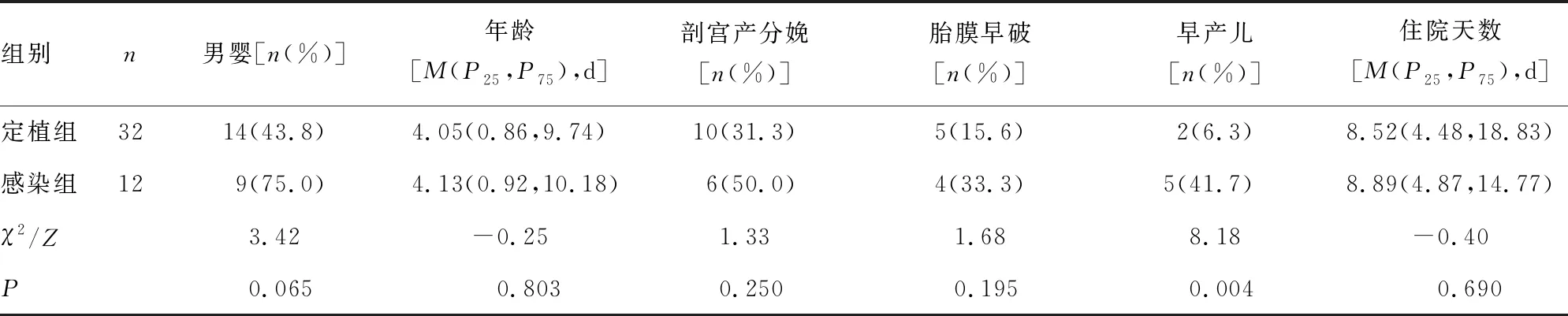
表1 感染组和定植组的人口学和临床特征分析
2.2定植组与感染组的耐药表型、耐药基因型、α样蛋白基因、菌毛岛基因与血清型分析 所有的菌株对青霉素、头孢曲松、万古霉素和利奈唑胺均敏感,对红霉素和克林霉素均耐药,对四环素、左氧氟沙星和氯霉素的耐药率分别为79.5%、38.6%和6.8%,多重耐药率达88.6%。感染组携带菌毛岛基因PI2b和α样蛋白基因rib的比例高于定植组(P<0.05)。定植组携带菌毛岛基因PI2a和α样蛋白基因alphaC的比例高于感染组(P<0.05)。定植组血清型Ⅰa型比例高于感染组(P<0.05),而感染组血清型Ⅲ型比例高于定植组(P<0.05)。见表2。
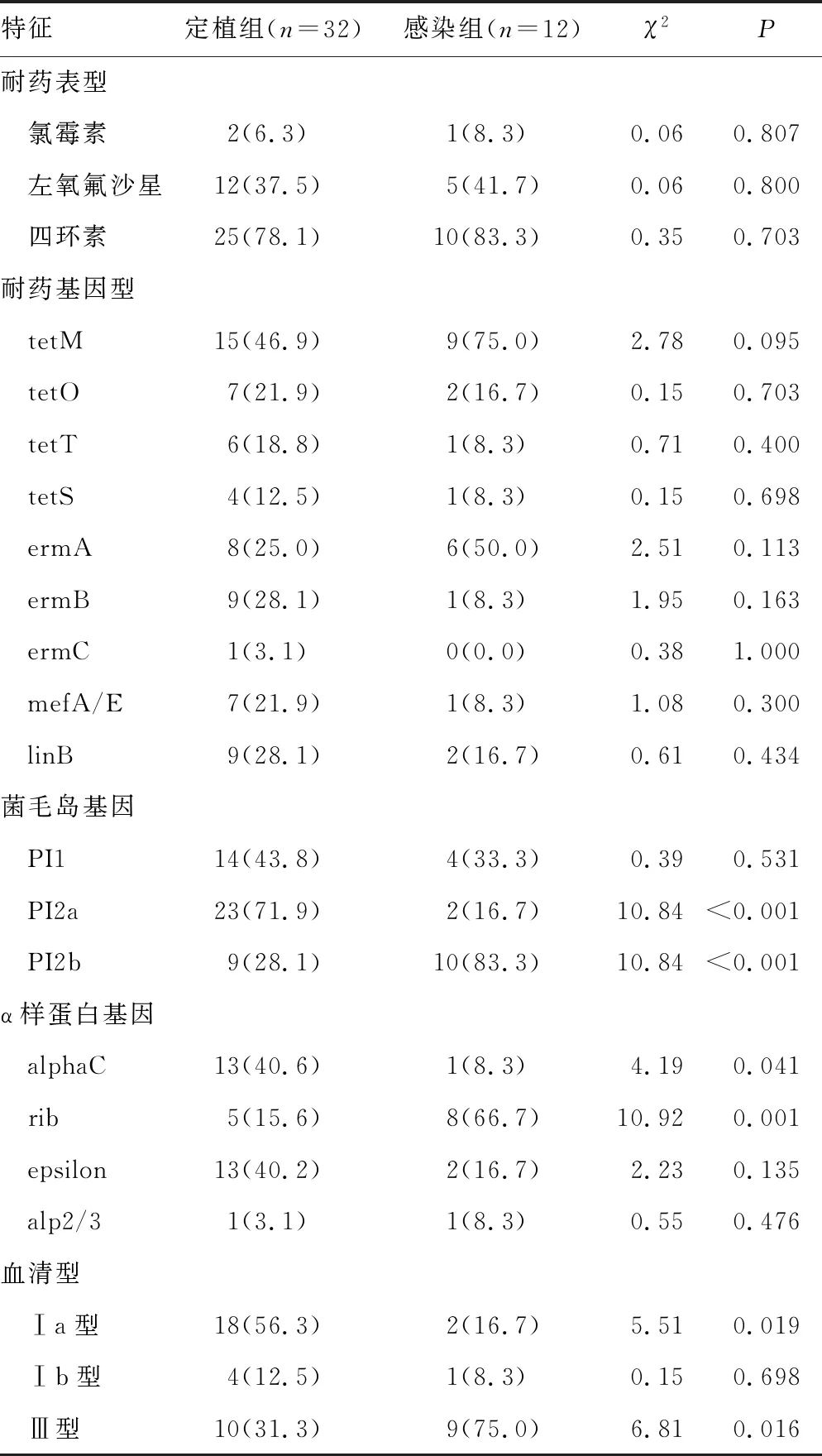
表2 定植组与感染组的耐药表型、耐药基因型、α样蛋白基因、菌毛岛基因与血清型分析[n(%)]
2.3新生儿GBS菌株血清型与耐药基因型、α样蛋白基因和菌毛岛基因的特征分析 四环素耐药基因tetT更常见于血清型Ⅰa型菌株(P=0.043);α样蛋白基因alphaC基因常见于血清型Ⅰa型菌株(P<0.001);α样蛋白基因rib基因常见于血清型Ⅲ型菌株(P<0.001)。见表3。
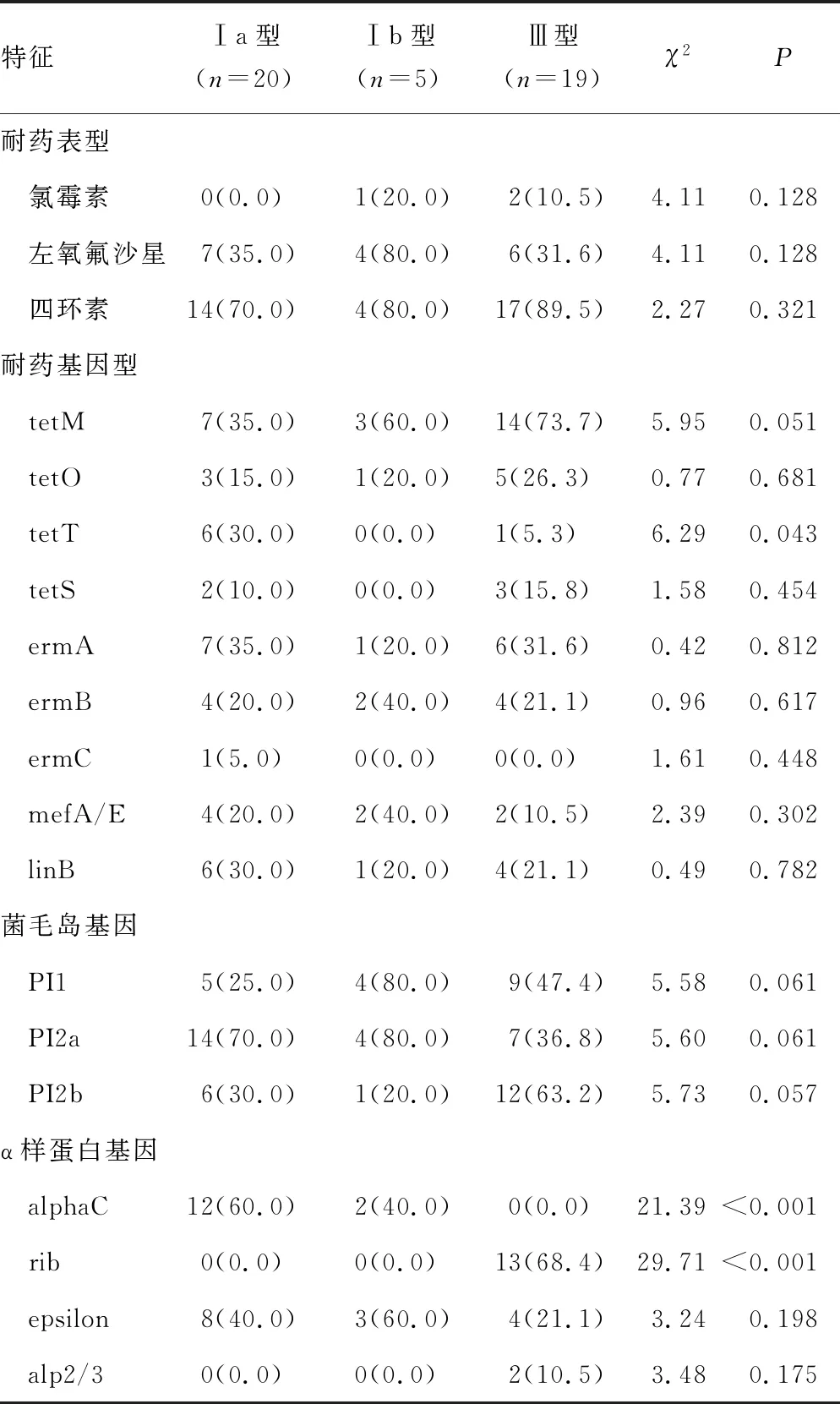
表3 GBS菌株血清型与耐药基因型、α样蛋白基因和菌毛岛基因的特征分析
2.4GBS菌株血清型与α样蛋白基因、菌毛岛基因的对应分析 对应分析结果显示,α样蛋白基因在不同血清型菌株中的分布差异有统计学意义(χ2=33.02,P<0.001),表现为α样蛋白基因rib、alp2/3更常见于血清型Ⅲ型菌株,而alphaC更常见于血清型Ⅰa型菌株,见图1。菌毛岛基因在不同血清型菌株中的分布差异有统计学意义(χ2=15.42,P=0.004),表现为血清型Ⅲ型菌株更容易携带PI2b,而血清型Ⅰa型菌株更容易携带PI2a,见图2。
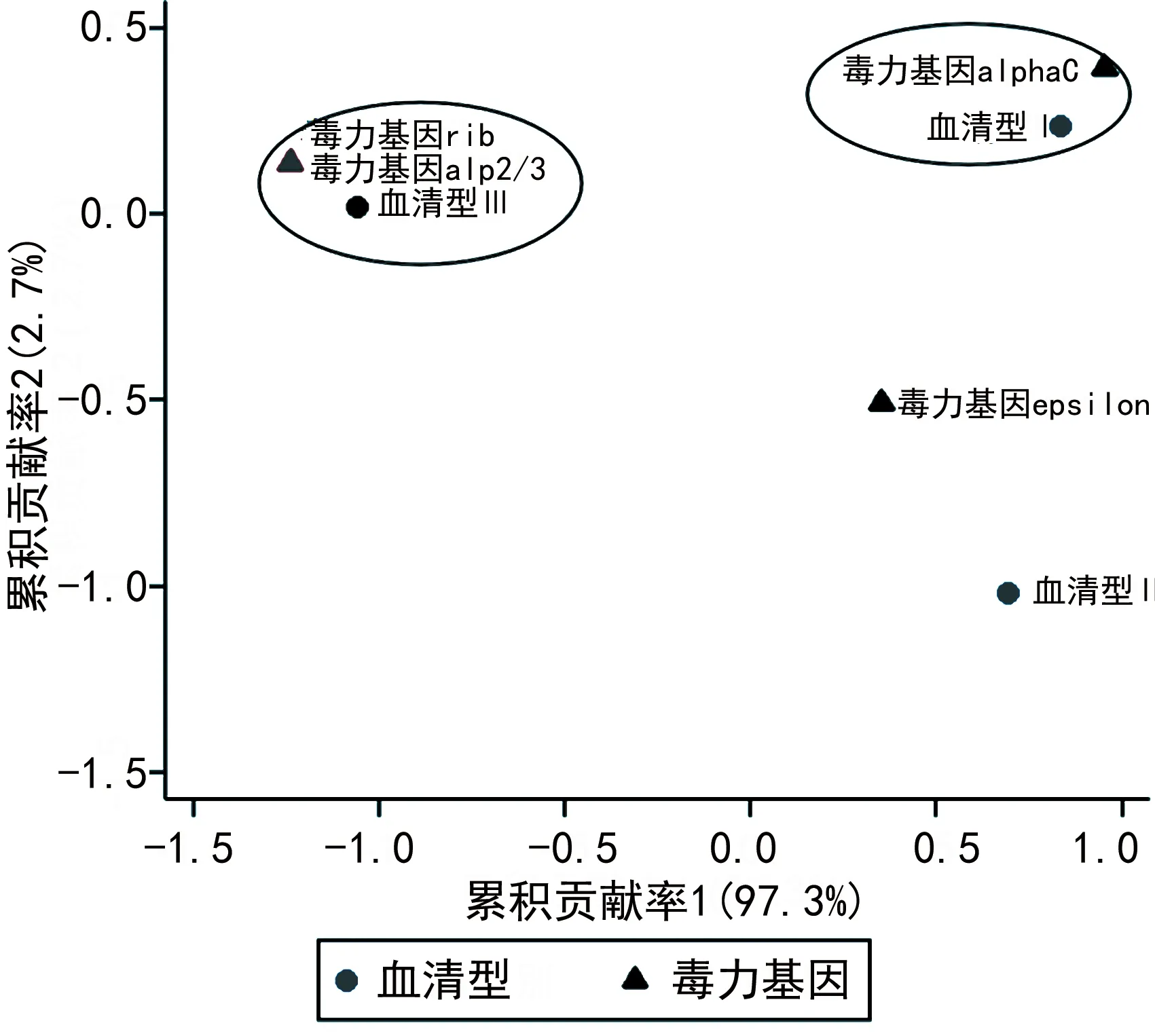
图1 GBS菌株血清型与α样蛋白基因分布的对应分析
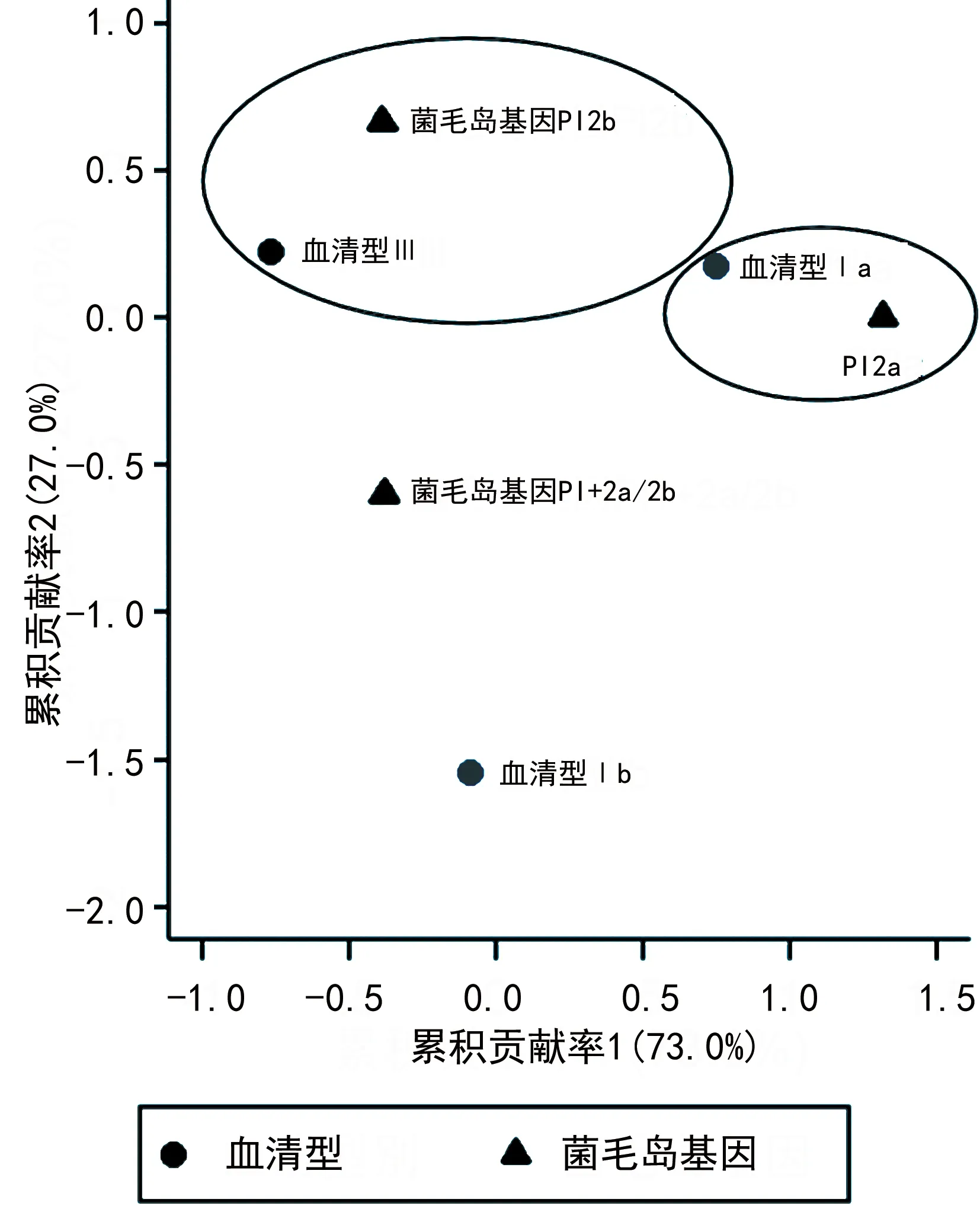
图2 GBS菌株血清型与菌毛岛基因分布的对应分析
3 讨 论
一项纳入5 315例GBS感染引起的新生儿迟发性菌血症/脑膜炎病例的meta分析结果显示,早产与GBS感染引起的新生儿迟发性菌血症/脑膜炎风险显著相关(OR=5.66,95%CI:4.43~7.22)[11]。此外,一项在丹麦和荷兰进行的流行病学调查研究显示,早产不仅可以导致GBS侵袭性感染的风险增加,且GBS感染与早产两个危险因素叠加,致使新生儿发生脑神经发育受损和死亡的风险明显增加[13]。本研究结果与上述研究结果基本一致,感染组早产儿比例高于定植组(P=0.004),提示GBS侵袭性感染的发生风险与早产儿的出生有关,早产是新生儿发生GBS感染的危险因素之一,未来的GBS疫苗研究应尝试确定母体在妊娠期间接种GBS疫苗,且选择最佳时间,以保护早产儿免受GBS侵袭性感染。
有研究显示,GBS对大环内酯类和克林霉素耐药率在世界范围均有逐步升高的趋势[14-15],且某些GBS菌株对万古霉素和庆大霉素产生了耐药[3]。有研究报道,GBS菌株对红霉素和克林霉素产生耐药的主要分子遗传背景基础与血清型Ⅲ型/序列型别ST17流行高度相关[16]。本研究结果显示,所有的GBS菌株均对红霉素和克林霉素耐药,这与以往的研究报道相似[4]。我国报道的GBS菌株对大环内酯类抗菌药物的耐药率为58.0%~70.8%,而欧洲和北美洲报道的GBS菌株对大环内酯类抗菌药物的耐药率仅为11.5%和36.0%[4]。本研究结果表明,本地区临床医生不能使用红霉素和/或克林霉素进行预防性用药,在抗菌药物选择性压力下,本地区的GBS菌株在不久的将来有可能对氨苄青霉素、青霉素和/或头孢类抗菌药物产生耐药性,最终会导致对青霉素不耐受患者的用药选择十分有限。
有研究结果显示,从定植菌株和侵袭性感染菌株分离的GBS血清型的频率相似[17],但本研究结果显示,定植组更容易携带血清型Ⅰa型而感染组更容易携带血清型Ⅲ型。GBS血清型Ⅲ型已成为亚洲最为流行的菌株之一,在所有的GBS侵袭性感染中所占的比例为32.2%~77.9%[16]。尽管GBS菌株的血清型随时间和空间分布容易发生变化,但血清型Ⅲ型在新生儿群体分离的GBS菌株中比例一直在增加[16]。孕妇接种GBS疫苗是预防新生儿发生侵袭性感染的有效策略之一[18]。世界卫生组织提出了加快GBS疫苗的研发速度以便降低新生儿GBS侵袭性感染的发病率和病死率[19],在此情况下,本研究的结果为本地区GBS菌株的分子流行病学特征和血清型分布提供了基础依据。
迄今为止,基于表型和分子特征区分GBS克隆的数据较少。本研究观察到某些血清型与α样蛋白基因之间存在良好的一致性,且α样蛋白基因与血清型的分布存在差异,如血清型Ⅲ-rib和血清型Ⅰa-alphaC,与此前的研究报道GBS的特定血清型-alp基因组合(如血清型Ⅴ-alp2/3,血清型Ⅲ-rib、血清型Ia-epsilon、血清型Ⅱ-rib和血清型Ⅰb-alp2/3)的结果相似[3,20]。此外,本研究观察到alphaC存在于非血清型Ⅲ型的GBS菌株中。因此,若能研究出由alphaC和血清型Ⅲ型组成的结合疫苗即有可能对大多数GBS感染具有保护作用。
本研究观察到每株GBS菌株至少可检测出一种菌毛岛基因,且根据对应分析结果,特定的血清型与菌毛岛基因的分布具有一致性,如血清型Ⅲ型的GBS菌株更易携带菌毛岛基因PI2b,血清型Ⅰa型的GBS菌株更易携带菌毛岛基因PI2a,此发现与之前的研究报道结果一致[21]。有研究报道表明,菌毛岛基因的存在可能会增加某些菌株在人体中的适应性和定植潜力,菌毛岛基因可使GBS菌株锚定在孕产妇阴道内并增加了随后GBS垂直传播的机会[22-23]。结合本研究结果和以往研究结论,可加深临床医生对不同标本来源和不同地区来源菌株的菌毛岛基因分布模式和菌株遗传背景多样性的了解,并对未来基于菌毛岛基因开发新的GBS疫苗提供启示。
综上所述,本研究结果显示本地区分离的新生儿GBS菌株对红霉素和克林霉素有较高的耐药性,强调了持续性监测GBS菌株抗菌药物敏感性的必要性。此外,本研究发现GBS菌株特定的血清型-α样蛋白基因和血清型-菌毛岛基因的组合,即GBS菌株的α样蛋白基因和菌毛岛基因在不同血清型菌株中的分布存在差异性,凸显了监测GBS菌株的分子特征以发现GBS新的流行病学趋势的价值,并为制订新的GBS疫苗提供了本土流行病学依据。
