基于网络药理学探讨加味十灰散治疗溃疡性结肠炎的作用机制*
2022-11-23俞雯雯任列钰康年松沈淼山倪观锋
俞雯雯 任列钰 康年松 沈淼山 倪观锋 王 丹
1 余姚市中医医院 浙江 余姚 315400
2 浙江理工大学 浙江 杭州 310018
溃疡性结肠炎(UC)是一种免疫介导的慢性、非特异性炎症性肠病,具有易反复、难治愈等特点,寻找安全、有效的 UC治疗药物已成为国内外学者的研究焦点。UC以“腹痛”“泄泻”“便血”为主症,中医将其归属于“痢疾”范畴,其主要病机为热邪壅滞于肠,气血阻滞,肠道运化失司,脂膜血络受损,腐败而化为脓血为病。从UC发生发展的过程来看,“热邪壅滞”是其关键,以“清热解毒、凉血散瘀”为治则的加味十灰散(JWSHS)加减治疗溃疡性结肠炎,效果显著[1],但该方治疗UC的具体作用机制尚不明朗。本研究将运用网络药理学方法探究JWSHS治疗UC的作用机制,寻找JWSHS干预UC的潜在治疗靶点,为其治疗UC提供理论依据。
1 材料与方法
1.1 药物活性成分筛选及潜在靶点获取:通过搜索中药系统药理数据库(TCMSP),收集JWSHS中17味中药“大蓟、小蓟、仙鹤草、五倍子、五味子、牡丹皮、大黄、野菊花、白头翁、秦皮、白及、丹参、当归、黄柏、黄连、黄芩、甘草”的主要成分,并以类药性(DL)≥0.18、口服利用度(OB)≥30%为条件筛选成药性较好的活性成分[2]。通过Cytoscape v3.7.2绘制中药-活性成分网络图。整理活性成分,通过TCMSP数据库搜索药物活性成分对应的靶点,并通过Uniprot数据库(https://www.uniprot.org/)进行靶点信息比对和基因名校正,限定基因来源为人源性。
1.2 疾病相关基因获取:通过检索疾病相关的基因与突变位点数据库(https://www.disgenet.org/)及人类基因组注释数据库(https://www.genecards.org/),输入检索词为“ulcerative colitis”,合并两个数据库搜索得到的疾病靶点,并与药物靶点进行映射,获取交集靶点,利用韦恩在线网站(https://bioinfogp.cnb.csic.es/tools/venny/)做交集靶点韦恩图。利用Cytoscape v3.7.2软件将结果可视化,并构建JWSHS活性成分-交集靶点网络图。
1.3 蛋白质互作网络(PPI)构建:将交集靶点导入STRING(http://string-db.org/cgi/input.pl)数据库,构建PPI,将结果导入Cytoscape v3.7.2,借助Cyto NCA插件中的Degree、Betweenness、Closeness等参数筛选节点,将连接度大于等于2倍中位数的节点确定为关键靶点。将关键靶点与对应的化合物一一对应,导入Cytoscape v3.7.2作图,以度值为筛选条件,得到JWSHS治疗UC的关键成分。
1.4 GO和KEGG分析:将关键靶点导入DAVID(https://david.ncifcrf.gov/)数据库进行生物学过程富集(GO)分析,导入京都基因与基因组百科全书(KEGG)(https://www.kegg.jp/kegg/)进行信号通路分析,获取关键靶点的相关生物学信息,并利用R软件绘制气泡图,分析JWSHS治疗UC的潜在作用机制。
2 结果
2.1 JWSHS活性成分和潜在靶点获取:在TCMSP中搜索JWSHS活性成分,最终得到237个药物活性成分,通过TCMSP数据库共获得305个药物潜在靶点,利用Cytoscape v3.7.2绘制中药-活性成分网络图,见图1。

图1 JWSHS中药-活性成分网络图
2.2 UC靶点获取:以“ulcerative colitis”为检索词,在Genecards数据库和Disgenet数据库检索相关基因,合并两个数据库找到的UC靶点,与JWSHS活性成分潜在靶点进行对比,利用韦恩在线网站寻找交集靶点,共得到159个共同基因,韦恩图见图2。将JWSHS活性成分与交集靶点导入Cytoscape v3.7.2将结果可视化,并构建JWSHS活性成分—交集靶点网络图,见图3。

图2 JWSHS交集靶点韦恩图

图3 JWSHS活性成分—交集靶点网络图
2.3 核心靶点互作图:构建PPI,159个目标靶点存在复杂的相互作用,共有159个结点,2824条边,结点平均度值为35.5,结点度值的中位数为32,最大值为113,将结果导入Cytoscape v3.7.2,得到加味十灰散治疗UC的159个靶标蛋白互作信息(图4A),设置度的筛选值为两倍中位数值14至最大值113,从交集靶点蛋白互作PPI网络筛选出核心靶点27个,分别为AKT1、IL-6、VEGFA、TP53、TNF、MAPK8、EGF、JUN、CASP3、STAT3、EGFR、PTGS2、MYC、MMP9、IL-1B、FOS、FN1、CCL2、ESR1、CCND1、NOS3、EDN1、CAT、MMP2、PPARG、IL-10和ICAM1。根据蛋白与蛋白的Degree值绘制27个核心靶点节点的条形图(图4B)。将27个核心靶点对应化合物进行网络构建,如图5所示。根据度值筛选前10味成分为槲皮素,木犀草素,汉黄芩素,山柰酚,丹参酮IIA,黄芩素,芦荟大黄素,柚皮素,隐丹参酮和吴茱萸次碱。

图4 A 靶标蛋白互作信息图 图4B 核心靶点条形图
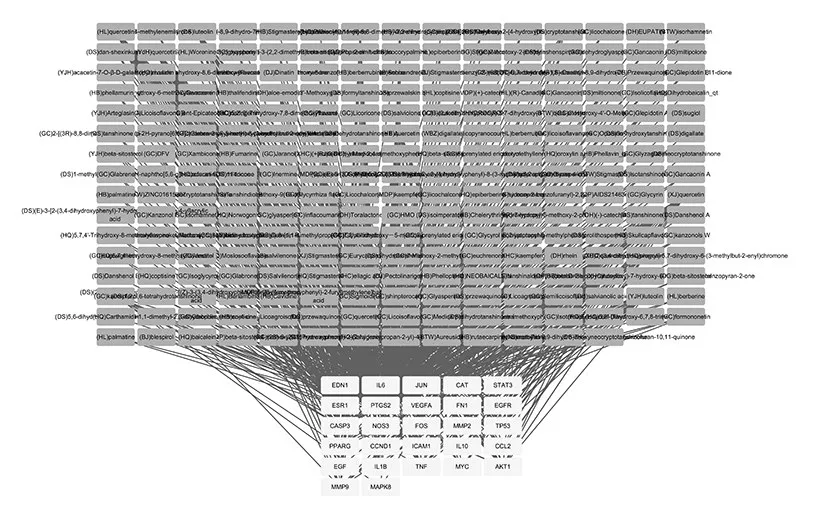
图5 JWSHS有效成分-核心靶点网络图
2.4 GO和KEGG分析:分述如下。
2.4.1 GO分析:将159个交集靶点导入DAVID数据库,并限定物种来源为人源,选择标记栏为official gene symbol进行检索,设定阈值以错误发现率(FDR)<0.01为前提,确定了258个GO条目,其中BP相关条目197个(图6A),MF相关条目39 个(图6B),CC相关条目22个(图6C)。
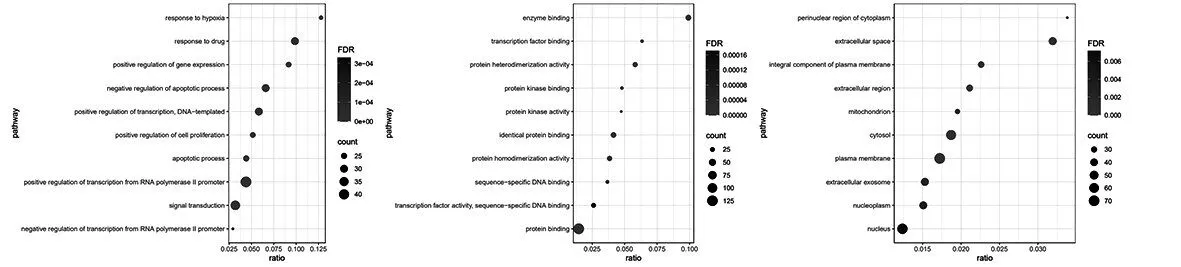
图6 A BP分析 图6B MF分析 图6C CC分析
2.4.2 KEGG分析:得到125条信号通路,根据FDR<0.01筛选出104条,其中包括癌症信号通路,乙型肝炎信号通路等,利用R-4.0.5进行KEGG通路富集可视化分析,通过count、ratio和FDR来衡量KEGG富集程度,筛选并确定其中50条最具统计意义的通路,见图7。
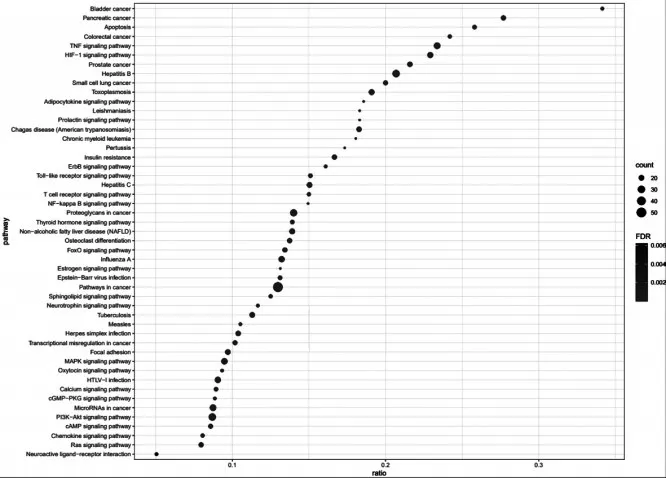
图7 JWSHS作用靶点KEGG富集分析
3 讨论
槲皮素存在于甘草、黄柏、黄连、牡丹皮、仙鹤草、小蓟、野菊花中,经文献验证,槲皮素可靶向作用于CXCL8用于防治UC[3]。木犀草素为丹参、仙鹤草、野菊花的活性成分,已有文献研究证实木犀草素可以通过SHP-1/STAT3信号通路缓解UC[4]。汉黄芩素为黄芩的主要有效成分,且小鼠实验证实汉黄芩素为治疗UC的血清药效物质基础[5]。肠道微生态破坏被认为是UC的发病机理之一,研究证实,山柰酚可以通过抑制LPS-TLR4-NF-κB信号通路调节肠道微生态,从而缓解UC相关症状[6],JWSHS组方中甘草、牡丹皮、仙鹤草均含有山奈酚。丹参酮ⅡA为丹参的主要有效成分,大鼠实验表明,其可有效抑制UC大鼠炎性反应,其作用机制可能与有效下调结肠组织p-p38MAPK、NOXs表达相关[4]。此外,动物实验表明黄芩素可有效减轻UC大鼠炎性反应及结肠黏膜组织炎性病理损伤,其作用机制可能与有效上调结肠黏膜组织HSP70表达相关[7]。最新研究显示,柚皮素可以通过miR-22抑制NLRP3炎症小体并减轻UC大鼠模型肠屏障损伤[8],隐丹参酮对小鼠急慢性UC有一定的治疗作用[9],吴茱萸次碱对UC小鼠有治疗作用[10]。以上报道与本研究相互印证,表明JWSHS治疗UC的具有一定科学性。
为深入研究JWSHS治疗UC的关键蛋白,对预测得到的JWSHS治疗UC的潜在靶标进行PPI网络分析,AKT1、IL-6、VEGFA、TP53、TNF等基因在网络中具有较高的Degree,在网络中处于重要地位。Akt在调节细胞代谢、生长、凋亡和生存方面具有重要作用,UC模型组中AKT表达显著升高[11]。IL-6和TNF作为重要的促炎性细胞因子,可以调控免疫炎性反应,介导UC发病[6]。VEGFA也被称为血管通透性因子,具有诱导血管渗漏的能力,它诱导的血管通透性增强是其在炎症和其他病理环境中发挥重要作用的基础,研究显示UC患者VEGF的黏膜表达水平显著升高[12]。TP53是一种重要的抑癌基因,而UC的癌变发生率高达28%,故对TP53进行有效调控可能是未来UC治疗的方向之一。
基于KEGG代谢通路的结果分析发现,JWSHS主要作用 于 Pathways in cancer,Hepatitis B,PI3K-Akt signaling pathway等通路。研究发现通过调控PI3K/Akt信号通路可有效抑制炎症介质释放的级联反应[13]。通过抑制PI3K/Akt信号通路中相关蛋白磷酸化水平,可降低炎症因子及蛋白的表达,从而抑制炎症小体活化,缓解肠组织炎症症状,进而改善肠组织损伤。肿瘤信号通路涵盖范围较广,与PI3K-Akt、MAPK信号通路等联系密切,可引起基因组损伤,化疗抵抗等反应,UC癌变发生率高达28%,而肿瘤信号通路的变化与癌变发生有着高度的关联性。
综上所述,本研究通过网络药理学分析发现槲皮素、木犀草素、汉黄芩素等为JWSHS主要活性成分,AKT1、IL-6、VEGFA、TP53、TNF等为主要作用靶标,主要调控癌症信号通路、乙肝信号通路、PI3K-Akt等通路。本研究对阐明JWSHS的作用机制具有借鉴意义,但所得结论仍需进一步通过实验或临床验证。
