强筋合剂对骨质疏松大鼠治疗及相关基因ALP、Osteocalcin、Runx-2表达的调节作用*
2022-11-23王青华龚卫月沈云方谢海霞蒋雪嫣
王青华 龚卫月沈云方 谢海霞 蒋雪嫣 胡 钧
浙江中医药大学附属湖州中医院 浙江 湖州 313000
骨质疏松症(osteoporosis,OP)是一种以骨量减少、骨微结构破坏、骨脆性增加、易发生骨折为特征的代谢性骨病[1]。在数千年积累的中药宝库中,多种药物存在抗OP作用,如淫羊藿、骨碎补、鹿茸、杜仲、山茱萸[2]等经研究表明,不仅能缓解患者症状,提高骨密度,且不良反应少而轻,不产生耐药性。因此,笔者旨在研究强筋合剂对骨质疏松的治疗作用及相关机制。
1 实验材料
实验动物与药物:取3月龄健康雌性SPF级SD大鼠40只,体质量约220g。强筋合剂20世纪80年代获得制剂批准文号(批准文号:浙药制Z20100176)。强筋合剂[3]由淫羊藿、骨碎补、杜仲叶、熟地、丹参、五加皮、川续断、鸡血藤、白芍各20g煮制而得。
2 研究方法
30只SD大鼠采用卵巢切除术制备骨质疏松大鼠:大鼠麻醉后,取仰卧位固定进行腹部剃毛并消毒,打开腹腔后切除双侧卵巢。低钙饲养3个月后,随机抽取6只大鼠,以检测骨密度(BMD)及血清碱性磷酸酶(ALP)及磷离子(P+)、钙离子(Ca2+)含量确认造模成功。大鼠分为模型组、低剂量组和高剂量组,另取10只SD大鼠为假手术组,操作同模型大鼠,打开腹腔,但不切除卵巢。确定造模成功后,低剂量组给药10mL/(kg·d),高剂量组给药20mL/(kg·d),同时假手术组和模型组用等量生理盐水灌胃,各组给药3个月,每天2次。
2.1 观察指标:①血清中磷离子(Phosphorusion,P+),钙离子(Calciumion,Ca2+),镁离子(Magnesiumion,Mg2+)浓度:给药3个月大鼠腹主动脉采血,离心制得血清,测定血清P+,Ca2+,Mg2+的含量;②骨形态检测;③骨显微结构观察;④RT-PCR检测碱性磷酸酶(Alkaline Phosphatase,ALP)、骨钙素(Osteocalcin)和Runt相关转录因子2(Runt-related transcription factor 2,Runx-2)表达。各基因引物如下。

表1 RT-PCR各基因引物设计
2.2 统计学方法:所有数据均采用SPSS 20.0软件分析。其中计量资料以均数±标准差(±s)表示,采用t检验。计数资料采用例数(%)表示,采用χ2检验,均以P<0.05表示差异具有显著性。
3 结果
3.1 两组大鼠血清P+,Ca2+,Mg2+含量的比较:从表2可得,与假手术组比较,模型组大鼠血清P+含量显著上升(P<0.05),Ca2+与Mg2+含量显著下降(P<0.05)。与模型组比较,给药组大鼠血清P+含量显著下降(P<0.05),Ca2+与Mg2+含量显著上升(P<0.05)。
表2 血清P+、Ca2+和Mg2+含量变化情况(±s,n=10)

表2 血清P+、Ca2+和Mg2+含量变化情况(±s,n=10)
注:与假手术组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
Mg2+(mmol/L)2.90±0.28 1.77±0.19**2.42±0.24##2.69±0.28##组别假手术组模型组低剂量组高剂量组P+(mmol/L)1.80±0.19 2.87±0.30**2.49±0.26#2.35±0.26##Ca2+(mmol/L)1.80±0.20 1.20±0.14**1.40±0.15#1.57±0.20##
3.2 大鼠股骨HE染色比较:由表3可知,与模型组比较,给药大鼠半定量评分显著降低(P<0.05或P<0.01)。由图1可得,与假手术组大鼠比较,模型组大鼠骨小梁局灶性坏死,排列稀疏、不整齐,部分断裂,骨髓腔内造血细胞数量减少,形态改变;给药组与模型组比较,大鼠骨小梁数量减少不明显,排列较规则,连续性、完整性较好;且高剂量组比低剂量组损伤更少;两组与模型组比较,骨形态学结构变化具有统计学意义。
表3 SD大鼠软骨组织HE半定量评分表(±s,n=10)

表3 SD大鼠软骨组织HE半定量评分表(±s,n=10)
注:与模型组比较,#P<0.05,##P<0.01。
半定量评分(分)-2.67±0.58 0.33±0.58#0.67±0.58##组别假手术组模型组低剂量组高剂量组

图1 鼠股骨组织细胞形态结构变化情况(HE染色,200倍)
3.3 Micro-CT检测大鼠股骨形态比较:由Micro-CT数据可得,骨小梁密度(Tb.Th)、骨小梁相对体积(BV/TV)和骨密度(BMD)指标,模型组比假手术组明显下降,且有显著性差异(P<0.05)。给药组相较于模型组明显上升,且有显著性差异(P<0.05),详见表4。各组小鼠的股骨显微结构改变见图2。
表4 骨质疏松大鼠Micro-CT检测结果(±s)

表4 骨质疏松大鼠Micro-CT检测结果(±s)
注:与假手术组比较,*P<0.05,**P<0.01,与模型组比较,#P<0.05,##P<0.01。
BMD 241.17±29.16 189.45±17.63**230.75±21.64##239.79±22.57##组别假手术组模型组低剂量组高剂量组BV/TV 0.24±0.03 0.16±0.01*0.20±0.01#0.21±0.01#Tb.Th(1/mm)3.42±0.08 1.84±0.14**2.74±0.21##2.97±0.23##

图2 Micro-CT观察大鼠股骨显微结构的改变
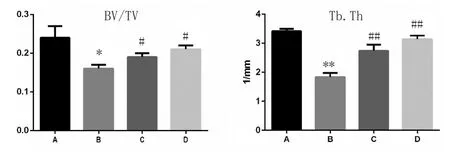
图3 各组大鼠Micro-CT检测结果
3.4 X光观察大鼠股骨结构的改变:X光图片可观察到,模型组相较于假手术组,骨密度明显降低,说明模型组出现骨质疏松病症。给药组相较于模型组,骨密度有所增加。

图4 X光观察大鼠股骨结构的改变
3.5 RT-PCR检测ALP、Osteocalcin、Runx-2表达:通过RT-PCR检测相关基因发现,与假手术组比较,模型组的ALP、Osteocalcin、Runx-2 mRNA相对表达量均显著下调(P<0.05);与模型组比较,给药组ALP、Osteocalcin、Runx-2 mRNA表达水平均显著上调(P<0.05),证实强筋合剂治疗骨质疏松症过程中对ALP、Osteocalcin、Runx-2表达有上调作用。

图5 RT-PCR检测ALP、Osteocalcin、Runx-2表达水平
4 讨论
骨质疏松是老年患者常见疾病,随着我国老龄化与日俱增,骨质疏松症的发病率逐年增高[4,5],如何预防和治疗骨质疏松已经成为相关学科研究的重要任务。有文献报道淫羊藿其主要成分可以促进骨髓间充质干细胞向成骨分化,以淫羊藿苷和淫羊藿次苷效果最佳[6]。网络药理学研究也表明骨碎补可以多成分、多靶点、多途径的抗OP[7]。因此,本研究拟大鼠去卵巢模型实验证实强筋合剂可以治疗大鼠骨质疏松的效果及可能机制。
强筋合剂为50多年前我院名老中医钱世勋先生根据临床经验和经方创建的“名方好药”,符合我国中药方剂学的君臣佐使配伍,多种药物发挥协同作用,达到治疗作用。
本研究结果显示,给药3个月后,模型组大鼠较假手术组血清P+含量显著上升,Ca2+与Mg2+含量显著下降。给药组大鼠与模型组比较,血清P+含量显著下降(P<0.05),Ca2+与Mg2+含量显著上升(P<0.05),且成剂量依赖性。HE染色结果显示模型组大鼠的骨小梁坏死,细胞形态改变且数量明显减少,给药组大鼠骨小梁较模型组明显增加,排列较整齐。此外,CT显示大鼠的骨结构明显改善,骨密度增加。通过以上研究初步证实了强筋合剂对骨质疏松的治疗作用,本研究进一步对相关因子如碱性磷酸酶、骨钙蛋白、Runx-2表达进行分析,发现模型组大鼠的ALP、Osteocalcin和Runx-2表达较假手术组明显减少(P<0.05),给药组的以上基因表达明显高于模型组。证实强筋合剂治疗骨质疏松症过程中对ALP、Osteocalcin、Runx-2表达有上调作用,促进成骨细胞合成。ALP是成骨细胞成熟重要标志,参与成骨细胞分化全过程,可用于代表成骨细胞分化活性和分化水平[8]。Osteocalcin是反映骨更新的生化指标,也能反映机体骨形成、骨代谢变化、骨细胞的功能状况[9]。Runx-2与其下游基因Osterix在骨形态发生蛋白(bone morphogenetic protein,BMP)诱导的前成骨细胞分化中发挥着重要作用[10]。多项报道研究显示以上3种因子在骨细胞成型过程中发挥重要作用[11]。
综上所述,强筋合剂能有效改善骨质疏松大鼠股骨形态学,增加细胞数量,提高骨小梁密度(Tb.Th)、骨小梁相对体积(BV/TV)和骨密度,上调ALP、Osteocalcin、Runx-2表达水平,且安全性较好。
