非小细胞肺癌FOXP3与P53突变的关联及其对Cyclin D1和CDK4的表达调控作用
2022-11-22何程远杨红宇
历 春,何程远,赵 颖,杨红宇
(1.北华大学基础医学院,吉林 吉林 132013;2.吉林化学工业公司总医院,吉林 吉林 132021)
叉头蛋白3(forkhead box protein 3,FOXP3)作为叉头/翼状螺旋转录因子家族的成员之一,不仅在CD4+CD25+调节性T细胞(regulatory T cells,Tregs)的发育和功能中发挥重要作用,而且还在肺癌、肝癌、宫颈癌等多种肿瘤细胞中有表达,其通过促瘤或抑瘤作用影响肿瘤的发生和发展[1-5].本课题组前期研究[6-8]发现,FOXP3在非小细胞肺癌(non-small cell lung cancer,NSCLC)细胞中高表达,可通过促进肿瘤细胞增殖、侵袭转移和化疗耐药等促进NSCLC的恶性进展.P53基因是重要的抑癌基因,可通过促进细胞周期阻滞、细胞凋亡和DNA修复等机制防止细胞癌变,至少50%的恶性肿瘤可检测到P53基因突变[9].NSCLC患者组织标本中可检测到约60%的P53基因突变,与肿瘤转移和不良预后关系密切[10-11].目前,NSCLC中FOXP3与P53突变的关联尚不明确.因此,本研究通过分析NSCLC组织中FOXP3和突变型P53(mutant P53,mt-P53)蛋白表达的相关性,观察FOXP3沉默对A549细胞增殖、细胞周期、细胞周期蛋白D1(cyclin D1)和细胞周期依赖性激酶4(cyclin-dependent kinase 4,CDK4)表达的影响,为FOXP3促进NSCLC的发生发展提供新的理论机制,也为NSCLC的免疫治疗提供新的靶点.
1 资料与方法
1.1 实验试剂
DMEM高糖培养基(上海中乔新舟生物科技有限公司);胎牛血清(天杭生物科技股份有限公司);FOXP3 siRNA及阴性对照序列(广州锐博生物技术有限公司);FOXP3抗体(Abcame公司,美国);mt-P53抗体和免疫组化试剂盒(北京中杉金桥生物技术有限公司);LipofectaminTM2000试剂盒(赛默飞世尔科技有限公司);SYBR Premix Ex TaqTMII试剂盒(宝生物工程(大连)有限公司);Cyclin D1、CDK4和GAPDH抗体(成都正能生物技术有限责任公司);细胞周期试剂盒(江苏凯基生物技术股份有限公司);BCA试剂盒、MTT试剂盒、ECL发光试剂盒(碧云天生物技术有限公司).
1.2 临床标本资料
收集吉林化学工业公司总医院病理科2010年—2013年原发性非小细胞肺癌(NSCLC)术后标本50例,其中,男30例,女20例;年龄39~77岁,平均(58.5±9.5) 岁.患者术前均未行放、化疗,术后均有病理学明确诊断.
1.3 免疫组化染色及结果判断
免疫组织化学染色采用PV二步法,参照试剂盒说明书进行,PBS替代一抗作阴性对照.结果判断采用双盲法,以肿瘤细胞质和细胞核显示棕黄色颗粒为阳性染色.FOXP3染色结果分析依照文献[7]、mt-P53染色结果判定依照文献[12]进行.
1.4 细胞培养
人NSCLC细胞株A549由北华大学基础医学院实验室保存,细胞培养于含10%胎牛血清的高糖DMEM培养基中,在37 ℃、5% CO2的孵箱中培养.
1.5 siRNA瞬时转染
取第三代A549细胞(3.0×105个/孔)接种6孔板,待细胞贴壁后进行siRNA转染.实验分为A549组、Control-siRNA组、FOXP3-siRNA组.si-FOXP3干扰序列:5′-CAUGGACUACUUCAAGUUCd TdT-3′.转染步骤按照LipofectamineTM2000说明书进行,转染后6 h更换为含10%胎牛血清的DMEM培养基.
1.6 Real-time PCR
应用0.25%胰酶消化转染各组A549细胞48 h,提取细胞总RNA,反转录为cDNA,使用 SYBR Premix Ex TaqTMII进行FOXP3 mRNA的表达检测.FOXP3 引物F:5′-CAC AAC ATG CGA CCC CTT TCA CC-3′,R:5′-AGG TTG TGG CGG ATG GCG TTC TTC-3′;GAPDH 引物F:5′-ATG GGG AAG GTG AAG GTC G-3′,R:5′-GGG TCA TTG ATG GCA ACA ATA TC-3′.反应条件:95 ℃ 15 min,95 ℃ 10 s,60 ℃ 10 s退火,40个循环.以 GAPDH 为内参,通过 2-ΔΔCt计算方法分析各样本中FOXP3 mRNA的相对含量.
1.7 Western blotting检测蛋白表达
收集转染72 h的各组A549细胞,提取细胞总蛋白,BCA法测定细胞总蛋白浓度.蛋白上样量30 μg,10%SDS-PAGE电泳,并用湿转方式移至PVDF膜上,封闭液封闭1 h,分别孵育FOXP3(1∶500稀释)、Cyclin D1﹑CDK4和GAPDH抗体(1∶1 000稀释);4 ℃摇床过夜.次日TBST洗涤3次,加入HRP 标记的IgG抗体(1∶3 000)室温孵育1 h,加入ECL显色底物发光并拍照.以GAPDH作内参,以目标条带与内参条带的灰度值之比作为目标蛋白的相对表达量.
1.8 CCK-8方法检测细胞增殖
将转染24 h后的各组A549细胞以5×103个/孔接种96孔板中,每组5个复孔;于48 h后每孔加入10 μL CCK-8溶液,继续培养2 h;应用酶标仪在450 nm波长检测各孔光密度值(OD值).
1.9 流式细胞术检测细胞周期
应用0.25%胰酶消化转染各组A549细胞48 h,计数1×106/mL;PBS洗涤细胞1次,加入70% 冷乙醇500 μL,4 ℃固定过夜;PBS洗涤2次,加入100 μL RNaseA 37 ℃水浴30 min,再加入400 μL PI染液,室温避光孵育30 min后上机检测.
1.10 统计学分析

2 结 果
2.1 FOXP3和mt-P53蛋白在NSCLC组织表达的相关性
应用免疫组化方法检测FOXP3和mt-P53蛋白在NSCLC组织的表达,Pearson相关分析二者间的相关性.结果显示:FOXP3蛋白的阳性表达率为64.0%,mt-P53蛋白的阳性表达率为56.0%,32例FOXP3阳性病例中P53突变率为68.8%,28例mt-P53阳性标本中FOXP3的阳性表达率为78.6%,Pearson相关分析显示二者之间表达呈显著正相关关系(r=0.342,P=0.015).见表1和图1.

表1 FOXP3和mt-P53在NSCLC组织表达的相关性Tab.1 Correlation between FOXP3 and mt-P53 expression in NSCLC tissues
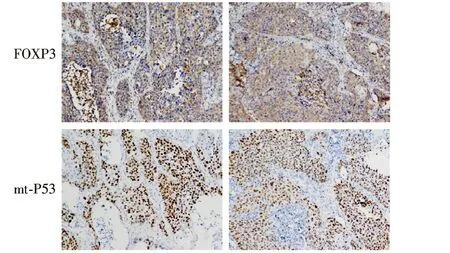
图1FOXP3和mt-P53蛋白在同一NSCLC 组织中的表达(× 200)
2.2 A549细胞FOXP3沉默效果检测
应用Real-time PCR和Western blotting法检测A549细胞瞬时转染FOXP3 siRNA和Control siRNA沉默效果,结果显示:与A549组和Control-siRNA组相比,FOXP3-siRNA组FOXP3 mRNA和蛋白的表达水平显著下调.见图2.
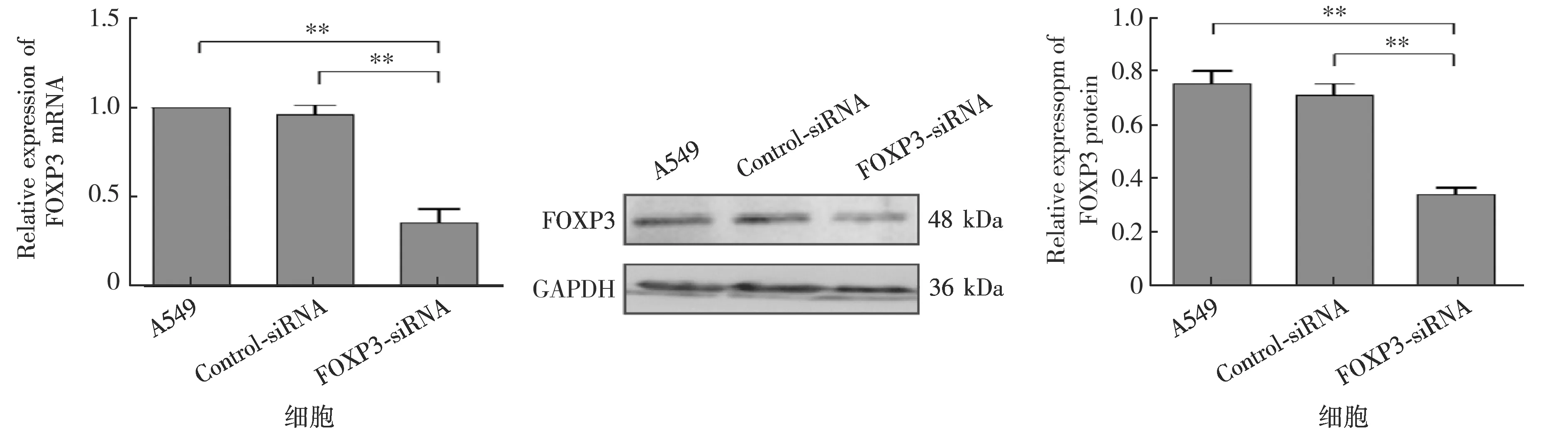
a Real-time PCR检测FOXP3沉默效果(**.P<0.01) b Western blotting检测FOXP3沉默效果(**.P<0.01)图2A549细胞FOXP3沉默效果检测Fig.2Detection of FOXP3 silencing effect in A549 cells
2.3 FOXP3沉默对A549细胞增殖能力的影响
应用CCK-8方法检测FOXP3沉默后A549细胞的增殖能力,结果显示:与A549组和Control-siRNA组相比,FOXP3-siRNA组细胞的增殖能力显著降低(P<0.01).见图3.
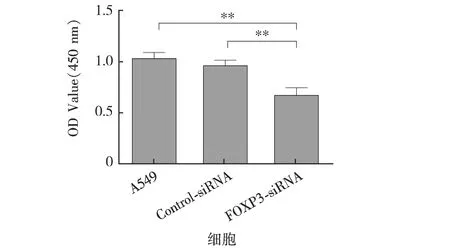
**.P<0.01.图3FOXP3沉默对A549细胞增殖的影响Fig.3Effects of silencing FOXP3 on the proliferation of A549 cell
2.4 FOXP3沉默对A549周期的影响
应用流式细胞术检测FOXP3沉默后A549细胞周
期的变化,结果显示:FOXP3沉默后可诱导细胞发生G0/G1期阻滞,G0/G1期细胞百分率明显上升,与A549组和Control-siRNA组比较差异具有统计学意义(P<0.05).见图4.

*.P<0.05.图4FOXP3沉默对A549细胞周期的影响Fig.4Effects of silencing FOXP3 on the cell cycle of A549 cells
2.5 FOXP3沉默对Cyclin D1和CDK4蛋白表达的影响
应用Western blotting检测FOXP3沉默对Cyclin D1和CDK4蛋白表达的影响,结果显示:随着FOXP3蛋白的表达下调,Cyclin D1和CDK4蛋白的表达也显著下调,与A549组和Control-siRNA组比较差异具有统计学意义(P<0.01).见图5.

图5FOXP3沉默对A549细胞周期蛋白表达的影响Fig.5Effects of silencing FOXP3 on the cell cycle proteins of A549 cells
3 讨 论
本课题组前期研究[7-8]发现,FOXP3在NSCLC组织和细胞高表达,其表达与淋巴结转移和临床分期呈显著正相关关系,可通过上皮间质转化促进肿瘤细胞的迁移和侵袭,还可促进肿瘤细胞对化疗药物顺铂和5-氟尿嘧啶的耐药性.此外,FOXP3表达与Ki-67呈显著正相关关系,可促进NSCLC细胞的恶性增殖,但其作用机制尚未完全阐明.
P53基因突变与肿瘤的发生发展关系密切,约60%的NSCLC患者组织标本中可检测到P53基因的突变,其与肿瘤转移和不良预后显著相关,也是预测NSCLC转移和预后的重要指标[10-11].有研究[13]报道,FOXP3在食管鳞癌中发挥抑瘤作用,其表达与P53突变呈显著负相关关系,而FOXP3和P53突变在NSCLC中的相关性研究尚未见报道.因此,本研究采用免疫组化方法检测了FOXP3和mt-P53蛋白在NSCLC组织中的表达.结果发现,FOXP3和mt-P53蛋白在NSCLC组织高表达,阳性表达率分别为64.0%和56.0%,此结果与前面学者报道[13]基本相符,证实了二者的异常表达与NSCLC的发生发展有关.进一步研究发现,FOXP3阳性病例中P53突变率为68.8%,mt-P53阳性病例中FOXP3的阳性率为78.6%,Pearson相关分析显示二者表达呈显著正相关关系,表明FOXP3在NSCLC的促瘤作用可能与P53基因突变有着密切联系.
有研究[14]表明,P53基因突变后失去对细胞周期的正常调控,导致细胞生长失去控制,进而导致肿瘤侵袭性增强.因此,本研究推测FOXP3可能通过调控细胞周期促进NSCLC细胞的恶性增殖.为验证此假说,本研究采用siRNA干扰技术将FOXP3 siRNA转染到NSCLC细胞株A549细胞中,检测FOXP3沉默后的A549细胞增殖情况及细胞周期的变化.结果发现,A549细胞转染FOXP3 siRNA后FOXP3表达显著下调,A549细胞的增殖受到显著抑制,细胞周期阻滞于G0/G1期,表明FOXP3沉默可通过调控细胞周期而抑制NSCLC细胞的增殖.
Cyclin D1是细胞周期蛋白家族的重要成员,主要在调控细胞周期的G1期中发挥作用[15].Cyclin D1与CDK4结合形成Cyclin D1/CDK4复合物,能够调控细胞由G1期进入S期,促进细胞的增殖和分裂[16].Cyclin D1与CDK4的异常表达可导致细胞周期失去控制,且与NSCLC等多种肿瘤的发生发展及预后密切相关[17-18].因此,为探究FOXP3沉默诱发A549细胞阻滞于G0/G1期的相关机制,本研究进一步检测了FOXP3沉默后Cyclin D1和CDK4蛋白的表达变化.结果发现,FOXP3表达下调后,Cyclin D1和CDK4蛋白的表达水平也显著下调,提示FOXP3沉默后能够抑制NSCLC细胞增殖的机制可能是通过下调Cyclin D1和CDK4的表达实现的.
综上,NSCLC组织中FOXP3的表达与P53突变显著相关,NSCLC细胞中FOXP3沉默可下调Cyclin D1和CDK4表达,诱发细胞周期G0/G1期阻滞,从而抑制NSCLC细胞的增殖.
