黄酒酿造过程中氨基甲酸乙酯形成的细胞生物学基础及消减研究进展
2022-11-22娄行行周万怡芦红云陈启和
娄行行,周万怡,芦红云,陈启和*
(1 浙江大学食品科学与营养系 杭州 310058 2 浙江省农业科学院食品科学研究所 杭州 310021)
黄酒是中国传统的酒精饮料,一般是由煮熟的糯米经酵母(传统的发酵剂)发酵而成,因具有独特的风味和较高的营养价值而受到消费者的喜爱。随着经济全球化的发展,中国黄酒已出口多国。同时,随着人们生活水平的提高,对中国黄酒的品质要求也越来越高。然而,在黄酒发酵过程中,微生物种类繁多,环境复杂,会产生一些副反应,形成部分潜在风险化合物,特别是氨基甲酸乙酯(Ethyl carbamate,EC)。中国黄酒中的氨基甲酸乙酯含量明显高于其它酒精饮料(米酒、白酒、葡萄酒、啤酒)[1]。氨基甲酸乙酯又称脲烷,是发酵食品和饮料发酵过程中产生的副产品。1940年,EC曾长期被用作抗肿瘤药,实验动物的催眠和麻醉剂,以及用于白血病和静脉曲张的治疗[2-3]。随着研究深入,发现EC 在许多物种包括小鼠、大鼠、仓鼠和猴子等中都具有遗传毒性和致癌性,对人类也具有潜在的致癌风险[4]。2007年,EC 被国际癌症研究机构列为2A 类致癌物[5]。因黄酒中较高含量的氨基甲酸乙酯可能对消费者的健康产生潜在的安全隐患,故而降低其含量对黄酒产业的可持续发展具有重要意义。
EC 主要是由乙醇与N-氨甲酰化合物自发反应产生的,EC 的形成速率及最终产率取决于氨甲酰基转移及竞争性受体分子的存在与否[6]。目前已鉴定出的EC 前体物至少有5 种,即尿素、瓜氨酸、氰、氨甲酰磷酸和焦碳酸二乙酯[7]。在酿造酒中形成EC 的主要前体物质为尿素、瓜氨酸和氨甲酰磷酸。尿素是黄酒中最主要的EC 前体物,其中的EC 有90%是尿素与乙醇反应产生的[8]。黄酒中的尿素主要来源于发酵原料本身和发酵过程中酿酒酵母(Saccharomyces cerevisiae,S.cerevisiae)精氨酸代谢产生,并分泌到胞外(图1a),而过量使用氮肥也会增加原料中尿素浓度[9]。瓜氨酸是酵母和乳酸菌(Lactic acid bacteria,LAB)精氨酸代谢的中间产物(图1),主要通过发酵后期LAB 的乳酸发酵(Malolactic fermentation,MLF)产生,是EC的另一重要前体物质。研究表明,发酵酒经MLF发酵后EC 含量升高[10-11],在葡萄酒中由瓜氨酸生成的EC 含量几乎和尿素相同[12]。酿酒酵母中瓜氨酸可被精氨琥珀酸合成酶(ARG1 基因)降解[13]。研究表明,氨甲酰磷酸也能与乙醇反应形成EC。氨甲酰磷酸是酵母代谢产生的ATP、CO2和胺在氨甲酰磷酸合成酶作用下产生的[14],然而,其合成途径受发酵后期氮代谢抑制的调控,因此黄酒中的含量相对较少,能形成的EC 有限。为促进黄酒产业健康发展,多年来许多研究者致力于探究黄酒中EC 的控制方法。本文首先总结EC 主要前体物的代谢调控机制,然后,阐述通过调控EC 形成途径来消减EC 的常用方法。
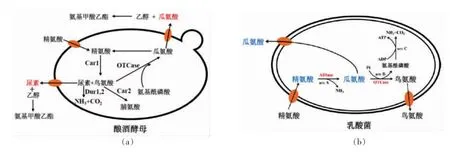
图1 (a)酿酒酵母细胞中精氨酸代谢;(b) LAB 细胞中精氨酸代谢过程Fig.1 (a) Metabolism of arginine in S.cerevisiae;(b) Metabolism pathway of arginine in LAB
1 EC 形成主要前体物的代谢调控机制
1.1 尿素的代谢调控机制
酿酒酵母细胞内的精氨酸在精氨酸酶(CAR1基因)的作用下降解产生尿素和鸟氨酸,鸟氨酸在鸟氨酸氨基转移酶(CAR2 基因)的作用下进一步分解[13]。胞内的尿素在由尿素酰胺化酶(DUR1,2基因) 激活的尿素羧化酶和脲基甲酸盐水解酶作用下水解成NH3和CO2[7]。酵母细胞内代谢产生的尿素一部分被降解,还有一部分被分泌到胞外,其分泌和重吸收是一个复杂的系统[15]。尿素的重吸收作用因其浓度不同而分为2 种途径,当胞外尿素浓度大于0.5 mmol/L 时,尿素通过促扩散系统(DUR4 基因)进入细胞,无需能量参与;低浓度条件下 (Km=14 μmol/L),尿素通过主动转运系统(DUR3 基因)重吸收[16]。有研究发现,DUR1,2 和DUR3 的表达受DAL81 和DAL82 两个GATA 家族转录因子的调控[17]。尿素的产生、外排以及重吸收受发酵原料成分、酵母菌株和酿造条件的影响[18]。精氨酸利用率高的菌株能产生更多的尿素;精氨酸浓度高会抑制尿素的重吸收作用;发酵液中的乙醇含量会抑制酵母生长及代谢物运输,高乙醇含量会抑制精氨酸代谢而减少尿素的产生和分泌、外排[15]。
1.2 瓜氨酸的代谢调控机制
LAB 菌通过精氨酸脱亚胺基酶途径(Arginine deiminase pathway,ADI)降解精氨酸产生瓜氨酸[19],如图2所示。LAB 细胞内瓜氨酸合成和分解代谢动态失衡导致瓜氨酸分泌到胞外生成EC。当精氨酸在精氨酸脱亚胺酶(Arginine deiminase,ADIase)作用下降解产生瓜氨酸(反应1)的反应速率大于瓜氨酸在鸟氨酸氨甲酰基转移酶(Ornithine transcarbamylase,OTCase) 作用下降解产生鸟氨酸和氨甲酰-P(反应2)时,瓜氨酸就被分泌出细胞外[20]。当精氨酸降解产生的ATP(反应3)超过细胞生长所需能量时,ATP 将介导抑制OTCase 的活性,使胞内瓜氨酸浓度升高而被分泌到细胞外[20]。也有少数菌株在精氨酸耗尽后重吸收再利用胞外的瓜氨酸[21]。
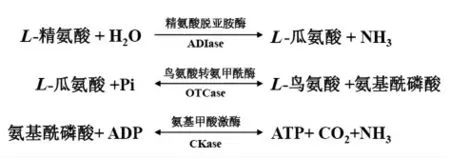
图2 精氨酸脱亚胺基酶途径Fig.2 The arginine deiminase (ADI) pathway
1.3 酿酒酵母中精氨酸的代谢调控机制
酿酒酵母细胞通过基本氨基酸透性酶(ALP1和CAN1 基因)和通用性氨基酸透性酶(GAP1 基因)吸收精氨酸转运到胞质中,Can1p 和Alp1p 的过表达可以提高精氨酸的吸收效率[22]。胞质精氨酸进一步被液泡碱性氨基酸转运蛋白Vba2p(VBA2 基因)转移到液泡中作为氮源储备[22]。
为了保障所有细胞能有效合成蛋白质,细胞溶质的氨基酸浓度必须保持在相对恒定的水平,酿酒酵母中氨基酸稳态除了从外部环境摄取和生物合成氨基酸来维持以外,还可以通过液泡氨基酸区室化来维持[23]。氮饥饿时液泡氨基酸迅速从液泡中输出到细胞质循环用于蛋白质的从头合成[24-25]。酿酒酵母中碱性氨基酸,如赖氨酸、组氨酸和精氨酸在液泡中高度浓缩,约70%~90%的碱性氨基酸积累在液泡中,而90%的酸性氨基酸,如天冬氨酸和谷氨酸都在细胞质中[26]。胞内氨基酸的分布差异表明液泡上存在氨基酸的选择性操作机制,这可能与液泡膜上存在氨基酸底物特异性主动转运蛋白有关。目前,已经鉴定并表征的涉及液泡氨基酸区室化的几个关键转运蛋白家族包括氨基酸/生长素通透家族(AAAP)和主要易化超家族(MFS),以上转运蛋白家族的发现使得从分子水平上评估液泡区室化氨基酸对胞质中氨基酸稳态的重要性成为可能,如表1所示[26-31]。

表1 酿酒酵母中液泡氨基酸转运蛋白及其分子功能Table 1 The transporters of vacuolar amino acids and its molecular function in S.cerevisiae
基于已有报道,VBA 家族转运蛋白(Vba1p,Vba2p 和Vba3p) 被鉴定是参与碱性氨基酸吸收的液泡转运蛋白[31]。Shimazu 等[31]利用酿酒酵母VBA 基因缺失突变株进行液泡膜囊泡实验,发现液泡Vba1p 和Vba3p 参与了组氨酸和赖氨酸的转运吸收,而Vba2p 参与了精氨酸、组氨酸和赖氨酸的转运吸收,且所有这些转运蛋白都属于质子/氨基酸反转运蛋白,是由液泡质子ATP 酶作用产生的质子形成电化学梯度驱动的主动转运。
2 EC 形成的调控途径与方法
2.1 优化生产工艺
黄酒中EC 前体物部分来源于生产黄酒的加工原料,糯米、辅料和水中含有精氨酸、尿素和瓜氨酸,尤其是糯米。因此可以通过精炼原料减少其中的精氨酸和尿素含量来降低EC 含量,然而精炼原料会导致原料中大量营养物质的流失,影响黄酒风味,因此不适用于黄酒的实际生产酿造。而由于过量使用氮肥也会增加原料中尿素浓度[9],因此在种植原料时,可以避免使用过多的尿素、氨和其它氮肥。发酵条件,如原料的添加量、温度、光照、pH、氧、储存时间、菌株种类、接种量、乙醇浓度和蒸馏方法,都能影响发酵过程中黄酒中尿素的量从而影响EC 的形成[32]。黄酒在装坛前需进行高温煎酒,以杀灭各种微生物,而由于尿素与乙醇生成EC 的反应强度与温度、反应时间呈正相关关系,因此往往会导致煎酒后EC 含量大幅上升。为了减少EC 生成可以适当降低煎酒温度和/或缩短煎酒时间。然而温度的降低或者缩短时间可能会导致杀菌不彻底,给黄酒带来生物稳定性风险[33]。
2.2 添加外源酶活小分子抑制剂
2.2.1 外源添加脲酶 黄酒酿造过程中通过酵母和乳酸菌等不断代谢产生EC 前体物,主要为尿素,黄酒中通过尿素产生的EC 含量约占90%。因此减少尿素的含量可以有效降低EC 含量。脲酶(EC 3.5.1.5)又称尿素酰胺水解酶,可以将尿素水解为氨和氨基甲酸酯,后者自发水解产生另一分子氨和碳酸。根据脲酶最适作用pH 的不同,脲酶被分为酸性脲酶、中性脲酶及碱性脲酶。由于酒精饮品如葡萄酒、白酒以及黄酒中含有乙醇和具有低pH 值的特性,因此所选择的脲酶在低pH 值(pH 4.0~6.0)范围内应具有催化活性,并要对乙醇具有一定的耐受能力(<20%)[34],酸性脲酶因其能在酸性条件下发挥作用而引起了人们的兴趣。在美国食品和药物管理局(FDA)推荐的几种降低氨基甲酸乙酯含量的预防措施中,添加酸性脲酶就是其中一种最方便的方法[35]。
已经有研究证明将酸性脲酶应用于黄酒去除尿素是可行的。Yang 等[34]从肠杆菌R-SYB082 中分离得到一种新型酸性脲酶并将其应用到黄酒中去除尿素,将两种不同的黄酒与酶(0.08 U/mL)在35 ℃下孵育7 d 时,尿素分解率超过85%。为了降低酶促加工成本,通过对初始葡萄糖浓度等条件的优化,可以将来自肠杆菌R-SYB082 的酸性脲酶的酶活从1 100 U/L 提高到2 504 U/L[36]。来自于罗伊氏乳杆菌(Lactobacillus reuteri)CICC6124 的酸性脲酶在黄酒模型体系中具有良好的尿素清除性能,50 U/L 的酶在20 ℃下孵育60 h,可除去黄酒中约95.8%的尿素[37]。酸性脲酶在应用过程中也受多方面的因素限制,包括酒的品种、抑制因子(酚类化合物等)的浓度及其实际应用条件。将酸性脲酶固定化可以促进酶的循环利用,具有降低成本,提高稳定性,提高对抑制因子抵抗力的优势[38]。Yang 等[39]将酸性脲酶固定在氧化石墨烯/壳聚糖微球上得到氧化石墨烯/壳聚糖脲酶珠,其在使用10 次后仍保留90%的原始活性,显示出优异的重复使用性,并且它具有较高的热稳定性和贮藏稳定性。在对脲酶进行固定化时,对选用的载体有较高要求,必须具备无毒、生物兼容性好、对蛋白黏附度高、结构稳定、再生性好、易制备、费用低等特点。因此寻找安全有效,成本较低的固定化酶载体有助于酸性脲酶在黄酒大规模工业发酵中应用。
2.2.2 外源添加小分子抑制剂 近年来,一些酚类化合物如没食子酸、原儿茶酸等被发现对黄酒发酵过程中EC 的形成具有一定的抑制作用,是一种天然的小分子抑制剂。Alberto 等[40]研究发现没食子酸和原儿茶酸可以通过抑制ADI 途径来减少精氨酸的降解,从而调控EC 前体物的产生,减少葡萄酒中EC 的形成。与此同时,也有研究指出当使用酿酒酵母作为发酵剂进行黄酒发酵时,在发酵第3 天添加没食子酸和原儿茶酸可以调节EC 分解代谢。没食子酸和原儿茶酸主要通过抑制精氨酸脱亚胺酶来减少精氨酸消耗,从而降低EC的含量,并且添加的没食子酸和原儿茶酸对氨基酸和挥发性风味化合物的产生以及酿酒酵母的生长几乎没有影响[41]。除了研究单一的酚类化合物对黄酒发酵过程中EC 含量的影响,一些含有丰富的酚类化合物的天然植物提取物也被研究。竹叶提取物含有包括没食子酸、原儿茶酸在内的多种酚酸,是一种新型的天然植物提取物。Zhou 等[42]研究了竹叶提取物在使用3 种不同发酵剂(酿酒酵母、酿酒酵母和短乳杆菌以及中国酒药)酿造的中国黄酒中对EC 形成的影响。结果表明,竹叶提取物可以通过抑制尿素/瓜氨酸与乙醇的反应,对多菌发酵黄酒中的EC 具有显著的抑制作用。同时竹叶提取物可以显著上调酿酒酵母 (S.cerevisiae)中液泡中精氨酸摄取基因(VBA2 基因)的表达,从而抑制精氨酸代谢。此外,竹叶提取物具有抗氧化、抗肿瘤等多种生物学功能[43],添加到黄酒中可以提高黄酒的整体质量。外源添加一些食源性酚酸类物质(没食子酸、原儿茶酸和竹叶提取物等)可以抑制黄酒中EC 的形成,然而将其应用到产业化生产低含量EC 的黄酒中,还需要进一步的研究。也有研究表明外源添加L-鸟氨酸盐可以抑制黄酒发酵过程中EC 形成,主要通过底物抑制原理激发OTCase 酶活来促进瓜氨酸代谢[44]。尽管如此,目前通过外源添加安全的小分子抑制剂来体外抑制黄酒酿造过程中EC 形成的研究还不是很多,值得更进一步探索。
2.3 基因工程改造选育优势发酵菌株
目前,利用基因工程手段主要通过构建低产尿素酵母或者尿素降解量高的酵母来实现对EC的调控。低产尿素酵母的构建是将酿酒酵母细胞内的精氨酸酶(CAR1 基因)敲除或者沉默来实现。研究发现敲除CAR1 基因后可以显著降低发酵酒中EC 含量,并且不会影响酿酒酵母的发酵性能[45]。同时,随着基因编辑技术的进步,利用CRISPR/Cas9 技术来完全删除CAR1 基因或在CAR1 基因座中引入无义突变来灭活酵母CAR1基因,通过这些改造得到的工程酵母菌株的精氨酸酶比活性降低了98%。与亲本酵母菌株相比,在发酵过程中CAR1 灭活的突变体形成的EC 和尿素较少,而乙醇发酵性能变化不大[46]。值得注意的是,CRISPR/Cas9 技术去除CAR1 基因时,不会在基因附近留下任何残留的基因组序列,可以最大限度地减少使用传统随机突变时发生的不需要的突变[46]。酵母尿素循环途径中的尿素羧化酶和脲基甲酸盐水解酶由同一个DUR1,2 基因编码,尿素通过DUR3 基因编码的主动转运系统被重吸收再利用,因此可以通过增强DUR1,2 和DUR3 基因的表达来增强尿素降解及吸收,减少尿素分泌,从而减少发酵过程中EC 含量。在实际发酵过程中,由于更优质氮源精氨酸的存在,尿素在胞内的降解及重吸收被抑制[15],通过将DUR1,2 基因构建到特殊基因盒子受强启动子PGK1 的调控,得到持续高效表达后,发酵液中EC 含量降低了89.1%[47]。单独过表达DUR3,同时过表达DUR1,2 和DUR3基因的研究表明,DUR3 对抑制EC 效果不显著,且过表达DUR1,2 和DUR3 基因,对EC 的抑制效果没有协同增效作用[48]。
同时,也有学者对GATA 家族转录因子进行研究,因为氮代谢阻遏效应(NCR)相关基因的转录水平受4 个GATA 家族转录因子——GLN3、GZF3、GAT1、DAL80 和1 个全局调控蛋白Ure2p的调控作用。而不同氮源被利用的优先性会受到NCR 的调控。如果利用其调控机制,对酿酒酵母使用基因工程手段进行有目的地改造,使其对尿素的利用优先性提高,就能减少EC 前体物质尿素的积累,这是控制黄酒中EC 含量的一个较新的思路[14]。焦志华[49]发现将酿酒酵母BY4741 中的DAL80 基因敲除后置于低氮和高氮条件下培养,其脲酶的酶活均较高,发酵液中尿素浓度均较低,说明DAL80 的敲除能够使得脲酶活性不受发酵原料中氮源优劣的影响。试验结果还表明,DAL80能够提高GAP1、DUR1,2、DUR3 的转录水平,且敲除DAL80 对酵母的生长无影响。而将DAL80敲除菌完全替代酒药用以黄酒发酵,EC 含量降低38.5%。
3 结论
目前,围绕中国传统发酵黄酒,尿素和瓜氨酸由于可以直接与乙醇反应生成氨基甲酸乙酯被认为是直接前体物,而精氨酸是间接前体物。本文介绍了酿酒酵母细胞中精氨酸及尿素的代谢调控机制和乳酸菌细胞中瓜氨酸的代谢调控机,并且从EC 形成的调控途径方面综述了黄酒发酵过程中控制EC 产生的方法。而现阶段探索的方法虽然能有效地降低黄酒中氨基甲酸乙酯的含量,但是基本处于研究阶段,很少能扩大规模应用于实际工业生产中。因此,在未来还要进一步探索出安全、有效、成本低廉,适于产业化、可降低黄酒中氨基甲酸乙酯的方法。
