固定化青霉素酰化酶对荧光假单胞菌群体感应的抑制作用
2022-11-22劳敏军王当丰崔方超李婷婷励建荣
申 悦,劳敏军,王当丰,崔方超*,林 洪,李婷婷,励建荣
(1 渤海大学食品科学与工程学院 生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心 辽宁锦州 121013 2 浙江兴业集团有限公司 浙江舟山 316120 3 中国海洋大学食品科学与工程学院 山东青岛 266100 4 大连民族大学生命科学学院 辽宁大连 116600)
微生物的生长代谢是导致水产品腐败的主要原因之一。在水产品腐败过程中,通常只有1 种或几种微生物起主要作用,这些细菌就是优势腐败菌(Specific spoilage organisms,SSOs)[1]。随着微生物的繁殖,细菌密度逐渐增大,细菌通过自身合成并释放自诱导物——信号分子,来调控其生物行为(如生物发光、生物被膜形成、毒力因子表达及浮游等),这一过程称为群体感应(Quorum sensing,QS)[2]。López-Martín 等[3]发现鲍曼不动杆菌的QS 系统在调节表面运动、生物膜形成和毒力方面起着重要作用。荧光假单胞菌(Pseudomonas fluorescens)是水产品贮藏过程中常见的嗜冷菌,属于好氧或兼性厌氧的革兰氏阴性细菌。因其适应性强、生长周期短、胞外酶活性高,故被公认为动物和水产品中的SSOs[4]。荧光假单胞菌能分泌N-酰基高丝氨酸内酯 (N-acyl-homoserine lactones,AHLs)作为信号分子,来调控水产品的腐败[5]。对QS 系统的干扰或破坏有助于控制许多致腐菌腐败表型的表达,从而延长水产品货架期。
通常将能够以QS 为靶标,干扰信号通路的物质称为群体感应抑制剂 (Quorum sensing inhibitors,QSIs)[6]。它们能在不杀死或不干扰细菌正常生命活动的前提下有效调控菌群的结构和功能[7]。目前QSIs 主要从3 个方面抑制QS:①通过阻断LuxI 型合酶中断AHL 信号合成;②通过群体感应淬灭酶(Quorum quenching enzymes)降解AHLs 信号传播,减少AHLs 的积累;③干扰信号受体或阻断AHL/LuxR 复合物[8]。这些方法旨在减少群体感应介导的表型表达,而不会对细菌产生其它破坏性的影响。群体感应淬灭酶中,研究最广泛的是AHL 乳糖酶和AHL 酰化酶,这两类的酶均以AHLs 为底物。AHL 乳糖酶通过水解内酯环上的酯键产生酰基高丝氨酸,使短链和长链AHLs失活。相比之下,AHL 酰化酶通常对侧链长度超过10 个碳的AHLs 最有效[9]。AHL 酰化酶可以分解AHLs 的酰胺键,产生相应的脂肪酸和高丝氨酸内酯(HSL),其作用方式与青霉素酰化酶的作用方式非常相似。通过详细的结构研究,已证实AHL酰化酶与其它青霉素酰化酶属于同一Ntn 水解酶超家族。由此可推测:青霉素酰化酶和其它Ntn 水解酶超家族酶可能具有切割AHLs 的能力[10]。2014年,Mukherji 等[11]首次报道了产自柠檬克鲁维酵母(Kluyvera citrophila)的青霉素G 酰化酶(KcPGA)活性,通过生化分析和分子对接验证了无论是否经过3-氧基修饰,KcPGA 对含6~8 个碳原子的AHLs 都具有活性。
产自巨大芽孢杆菌的青霉素酰化酶主要用来合成青霉素或头孢霉素类抗生素,为了方便工业应用[12],越来越多的研究集中于酶的性质方面。由于固定化酶灵敏度高、稳定性好、操作简单、成本低,因此被广泛应用于在食品工业中,降低了食品生产成本,也减少了生产过程中造成的污染[13]。迄今为止,尚未有文献报道固定化青霉素酰化酶对QS 的淬灭作用。本文以市售青霉素酰化酶为对象,研究其对水产腐败菌的QS 淬灭作用,以期为其在抑制水产品腐败方面的研究奠定理论基础。
1 材料与方法
1.1 菌株与试剂
紫色杆菌 (Chromobacterium violaceum 026,CV026) 为紫色杆菌ATCC 31532 的mini-Tn5 突变体,卡那霉素抗性,仅当存在外源短链AHLs(C4-HSL、C6-HSL、C8-HSL)时,菌株CV026 产生特征性紫色色素。供试菌株荧光假单胞菌(Pseudomonas fluorescens)从腐败大菱鲆中分离、鉴定。两种菌株均保藏于渤海大学食品科学学院水产品贮藏与加工研究所。
固定化青霉素酰化酶,产自巨大芽孢杆菌(酶活力:≥240 U/g),上海笛柏生物科技有限公司;卡那霉素、冰醋酸,国药集团化学试剂有限公司;乙酸乙酯,天津风船化学试剂有限公司;结晶紫,天津致远化学试剂有限公司;载玻片,江苏飞舟玻塑有限公司;LB 肉汤培养基、LB 营养琼脂,北京奥博星生物技术有限责任公司;Skim Milk 脱脂奶粉,北京索莱宝科技有限公司;琼脂糖,美国Sigma公司。
1.2 仪器与设备
SW-CJ-2FD 超净工作台,苏景集团苏州安泰空气技术有限公司;Biofuge Stratos 台式高速离心机,美国Thermo Fisher 公司;LDZX-50KB 立式压力蒸汽灭菌器,上海申安医疗器械厂;MS105UD电子分析天平,瑞士梅特勒-托利仪器有限公司;imark 酶标仪,美国BIO-RAD;Nikon80i 显微镜,日本尼康公司;Agilent 7890N/5975 气质联用(GC-MS)仪,美国Agilent 公司;LRH 系列生化培养箱,上海一恒科技有限公司。
1.3 试验方法
1.3.1 固定化青霉素酰化酶抑菌活性确定及QSIs活性检测 参考梅永超等[14]的方法略加修改,将CV026 和荧光假单胞菌过夜培养对数期(106CFU/mL),按1 ∶100 的体积比接种于LB 肉汤中(培养CV026 的LB 肉汤中需含有20 μg/mL 卡那霉素;培养荧光假单胞菌的肉汤中分别含有0,2.5,5,10,15,20,25 mg/mL 的固定化青霉素酰化酶),28 ℃,160 r/min 振荡培养16~18 h。吸取200 μL 加入不同质量浓度固定化青霉素酰化酶培养的荧光假单胞菌菌液添加到96 孔板中,用酶标仪于波长595 nm 测定OD 值,观察酶对菌株生长的影响。将用牛津杯提前放入平板中的10 mL CV026 与100 mL LB 营养琼脂培养基混合,倒平板,孔中加入不同质量浓度固定化青霉素酰化酶培养过的荧光假单胞菌上清液,以没有加固定化青霉素酰化酶培养的荧光假单胞菌上清液为空白对照,28 ℃静置培养24~48 h 后,观察紫色菌素的产生情况。
1.3.2 固定化青霉素酰化酶对紫色菌素产生的影响 根据参考文献[15],菌株CV026 过夜活化后,按1∶100 的体积比接种于含有不同质量浓度固定化青霉素酰化酶 (0,2.5,5,10,15,20,25 mg/mL)的LB 肉汤中,并加入200 μL 的AHLs 粗提液,160 r/min,28 ℃振荡培养48 h。而后依次吸取300 μL 培养液于1.5 mL 离心管中,加入150 μL 10%十二烷基硫酸钠,振荡10 s,加入600 μL 正丁醇,振荡5 s,10 000 r/min 离心5 min,吸取200 μL 紫色上清液添加到96 孔板中,用酶标仪测定OD595nm,以不加信号分子的试验组作为对照。
1.3.3 固定化青霉素酰化酶对荧光假单胞菌生物被膜的影响
1) 酶标板法测定生物被膜 将过夜培养的荧光假单胞菌,按1∶100 的体积比接种于LB 肉汤中,分装至无菌离心管,每管4 mL,加入终质量浓度为0,2.5,5,10,15,20,25 mg/mL 的固定化青霉素酰化酶,培养36 h,以没有加酶为对照,每组3次重复,具体参照孙晓佳等[16]的方法。取菌液测定波长595 nm 处的菌液密度后,弃去菌液,用无菌水清洗3 次,无菌风干燥30 min,使生物被膜固定在离心管内壁后,取1 mL 0.2%的结晶紫染色15 min。弃去染色液,无菌水清洗3~5 次至干净透明。用33%(φ)冰乙酸溶解固定着的染色液。用酶标仪测定波长595 nm 下的吸光度,每处理组取3 个平行。生物被膜的相对生成率按公式(1)计算:
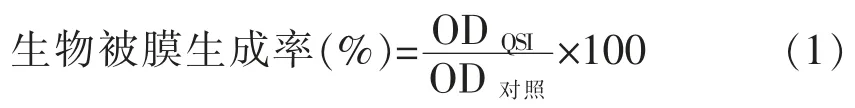
2) 光学显微镜观察固定化青霉素酰化酶对生物被膜形态的影响 载玻片(普通载玻片,25.4 mm×76.2 mm,厚度1~2 mm)预处理:置于体积分数75%乙醇溶液中浸泡24 h 后,用蒸馏水洗净、烘干,灭菌备用。
在无菌培养皿中加入10 mL 含有1%荧光假单胞菌的LB 肉汤,并分别加入终质量浓度为0,2.5,5,10,15,20,25 mg/mL 的固定化青霉素酰化酶,混合均匀后放入处理后的载玻片,28 ℃静置培养36 h。同时,设立没有添加酶的阴性对照组。36 h 后取出载玻片,无菌水冲洗,除去浮游菌及黏液,置于无菌培养皿中,加入适量甲醇固定15 min,再加入适量2%结晶紫溶液染色5 min 后,用无菌水冲洗干净,室温下干燥,干燥后在光学显微镜下观察,拍照记录。
3) 扫描电镜观察固定化青霉素酰化酶对生物被膜形态的影响 将载玻片换成锌片,前期操作同1.3.3(2),培养36~48 h。结束后用无菌水反复冲洗,洗去表面的浮菌。将锌片放入4 ℃预冷的体积分数2.5%戊二醛溶液中浸泡4 h,取出用50%,70%,80%,90%,100%的乙醇梯度脱水,自然干燥后喷金处理,用扫描电子显微镜观察。
1.3.4 固定化青霉素酰化酶对荧光假单胞菌胞外蛋白酶活力的影响 参照赵阳洁[17]的方法稍作改动,制作牛奶平板,用牛津杯打孔,加入用不同质量浓度(2.5,5,10,15,20,25 mg/mL)的固定化青霉素酰化酶过夜培养的荧光假单胞菌上清液,28℃静置培养18~24 h。蛋白酶水解酪蛋白后,在孔周围出现明显的水解圈,水解圈越大,说明胞外蛋白酶活力越高。以不加固定化青霉素酰化酶的上清液为阴性对照。
1.3.5 GC-MS 测定固定化青霉素酰化酶对荧光假单胞菌产AHLs 的影响 参照张清霞等[18]的方法稍作修改,荧光假单胞菌用400 mL LB 肉汤培养。在28 ℃,160 r/min 振荡培养24 h,5 000 r/min离心30 min 去沉淀,等体积乙酸乙酯(含体积分数0.1%冰乙酸溶液) 萃取,35 ℃旋转蒸发有机相后,用2 mL 甲醇溶解,粗提液保存于-20 ℃备用。向上述粗提液中加入固定化青霉素酰化酶使其终质量浓度为25 mg/mL,以不添加固定化青霉素酰化酶为对照。28 ℃作用40 min 后,将样品用有机滤膜过滤于GC-MS 检测确定加酶前、后AHLs 的变化情况。参照孙晓佳[19]的方法设置GC-MS条件。
1.3.6 分子对接分析青霉素酰化酶与AHLs 的相互作用 将PDB 数据库中获得的青霉素酰化酶(产自巨大芽孢杆菌)6nvy 的3D 结构,使用Discovery Studio(DS)软件进行3D 蛋白结构的优化。从ZINC 数据库 (http://zinc.docking.org/) 中得到C4-HSL、C6-HSL、C8-HSL、C10-HSL、C12-HSL、C14-HSL 的3D 结构,在DS 软件中优化结构后,采用半柔性对接分析酶和配体之间的作用方式,以及酶对不同碳链的AHLs 的作用差异[20]。
2 结果与分析
2.1 固定化青霉素酰化酶QS 抑制活性的确定
经过测定培养结束后的菌液密度,发现添加不同质量浓度的固定化青霉素酰化酶对荧光假单胞菌的生长没有影响。因此直接选取培养后的上清液加入孔中与培养基中的CV026 作用,结果如图1所示。当荧光假单胞菌同25 mg/mL 的固定化青霉素酰化酶培养后,使得CV026 产生紫色菌素不明显,说明固定化青霉素酰化酶可能减少了荧光假单胞菌中的信号分子的产量。

图1 固定化青霉素酰化酶对CV026 紫色菌素的抑制作用Fig.1 Inhibition of immobilized penicillin acylase on CV026
2.2 固定化青霉素酰化酶对CV026 紫色菌素产生的影响及最小抑紫浓度的确定
通过观察CV026 产紫色菌素的差异性能够看出不同酶浓度对QS 的干扰程度不同,从图2a中能够直观看出酶添加量越多紫色越浅,说明固定化酰化酶的QSI 活性呈剂量依赖性。从颜色变化来看,与不加酶的对照组相比,5 mg/mL 固定化青霉素酰化酶处理可以明显降低紫色菌素的产量。从图2b 可知,随着酶质量浓度的增大,紫色菌素逐渐减少,当酶质量浓度为25 mg/mL 时,对紫色菌素的抑制率达到38.63%,由此推断固定化青霉素酰化酶可通过干扰QS 现象,使得在外源AHLs 存在的情况下,抑制CV026 紫色菌素的产生。可以推测固定化青霉素酰化酶可通过降解AHLs 达到抑制腐败菌间信息交流的目的,从而减少致腐因子的产生以达到水产品保鲜的效果。

图2 固定化青霉素酰化酶对CV026 的QSI 效应Fig.2 QSI effect of immobilized penicillin acylase on CV026
2.3 固定化青霉素酰化酶对荧光假单胞菌生物被膜的影响
2.3.1 固定化青霉素酰化酶对荧光假单胞菌生物被膜形成量的影响 生物被膜的形成是水产品污染的常见来源。研究发现有氧冷冻条件下贮藏时,QS 会参与新鲜肉制品的腐败以及其表面生物被膜的形成[21]。从腐败食品中分离到的荧光假单胞菌具有快速产生生物膜的特性[22]。从图3中可看出,固定化青霉素酰化酶的添加并没有对荧光假单胞菌的生长造成影响,随着酶质量浓度的升高,生物膜的生成率逐渐减小,当酶质量浓度为25 mg/mL 时,对生物被膜形成的抑制率达到57.41%。由此可知固定化酰化酶能够有效抑制荧光假单胞菌生物膜的形成,减少其在水产品表面定殖。
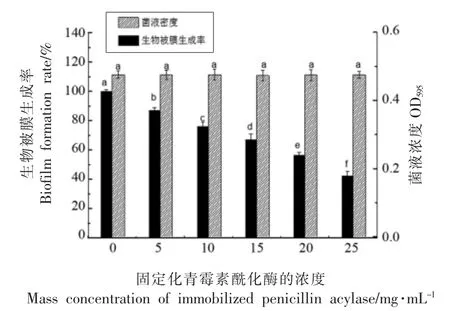
图3 不同质量浓度固定化青霉素酰化酶对荧光假单胞菌生物被膜形成率的影响Fig.3 Effects of different mass concentrations of immobilized penicillin acylase on biofilm formation rate of P.fluorescens
2.3.2 固定化青霉素酰化酶对荧光假单胞菌生物被膜形态的影响 通过光学显微镜可以观察到不同质量浓度的固定化青霉素酰化酶培养后的荧光假单胞菌生物被膜形态的微观结构。从图4a 可看出随着固定化青霉素酰化酶质量浓度的升高,生物膜的形成量逐渐减少。未加固定化青霉素酰化酶的荧光假单胞菌的生物被膜中密布的菌体连接成紧密的膜状物。随着酶浓度的升高,菌体越来越稀疏,生物被膜的产量难以在载体上牢固附着,因此菌体无法聚集形成膜状物。由此推断固定化青霉素酰化酶能够降低荧光假单胞菌生物被膜的形成量,从而减少其在水产品表面的附着,从而达到延缓腐败的效果。

图4 固定化青霉素酰化酶对荧光假单胞菌生物被膜的影响Fig.4 Light microscope observation of the effect of immobilized penicillin acylase on P.fluorescens biofilm
通过扫描电镜能够更加直观的观察到生物膜表面的结构情况。从图4b 中可看出没有加酶的对照组菌体形态最为致密,结构均匀,具有一定的层次感,无法看到单一菌体。添加不同质量浓度固定化青霉素酰化酶培养后,随着酶质量浓度增大,生物被膜出现了破裂,失去原有的立体网格结构,单一菌体周围的膜包围状物逐渐消失,当酶质量浓度为25 mg/mL 时,出现了明显单菌,表明固定化青霉素酰化酶能够有效减弱荧光假单胞菌的成膜能力。与生物被膜形成量的测定结果一致,证实了固定化青霉素酰化酶对荧光假单胞菌生物被膜的影响,推测其可能通过调控了QS 相关基因的表达,有效减少了胞外聚合物的生成。
2.4 固定化青霉素酰化酶对荧光假单胞菌胞外蛋白酶活性的影响
假单胞菌具有较强的水解蛋白质和脂肪的能力,可以产生吲哚、苯酚、腐胺、尸胺、硫化氢等有毒物质,并导致水产品产生感官不可接受性的黏液、异味[23]。通过测定胞外蛋白酶的变化,能够了解固定化青霉素酰化酶对荧光假单胞菌胞外酶蛋白酶表达量的影响。试验结果如图5所示,随着酶质量浓度的增加,透明圈逐渐减小,且当添加15 mg/mL 酶后,可以完全抑制胞外蛋白酶的活性。由于QS 是一个转录调控系统,可能通过调控编码胞外蛋白酶的基因转录来实现对胞外蛋白酶表达的干预[24]。Li 等[25]发现铜绿假单胞菌中的QS 系统会干预其3 种胞外蛋白酶的表达,通过构建QS 突变体研究,表明QS 系统不只是通过转录来调节这些蛋白酶的活性,即使这些蛋白酶从细胞中分泌出来,QS 系统仍然控制着它们的活性。基于固定化青霉素酰化酶的功能,可以推测通过淬灭AHLs可抑制胞外蛋白酶的表达,而不影响其活性。

图5 固定化青霉素酰化酶对荧光假单胞菌胞外蛋白酶活性的影响Fig.5 The effect of immobilized penicillin acylase on the extracellular protease activity of P.fluorescens
2.5 GC-MS 测定固定化酰化酶对荧光假单胞菌分泌AHLs 的影响
通过GC-MS 可以直观看出样品中AHLs 的变化。从图6a 中可以看出供试菌株荧光假单胞菌主要产3 种信号分子,根据课题组前期的研究结果表明,出峰时间在6,8,11 min 左右所对应的AHL 分别为C6-HSL、C8-HSL、C10-HSL。由图6b 中可看出3 种AHLs 都有下降趋势,其中C8-HSL 下降最多,说明固定化青霉素酰化酶对C8-HSL 的降解活性最强。张争等[26]从植物病原菌青枯菌中鉴定出了的1 种AHL 酰化酶Aac 淬灭细菌的群体感应信号,控制细菌性病害,对C8-HSL 有较强的淬灭活性。
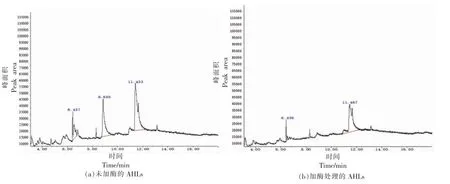
图6 GC-MS 检测固定化青霉素酰化酶对荧光假单胞菌产AHLs 的影响Fig.6 Effect of immobilized penicillin acylase on AHLs production by P.fluorescens detected by GC-MS
2.6 分子对接分析青霉素酰化酶与AHLs 的相互作用
分子对接是借助计算机模拟酶与底物之间的相互作用,预测其结合位点和结合强度。通过将酶与不同的底物对接可预测出与酶有相互作用的底物,为下一步试验验证提供理论依据。从表1可看出不同碳链的AHLs 与酶对接的打分情况,其中C14-HSL 的打分最高。有研究表明已知的大多数细菌AHL 酰化酶是N 端亲核酶(Ntn)-水解酶的成员,这类酶由多种酶组成,它们识别不同种类的底物,然而具有共同的性质,如自动催化活化、N 端催化亲核(苏氨酸、丝氨酸或半胱氨酸)的存在和酰胺键的断裂,青霉素酰化酶也是其中的一员[28]。具有AHL 酰化酶功能的青霉素酰化酶对长链的AHLs 作用效果较好,一般都是含有α 和β 2 个亚基的二聚体,在α 亚基上都含有1 个保守的丝氨酸活性位点,该位点与周围的氨基酸残基盘曲折叠成一个疏水结合囊,更适合与长链AHLs 结合,因此与短链的AHLs 作用力较弱[28]。从表1可知随着碳链长度的增加,分值越来越大,说明该酶的最佳底物更偏向于长链AHLs。

图7 固定化青霉素酰化酶对荧光假单胞菌AHLs 的影响Fig.7 Effect of immobilized penicillin acylase on AHLs of P.fluorescens

表1 青霉素酰化酶(产自巨大芽孢杆菌)与AHLs 分子对接打分Table 1 Molecular docking score of penicillin acylase (from Bacillus megaterium) and AHLs
从上述打分结果中选择短链、中长链、长链3种AHLs 进行作用力分析,结果见图8。图中呈现了青霉素酰化酶6nvy 与C4-HSL、C8-HSL、C14-HSL 对接的活性位点2D 图。可以看出AHLs 与酶之间的相互作用力,C4-HSL 与活性位点中A 链的天冬酰胺形成2 个氢键;C8-HSL 与活性位点中A链上的丝氨酸和天冬酰胺形成3 个氢键,与缬氨酸形成1 个碳氢键;C14-HSL 与活性位点中A 链上的苏氨酸、酪氨酸和丝氨酸形成3 个碳氢键。仅依靠2D 图无法确定酶与底物间的空间构象,也无法确定酶对长链AHLs 偏好的原因,故又对C4-HSL 和C14-HSL 与酶结合的3D 图进行分析。
图8b 分别显示了短链和长链AHL 与青霉素酰化酶分子对接的3D 图,从中可看出C4-HSL 与酶的结合没有C14-HSL 紧密。C14-HSL 被结合囊周围的氨基酸残基全部包裹,相互以氢键连接,与C4-HSL 相比,氢键的数量较多。可能是由于C14-HSL 具有更长的碳链,能够形成更多氢键。

图8 青霉素酰化酶6nvy 与AHLs 结合活性位点示意图Fig.8 Schematic diagram of binding active sites of penicillin acylase 6nvy with AHLs
3 结论
本文研究了固定化青霉素酰化酶(产自巨大芽孢杆菌)对荧光假单胞菌的QS 抑制作用。通过紫色杆菌CV026 验证了不同质量浓度固定化青霉素酰化酶对荧光假单胞菌AHLs 的抑制作用,表明酶的加入能够使紫色菌素的产量减少,当质量浓度为25 mg/mL 时,抑制率达到38.63%。在酶的作用下,荧光假单胞菌的生物被膜和胞外蛋白酶活力均受到影响,且呈浓度依赖性,当酶质量浓度为25 mg/mL 时,对生物被膜形成的抑制率达到57.41%;当酶质量浓度为15 mg/mL 时,完全抑制了胞外蛋白酶的活性,推测是由于酶的加入干扰了荧光假单胞菌的QS 系统,使得蛋白酶的表达受到影响。GC-MS 结果表明,酶能够降低荧光假单胞菌的AHLs,从而进一步证明酶是通过与AHLs作用来干扰QS。分子对接结果表明酶对长链和短链AHLs 都有作用,然而更偏好长链AHLs。3D 对接图显示酶的活性中心会与C14-HSL 形成更多的氢键,从而增大两者间的相互作用。前人已经研究发现多种青霉素酰化酶都有淬灭AHLs 的作用,并且已经利用蛋白质工程的方法来生产更加稳定、特异性和活性更强的AHLs 淬灭酶[29],本文中酶与荧光假单胞菌的AHLs 作用后的产物还未清晰,需要进一步验证其作用机理。
