星形胶质细胞瘤分泌一氧化氮促进炎性水肿带相关肿瘤微环境的研究*
2022-11-22李春涛张其健张李洋付思祺曾
李春涛 张其健 张李洋 付思祺曾 瑜**
(1)中南大学湘雅医院神经外科,长沙 410008;2)中南大学湘雅医院伤口中心,长沙 410008;3)中南大学湘雅二医院皮肤科,表观遗传湖南省重点实验室,长沙 410011;4)国家老年病学临床医学研究中心,长沙 410008)
脑胶质瘤是神经外科最常见的原发性颅内肿瘤,根据WHO病理分级分为I~IV级[1]。随着影像学的发展,磁共振扩散加权成像(diffusionweighted imaging,DWI)能更清楚地区分肿瘤组织、水肿组织及正常的脑组织。对于低级别的胶质瘤,磁共振波谱分析(magnetic resonance spectroscopy,MRS)提示肿瘤组织的萘乙酸(1-naphthylacetic acid,NAA)和胆碱(choline,Cho)比值显著高于瘤周水肿组织[2]。而胶质瘤侵袭的范围已远超出影像所显示的肿瘤边界。目前认为,胶质瘤相关的水肿,尤其是瘤周的脑水肿促进了胶质瘤细胞的侵袭,并显著影响胶质瘤的预后[3]。炎症所导致的胶质瘤微环境变化与胶质瘤的生长与治疗相关[3-4]。因此,胶质瘤手术切除后周围水肿组织是胶质瘤治疗与预后的重要研究方向。前期研究通过对大样本临床病例检测诱导性一氧化氮合酶(inducible NOS,iNOS),发现iNOS的表达情况不仅与恶性肿瘤是否发生转移密切相关,而且恶性肿瘤颅内转移的病例中,转移灶明显呈现iNOS高表达[5]。本研究拟通过对胶质瘤临床病例的肿瘤组织和水肿带中蛋白质及一氧化氮(nitric oxide,NO)的检测和标定,探讨星形胶质细胞瘤分泌NO促进炎性水肿带相关肿瘤微环境的作用。
1 材料与方法
1.1 仪器与试剂
Thermo Finigan TSQ Quantum Discovery Max型液相色谱-三重四极杆串联质谱仪,Xcalibur高级色谱工作站(赛默飞,美国)。Mettler电子天平(梅托勒,瑞士);AllegraTM 64R台式高速冷冻离心机(贝克曼,美国);涡旋混合器(赛默飞,美国);TTL-30超纯水器(北京同泰联,中国)。甲醇为色谱纯,甲酸为分析纯,超纯水(TTL-30超纯水器自制),氯化胺缓冲液,硫酸锌溶液(0.42 mol/L),乙酸锌溶液,10.6%亚铁氰化钾溶液;氢氧化钠溶液(20 g/L),对氨基苯磺胺酸溶液,N-1-萘基乙二胺溶液(1 g/L),以上试剂均购自德国默克公司。亚硝酸钠标准溶液配置:准确称取250 mg于硅胶干燥器中干燥24 h的亚硝酸钠,加水溶解移入500 ml容量瓶中,加100 ml氯化铵缓冲液,加水稀释至刻度混匀,在4℃避光保存。亚硝酸钠标准使用液:临用前,吸取亚硝酸钠标准溶液1 ml,置于100 ml容量瓶中,加水稀释至刻度此溶液每毫升相当于5 μg亚硝酸钠。显色剂:临用前将N-1-萘基乙二胺溶液(1 g/L)和对氨基苯磺胺酸溶液等体积混合。
1.2 胶质瘤患者标本的收集和准备
选取2018年1月至2020年1月中南大学湘雅医院神经外科诊治的初次手术且术前未进行放化疗等特殊处理、术后经病理检验证实为星形胶质细胞瘤的标本27例(WHO II级10例、II-III级7例、IV级10例)。所有患者均签署知情同意书并获得了中南大学湘雅医院伦理委员会批准(No.201703478)。取肿瘤水肿带组织加入生理盐水,采用组织匀浆器制成浓度为0.5 kg/L的组织匀浆,加入内标30 µl,涡旋后,加入乙醚-正己烷(4∶1)4 ml,涡旋3 min,3 500 r/min离心10 min。吸取上层有机相于另一离心管中,40℃水浴氮气吹干;下层液体再加入有机溶剂4 ml(乙醚-正己烷4∶1)提取,得到有机相,合并两次有机相,氮气吹干,残渣用200µl流动相溶解,取10µl进样分析。所有样本均进行NO检测。
1.3 高效液相色谱质谱联用(HPLC-MS/MS)条件
色谱柱为Lichrospher C18色谱柱(2.1 mm×100 mm,5 µm);流动相:甲醇-0.1%甲酸的5 mmol/L乙酸铵=70∶30;流速:0.2 ml/min;柱温:35℃,进样量10µl。质谱条件:离子检测方式为选择性离子检测(SRM);离子极性为正离子;离子化方式为气动辅助电喷雾离子化(ESI);以多反应离子监测方式检测。每个级别取5例样本进行质谱分析。所有的测定值均在正离子模式下检测,一级扫描MS 8 100 amu/s,二级扫描MS 26 000 amu/s。质谱鉴定的结果在DateAnalysis处理后,采用Mascot软件搜库。
1.4 格里斯试剂比色法(Griess reagent)
称取约10 g经绞碎混匀肿瘤水肿带样品,置于打碎机中,加70 ml水和12 ml氢氧化钠溶液(20 g/L),混匀,用氢氧化钠溶液(20 g/L)或盐酸溶液(6 mol/L)调样品pH=8.0,定量转移至200 ml容量瓶中,加10 ml硫酸锌溶液,混匀,如不产生白色深沉,再补加2~5 ml氢氧化钠,混匀。置60℃水浴中加热10 min,取出后冷至室温,加水至刻度混匀。放置0.5 h,滤纸过滤,弃去初滤液20 ml,收集滤液备用。吸取10 ml上述滤液于25 ml带塞比色管中,于管中分别加入4.5 ml氯化铵缓冲液,加2.5 ml 60%乙酸后立即加入5 ml显色剂,加水至刻度,混匀,在暗处静置25 min,用1 cm比色杯(灵敏度低时可换2 cm比色杯),以零管调节零点,于波长550 nm处测吸光度。同时做试剂空白。
1.5 信号通路预测
通 过ClusterProfiler包 以 及Proteomaps和Metascape网页工具进行富集分析,分析BioCarta、KEGG通路和GO功能注释,根据HPLC-MS/MS结果,使用上述方法对蛋白质或对应的基因集进行富集分析,得到富集的功能注释及通路结果。
1.6 量化和统计分析
所有数据值均以平均值±SEM表示。两组数据的比较使用Student-t检验进行分析。P<0.05被认为是显著的。
2 结 果
2.1 星形胶质细胞瘤水肿带中富含炎症相关蛋白质
磁共振成像显示15例代表性星形胶质细胞瘤患者水肿带,黄色圆圈为手术取材部位(图1)。高效液相色谱质谱联用检测上述15例星形胶质细胞瘤患者水肿带组织成分,提示其富含大量炎性蛋白质,随着肿瘤病理级别的升高,色谱质谱波峰更多,提示高级别星形胶质细胞瘤水肿带中蛋白质成分更复杂(图2a)。这些蛋白质中和炎症相关的代表性蛋白质包括:细胞色素C氧化酶(cytochrome coxidase,COX)、热休克蛋白(heat shock protein,HSP)、CD44抗 原、白 介 素-8(interleukin-8,IL-8)、白介素-24(interleukin-24,IL-24),凝溶胶蛋白(gelsolin,GSN)、应激诱导磷酸蛋白1(stress-induced-phosphoprotein 1,STIP1)、丝裂原活化蛋白激酶1(mitogen-activated protein kinase 1,MAPK1)、硫氧还蛋白过氧化物酶(peroxiredoxin,PRDX)、S100蛋白、超氧化物歧化酶(superoxide dismutase,SOD)等(图2b)。
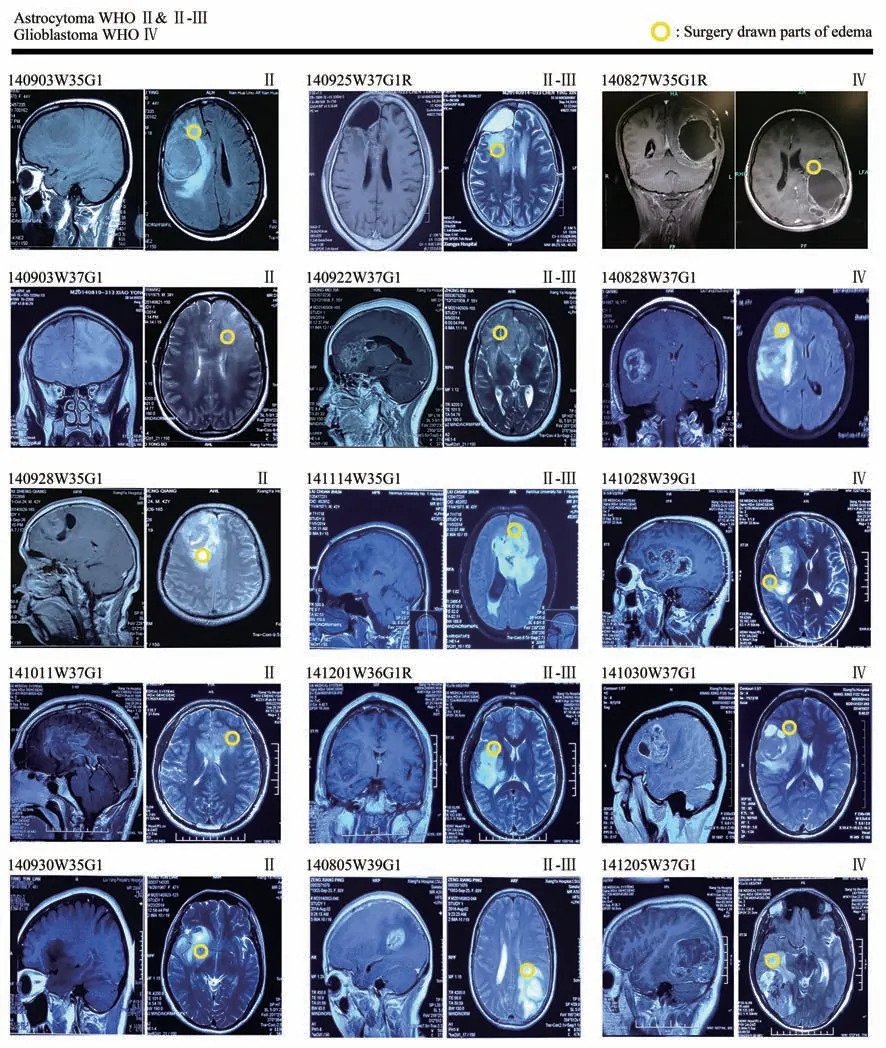
Fig.1 The edema zone and sampling position of patientsThe magnetic resonance imaging(MRI)edema zone of WHO grade II,II-III,IV astrocytoma patients and sampling position(yellow circle).

Fig.2 The protomics analysis of astrocytoma by HPLC-MS/MS
2.2 星形胶质细胞瘤组织中NO的含量高于水肿带
通过对所有星形胶质瘤临床病例的肿瘤组织和水肿带中NO的检测和标定,发现胶质瘤组织中NO的含量高于水肿带,差异有统计学意义(P<0.000 5)(图3)。

Fig.3 The nitric oxide expression in 27 cases of astrocytoma edema zone and tumor tissues
2.3 HPLC-MS/MS结果的富集分析
基于HPLC-MS/MS的结果,通过多种方法对结果蛋白质/基因进行了富集分析。BioCarta基因集提示这些蛋白质高度参与柠檬酸代谢途径(citric acid/KREB pathway)。与II-III级别星形胶质细胞瘤相比,Ⅳ级星形胶质细胞瘤水肿带中的基因更多地参与无氧代谢,如糖酵解(glycolysis)。更重要的是,这些目标基因显著参与多种氧化还原反应,如氧化还原酶活性(oxidoreductase activity)和过氧化物酶活性(peroxiredoxin activity)。诱导性一氧化氮合酶负责催化L-精氨酸和分子氧反应产生NO。NO作为一种信使分子,在全身发挥不同的功能。并可介导环氧化酶(cyclooxygenase,COX)等细胞质靶蛋白的半胱氨酸S-亚硝基化。NO分子和NO合成代谢过程中生成的NO2、NO2-、NO3-和过氧亚硝基阴离子(peroxynitrite anion,ONOO-)等含氮自由基,被统称为反应性氮代谢物。其中,iNOS、NO、ONOO-以及SOD1在氧化还原反应中发挥重要作用(图4)。
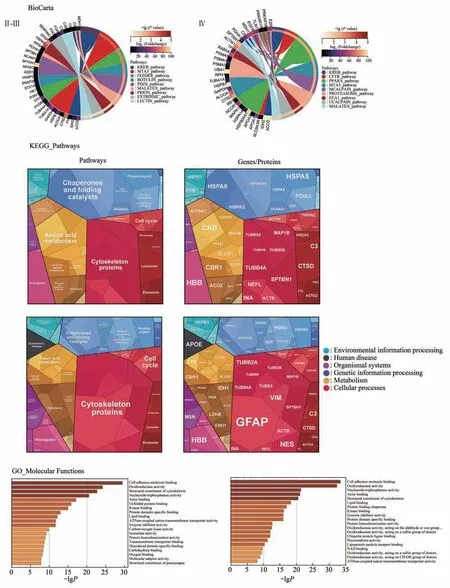
Fig.4 Gene functional analysis
3 讨 论
3.1 星形胶质细胞瘤周围的水肿带是肿瘤引起炎症反应改造的微环境
Wang等[3]分析了22例胶质瘤水肿带的组织病理学特征,发现水肿组织的主要成分是分散的侵袭性肿瘤细胞、反应性细胞和各种血管组织。高级别胶质瘤的侵袭性肿瘤细胞密度显著高于低级别胶质瘤,且靠近胶质瘤区域的肿瘤细胞密度显著高于远离胶质瘤区域的肿瘤细胞密度。瘤周水肿带是肿瘤细胞侵袭导致的组织重建的结果,是胶质瘤细胞生长和扩散的合适生态位,胶质瘤是沿着神经纤维束浸润和播散的[6]。Henderson等[7]发现胶质瘤细胞的浸润和水肿经常难以完全区分,他们使用DTI数据可以区分水肿和低度恶性肿瘤(敏感性91.7%,特异性86.4%),提出了一种基于多DTI参数补充信息和空间归一化的肿瘤浸润概率图。该课题组进一步研究发现,这种水肿校正方法可以改善胶质瘤相关瘤周水肿患者神经纤维运动束和语言束的可视化[8],这在一定程度上可以帮助医生更好地切除肿瘤。因此,胶质瘤周围的水肿带,是肿瘤细胞引起的炎症反应形成的一种有助于肿瘤浸润的微环境。
3.2 合成和分泌NO是星形胶质瘤细胞改造周围炎性肿瘤微环境的重要方式
NO是机体内的重要信使分子和效应分子,不仅参与众多生理过程,还可通过影响肿瘤抗药性、逃避凋亡、促进增殖、促进血管新生等效应发挥促瘤作用[9]。NO的作用十分复杂,可影响肿瘤的生物学行为与炎症反应,有时候呈促进作用而有时呈抑制作用[10]。这种抗肿瘤和促肿瘤的双重关系被认为是浓度依赖性的,也取决于细胞的类型与细胞的生存环境[11-12]。在中枢神经系统的损伤和疾病中,高剂量的NO释放,能导致ONOO-和其他活性氮自由基的形成,二者可以使蛋白质的酪氨酸硝基化,形成3-硝基酪氨酸(3NY),引起细胞的死亡[13]。
利用经典的格里斯试剂检测亚硝酸盐含量,证实在胶质瘤的肿瘤组织及水肿带中存在NO。胶质瘤的肿瘤组织中NO含量高于周围水肿带,从侧面证实肿瘤细胞中的一氧化氮合酶的活性是明显高于肿瘤周围组织的。这一结果与Lam-Himlin等[14]的研究一致。课题组前期发现并报道,在其他恶性肿瘤(肺癌)的颅内转移病例中,iNOS与恶性肿瘤是否发生转移密切相关,并且在肿瘤颅内转移灶呈现高表达[5]。NOS广泛存在于神经系统内,目前已发现存在3个亚型:神经元型一氧化氮合酶(neuronal NOS,nNOS)、内皮型一氧化氮合酶(endothelial NOS,eNOS)以及iNOS[15]。在炎症反应中,NO主要由激活的iNOS合成产生[16]。iNOS在炎症和神经退行性疾病的发病机制中,及胶质瘤的发生和进展过程中,发挥重要的作用[16-17]。iNOS诱导参与多种癌症的恶性增殖和肿瘤进展,如胶质母细胞瘤。iNOS是星形胶质细胞恶性激活的关键调节因子,它可以诱发神经炎症和胶质瘤生成[17]。本课题组在对不同分级的星形胶质细胞瘤的水肿带,进行蛋白质组的研究中,均发现有SOD-1的表达存在。SOD-1是一种含量丰富的32 ku同二聚体抗氧化酶,能将超氧化物转化为过氧化氢。SOD-1的表达与胶质瘤的恶性程度成反比[18],过表达SOD-1能够促进肺癌细胞生长、抑制其凋亡[19]。
Kato等[20]研究发现,41例胶质母细胞瘤样本中16例免疫组化阳性,iNOS阳性的样本常常SOD1或SOD2阳性,尤其是iNOS的表达和SOD1的表达显著相关。研究发现NO可以通过抑制半胱氨酸依赖的SOD1单体化来增强SOD1活性并抑制氧化应激[21]。另外,科学家们也发现NO对血管细胞中氧化还原环境的影响,NO可快速刺激血管细胞中SOD-1基因的表达,进而引起SOD-1蛋白的高表达,伴随氧化应激分子标志的表达和O2-水平的下降。升高的SOD-1还抵消了NO抗细胞增殖的效应。但是,这种SOD-1蛋白水平在内皮细胞和外膜成纤维细胞中并未增加[22]。这说明,NO对于SOD-1的影响在不同细胞中亦有所不同[23]。另外,在高级别胶质瘤中SOD-1蛋白表达水平低,这与放疗后的胶质瘤SOD-1的高表达形成对比。体外实验中人脑胶质瘤细胞系U251的抗辐射变异也表现出较高的SOD-1表达[24]。
细胞周期蛋白依赖性蛋白激酶5(cyclindependent kinase 5,Cdk5)在神经系统发育及成熟阶段,通过磷酸化细胞骨架蛋白、信号分子以及调节蛋白等众多底物蛋白的特异性丝/苏氨酸位点,而在神经元的迁移分化、存活和突触的发生、信息传递、可塑性等诸多方面起到了重要的作用。单体Cdk5无活性,需要与p35等因子结合才能被激活,Cdk5特异性磷酸化其底物蛋白的丝氨酸和苏氨酸位点[25]。在如炎症、氧化应激和兴奋性毒性刺激等促发钙稳态失衡或兴奋性毒性的情况下,p35可被特定蛋白酶(如钙蛋白酶(calpain))剪切,失去锚定在细胞膜上的氨基端序列,形成半衰期更长的p25[26-27],Cdk5与p25结合,形成的复合体主要是使细胞骨架蛋白异常磷酸化,进而调控细胞凋亡[27-28]。而SOD-1可以通过抑制Cdk5/p35通路,来维持神经元细胞骨架的完整性[29]。结合数据库分析,提示星形胶质瘤中肿瘤细胞有可能是通过iNOS-NO-ONOO--SOD-1细胞死亡来改造肿瘤周围微环境。
本研究具有一定的局限性。首先,样本量偏少,一共只有27例,质谱分析各个级别只选取了5例作为代表性样本。其次,生物信息学分析的结果和作用机制需要进一步通过实验来验证。
综上所述,星形胶质细胞瘤的肿瘤周边水肿带,可能是肿瘤细胞对周围微环境的一种主动改造。肿瘤细胞通过高表达iNOS,合成并对外分泌大量的NO,NO形成的ONOO-将周围脑组织的组织间隙、神经元等细胞中的SOD-1消耗,产生过氧化细胞毒性,形成利于肿瘤细胞生长和侵袭的炎性肿瘤微环境。
4 结 论
星形胶质细胞瘤周围水肿带的形成是炎症反应的结果,胶质瘤细胞通过分泌NO调控SOD-1等炎性分子促进侵袭性炎性肿瘤微环境的形成。
