星形胶质细胞调节性容积减小(RVD)的关键膜蛋白研究进展*
2022-11-22周佐邑高嘉琪高凯龚艳君于常海
周佐邑高嘉琪高凯龚艳君于常海
(1)北京大学第一医院心血管内科,北京 100034;2)北京大学第一医院儿科,北京 100034;3)北京大学基础医学院,神经科学研究所,北京 100191;4)北京大学第三医院消化内科,北京 100191)
水约占大脑重量的80%,水平衡是脑部生理活动的重要基础,同时,水平衡的紊乱也是脑部疾病发生发展的重要机制之一[1]。宏观层面上看,脑浸润 于脑 脊液(cerebrospinal fluid,CSF)中,CSF主要由位于脑室的脉络丛产生,同时也来自脑微循环以及脑部细胞代谢产生的水[2-3]。CSF循环于脑室和蛛网膜下腔中并最终主要由蛛网膜粒吸收,维持颅内压的相对稳定[2,4]。因颅骨的解剖学限制,在有限的颅内空间中,液体的增多(如脑脊液回流不畅、脑水肿)会极大增加颅内压,引起继发损伤和威胁生命的并发症[5]。微观层面上,神经元和多种神经胶质细胞生存的细胞外环境为脑部组织液(interstitial fluid,ISF),复杂的神经电活动依赖于神经递质和受体的结合以及细胞内外的离子转移,轻微的细胞容积或细胞外空间(extracellular space,ECS)容积变化都可能会影响局部神经递质及离子浓度,进而影响神经元信号传输等功能。病理情况下,脑细胞水肿使得ECS减小,导致兴奋性神经递质谷氨酸和类似物质在ECS中的累及,进而可能导致兴奋性毒性等损伤[6]。因此,维持脑的水平衡是至关重要的。
星形胶质细胞是脑内数目最多的细胞类群之一[7],近年来的研究显示,星形胶质细胞在脑内发挥多种重要功能,包括构成血脑屏障(BBB)、支持营养神经元、调节突触形成和成熟以及参与神经信号的传递等[8-11]。其中,星形胶质细胞的一项基本功能是监测和维持脑部细胞外微环境的稳定,包括水电解质平衡[12-14]。生理状态下,星形胶质细胞可以通过快速改变自身局部容积,介导水和离子的再分布,是神经活动中突触间隙过量钾离子清除的主要机制[15-17]。在脑缺血缺氧、脑外伤、肝性脑病、癫痫等多种疾病情况中,星形胶质细胞会首先并最显著地出现水肿[6,18-20]。星形胶质细胞水肿造成的细胞外液与细胞内环境的离子梯度,是脑水肿病理过程进展的重要推动力[19];同时,肿胀的星形胶质细胞压迫毛细血管微循环,也加剧了局部缺血缺氧损伤[5]。
应对水肿,星形胶质细胞可通过调节性容积减小(regulatory volume decrease,RVD)的方式代偿性快速减小自身部分容积。RVD是多种细胞在水肿时通过离子或中性渗透物的跨膜流动使水从细胞内向细胞外转移进而恢复自身原有容积的一种代偿机制,在不同的细胞中,根据其各自表达的膜蛋白不同,引起RVD的机制也不甚相同[21]。星形胶质细胞RVD的确切机制,目前仍未被完全揭示。早期观点认为,TRPV4(transient receptor potential vanilloid 4)介导的钙离子内流激活下游信号通路是星形胶质细胞RVD的关键驱动力[22],但后续研究通过药物抑制TRPV4功能或去除细胞外液钙离子等方式发现,阻断TRPV4介导的钙离子内流并未影响星形胶质细胞RVD过程,提示TRPV4介导的钙离子内流并非星形胶质细胞RVD发生的必要条件[23-24]。近年来,更多研究表明体积调节性阴离子通道(volume-regulated anion channel,VRAC)介导的阴离子外流是星形胶质细胞RVD的主要驱动力[25-27]。水从星形胶质细胞内转移至细胞外的这一过程,也并非简单的跨膜自由扩散,而是通过水通道蛋白(aquaporin,AQP),尤其是水通道蛋白4(AQP4),所进行的快速转移[24]。表1按时间顺序列举了星形胶质细胞RVD的关键研究进展。进一步了解VRAC和AQP的结构、功能特点及其在星形胶质细胞RVD中如何发挥作用,是理解星形胶质细胞RVD机制以及病理状态下RVD无法代偿机理的关键,有助于发现脑水肿治疗的潜在靶点,本文的后半部分将分别围绕VRAC及AQP进行具体介绍。

Table 1 Milestones in the research of astrocyte RVD表1星形胶质细胞RVD关键研究进展年表
1 体积调节性阴离子通道(VRAC)
早在20世纪80年代,细胞水肿激活的阴离子外流就首次在人外周血单核细胞中被报道并被认为是单核细胞RVD的关键因素[28]。此后,VRAC被发现广泛存在于脊椎动物的细胞中[37]。细胞水肿时,VRAC受到激活,介导氯离子和有机分子的外流,配合钾离子的外流,减少细胞内渗透性物质浓度,进而引起水向细胞外的转移,造成细胞容积减小[25,38]。然而长期以来,VRAC的分子本质一直未得到明确。直到2014年,两项研究揭示了VRAC的主要成分为LRRC8(leucine-rich repeatcontaining 8)家族,一类4次跨膜蛋白家族所构成的多聚体[32-33]。进一步结构学研究发现,VRAC是由LRRC8A及其家族的其他成员(LRRC8B~E)构成的异六聚体。其主要结构包括一个跨膜孔结构域以及胞浆侧的亮氨酸富集结构域。VRAC的跨膜孔在细胞内外并非对称,其胞浆侧孔径较宽而胞外侧孔径小,跨膜孔胞外侧是形成VRAC选择性的核心结构[34-35,39]。
Hyzinski-Garcia等[26]使用实时定量PCR技术检测确定了LRRC8A~E在原代大鼠星形胶质细胞中的mRNA表达,并发现LRRC8A是组成VRAC的核心组分,使用小干扰RNA敲除LRRC8A和LRRC8D,电中性渗透性物质(如肌醇、牛磺酸)的外流受到抑制;而敲除LRRC8A和LRRCB/C/E则显著抑制了带电荷的渗透性物质(如D-天冬氨酸)的外流[26,40]。Formaggio等[27]则通过免疫印迹和免疫荧光的方法确定了LRRC8A蛋白在原代大鼠皮层胶质细胞和大鼠脑切片的原位胶质细胞膜上表达,同时发现使用小干扰RNA敲低LRRC8A表达后,星形胶质细胞在低渗刺激水肿后的RVD不能发生,直接证明了LRRC8A是星形胶质细胞RVD的必需蛋白质。
值得注意的是,VRAC不仅可以介导星形胶质细胞RVD,通过VRAC释放至细胞外液的有机分子,特别是兴奋性神经递质谷氨酸,也是突触间隙中谷氨酸的重要来源之一。定向敲除小鼠星形胶质细胞的LRRC8A后,小鼠的微型兴奋突触后电流频率减少,突出可塑性降低,同时出现了持续的学习及记忆缺陷。在脑缺血等病理情况下,星形胶质细胞病理性水肿,激活VRAC引起大量谷氨酸释放,如细胞外液与神经元表面受体相结合,可能进一步加重缺血性卒中时神经元的兴奋性损伤[36,41]。VRAC的生理功能及其在病理性水肿中所发挥的复杂作用仍有待进一步研究明确。
2 水通道蛋白(AQP)
1988年,Denker等[29]在人类红细胞中发现了第一个AQP成员AQP1,并因此获得了2003年诺贝尔化学奖。目前,在人类和啮齿类动物中已经发现13种AQP亚型(AQP0~AQP12)。所有这些亚型都具有相对保守的整体结构,通常作为稳定的均四聚体存在于细胞膜上,其中每个单体都独立形成一个双向水通道。根据先前报道的人类AQP1信息,以AQP1为例画出AQP单体的一般三级结构示意图(图1a)[31,42-44](同时参考数据库信息:RSCB蛋白数据库(ID:1FQY);Uniprot数据库(ID:P29972))。AQP每个单体(大小为26~34 ku)由6个跨越膜的α螺旋(H1~6)组成,6个跨膜螺旋之间由5个长度不同的氨基酸环(Loop A-E)顺序连接。前3个跨膜螺旋(H1~3)与后3个跨膜螺旋(H4~6)具有氨基酸的高度同源性。6个螺旋串联并重复跨膜,使得每对高度同源的螺旋(H1-H4、H2-H5、H3-H6)都处于相反的取向,构成了通道双向性的结构基础。决定AQP通道选择性的最重要结构是NPA模体,这一结构由环B和环E分别部分插入脂双层形成的两段非跨膜螺旋(HB和HE)构成,HB和HE在脂双层中心相遇的末端是两个高度保守的天冬酰胺-脯氨酸-丙氨酸(NPA)序列(图1,红色),通常将位于HB的NPA保守序列称为NPA1,而将位于HE的NPA保守序列称为NPA2,两个NPA序列相互作用于脂双层中心,称为NPA模体,这一结构决定了AQP通道的电荷选择性,不允许氢离子通过。AQP通道物理上的最狭窄处则由位于NPA模体近胞外侧的四氨基酸功能位点(芳香族/精氨酸收缩区(ar/R收缩)和一个半胱氨酸)形成,在人AQP1中这4个氨基酸分别为Phe56、His180、Arg195和Cys189(图1,粉色)[31,45-46]。
目前被发现表达于哺乳动物细胞的13种AQP亚型可根据其功能及氨基酸序列特点分为3个亚家族(图1),AQP0、AQP1、AQP2、AQP4、AQP5、AQP6、AQP8属于经典AQP亚家族,其特点是通道内径相对较窄,具有较严格的水分子选择性(同时可通过氨、尿素等极性小分子)。其中的AQP6因其水通透性较差并可允许甘油通过,其分类尚存在一定争议。AQP3、AQP7、AQP9、AQP10属于甘油-水通道亚家族,其特点是通道内径较大,允许甘油通过[43]。同时,甘油-水通道亚家族中的水通道蛋白在氨基酸序列拥有共同特点,即NPA2下游第2位氨基酸为保守的天冬氨酸。AQP11、AQP12属于超AQP亚家族(superaquaporins),其序列特点是具有高度退化的NPA1,但在NPA2的下游具有保守的半胱氨酸。目前AQP11已被证实具有水通透性,但AQP12是否有水通透性尚不明确[47-48]。从进化的角度看,经典AQP亚家族和甘油-水通道亚家族可能来源于一个共同的AQP祖先,而超AQP亚家族与前二者的关系较远[48-49]。
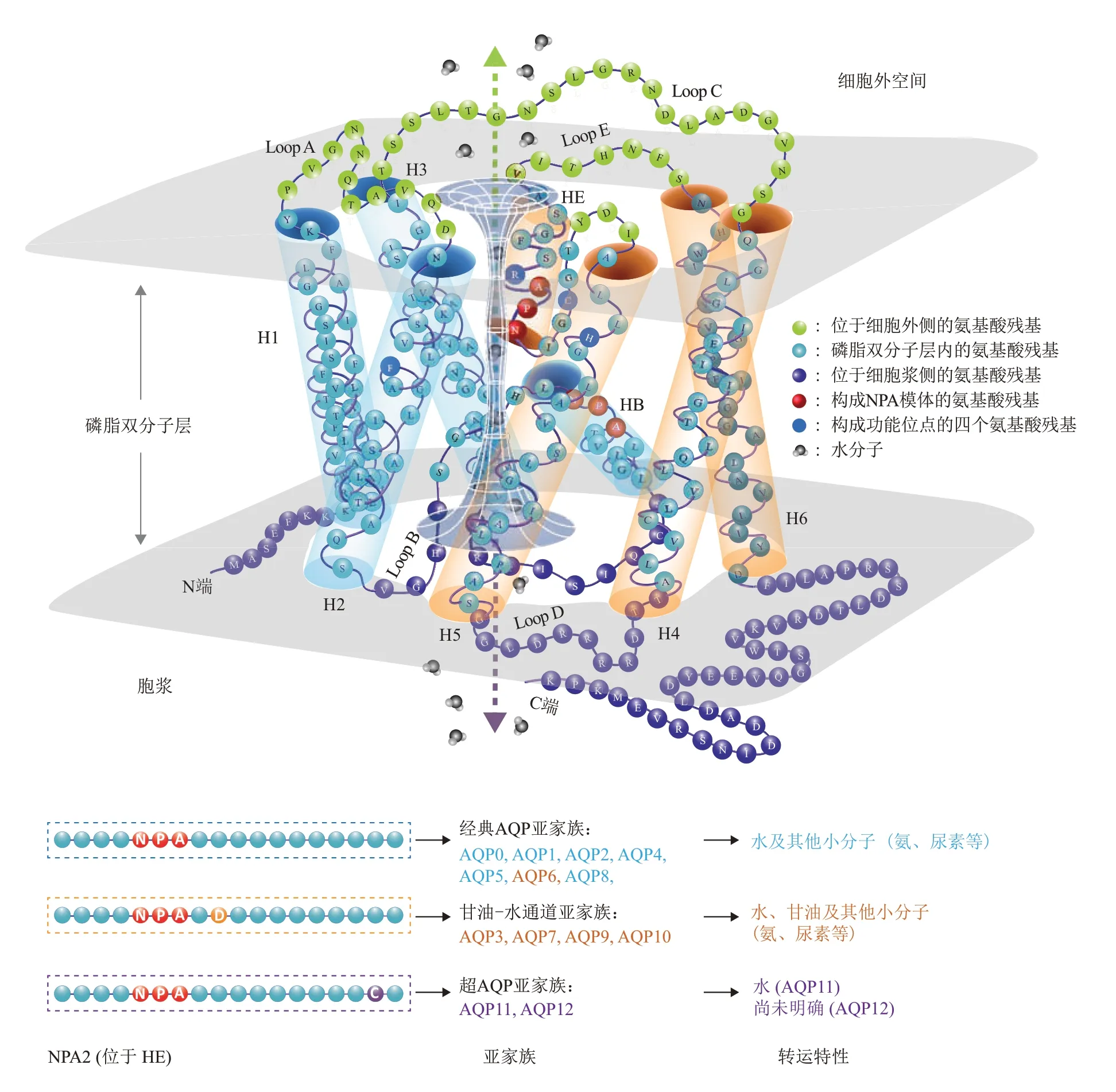
Fig.1 Structure and subfamilies of AQP图1 AQP结构及亚家族示意图(以AQP1结构为例)
至今,在星形胶质细胞中共发现6种AQP亚型的表达,分别为AQP1、AQP3、AQP4、AQP5、AQP8、AQP9,这些水通道蛋白在星形胶质细胞生理及病理过程中发挥了多种作用[50]。其中,AQP4是星形胶质细胞中表达量最大的AQP,AQP4在星形胶质细胞膜上的分布并不是均匀的,而是与细胞外环境有着紧密联系。总的来说,AQP4富集于星形胶质细胞与液体接壤的细胞膜区域,包括包绕毛细血管,与血管内皮、基底膜共同构成BBB的星形胶质细胞终足;也包括紧邻脑室或蛛网膜下腔脑脊液成分、构成胶质界膜(glia limitans)的星形胶质细胞终足(end-feet)[30,51]。星形胶质细胞的AQP4参与了脑水平衡的多个重要环节,敲除AQP4的小鼠,其BBB对水的透过性较正常小鼠明显下降[52];敲除AQP4也使得CSF流动及循环受到明显抑制[53]。同时,在紧贴突触结构的星形胶质细胞膜上,也有一定数量的AQP4表达,参与突触间隙中钾离子及谷氨酸的清除过程[54-58]。不仅如此,AQP4还被证明与星形胶质细胞的迁移密切相关。小鼠脑外伤模型中,AQP4缺失的小鼠,星形胶质细胞迁移速度显著减慢[59]。AQP4促进星形胶质细胞迁移的机制可能为AQP4介导水快速进入细胞,促进了星形胶质细胞移动前沿(leading edge)的形成。另外,更近期的研究也发现,AQP4与结合素43(connexin 43)的相互作用,也可能作为AQP4促进星形胶质细胞迁移的机制之一[59-61]。AQP4在星形胶质细胞RVD的启动和加速过程中都发挥重要作用,一方面,星形胶质细胞的快速水肿是RVD的启动条件,而AQP4介导了星形胶质细胞的快速水肿;另一方面,当RVD过程启动后,随着渗透性物质快速转移至细胞外的水也需要通过AQP4这一“快速通道”。AQP4既是星形胶质细胞RVD启动的必要条件,也是RVD快速发生的通道[24]。
3 总 结
水平衡是脑发挥生理功能的基础。多种累及中枢神经系统的疾病都可能打破这一平衡,进而引发脑水肿、脑积水等病理改变,导致不良预后,甚至引起脑疝等威胁生命的临床并发症。星形胶质细胞是脑内数量最多的细胞之一,是大脑水平衡的主要维持者,在脑缺血等多种疾病发生进程中,星形胶质细胞最早也最为显著地表现出细胞水肿,并进而通过多种机制推动疾病的发展。星形胶质细胞快速水肿激活RVD启动,使得渗透性物质和水快速转移至细胞外,部分恢复细胞原有容积。VARC和AQP是RVD过程中的两种关键膜蛋白,AQP介导细胞快速水肿激活VRAC,使得渗透性物质快速转移至细胞外,在渗透作用的驱动下,细胞内的水快速通过AQP转移至细胞外,完成星形胶质细胞调节性容量减少。对VRAC和AQP结构及其在星形胶质细胞中功能的研究将进一步帮助人们认知RVD的发生机制,为多种疾病中脑水肿的预防和治疗提供新靶点。
