脊髓星形细胞瘤研究进展*
2022-11-22王永志柴睿超
庞 波 王永志 柴睿超**
(1)首都医科大学,北京市神经外科研究所分子神经病理室,北京 100070;2)首都医科大学附属北京天坛医院,北京 100070)
1 脊髓星形细胞瘤临床特征及病理分型
脊髓星形细胞瘤为髓内原发性肿瘤,约占髓内肿瘤的1/3,占中枢神经系统肿瘤的2%~4%,发病率低于0.1/10万人/年;平均发病年龄为35岁,男性略高于女性[1-4]。脊髓星形细胞瘤的临床表现在很大程度上取决于肿瘤的发生位置和生长情况[5],颈段和胸段多见,腰段较少,患者多以弥漫性非特异性轴性疼痛为始发症状,包括背痛、神经根痛和中枢痛等。其他常见的发病症状是缓慢进展的运动或感觉缺陷,膀胱或胃肠功能障碍发生的频率较低,通常在症状发展的晚期出现[6-7]。较低级别肿瘤经手术切除可长期生存,但高级别脊髓星形细胞瘤预后极差,平均生存期约20.2个月[8]。根据现有临床队列研究,对于较低级别肿瘤,手术切除程度是最显著的预后因素,完全切除可获得较好局部控制[9-10]。高级别脊髓星形细胞瘤局部浸润严重,手术无法完全切除,对于这些肿瘤,积极的手术切除可能并不能使患者生存获益[11]。此外,根据世界卫生组织(WHO)(CNS2016)分型,本团队构建的包含外周血炎症指标的预后预测模型还发现,Ki-67<10%和切除范围≥90%与WHO II/III级脊髓星形细胞瘤患者更好的预后独立相关,而中性粒细胞与淋巴细胞比率(NLR)≤3.65和麦考密克评分(MMS)≤3分与WHO IV级肿瘤患者的生存期有独立相关性[10]。
2007年WHO根据组织学病理特征将星形细胞瘤分为4个等级:Ⅰ级多为毛细胞星形细胞瘤,或毛黏样星形细胞瘤,肿瘤边界清楚,无侵袭性,多见于儿童和青少年,预后最佳,10年生存率高达96%;Ⅱ级为星形细胞瘤,多呈弥漫性生长,容易侵犯周围组织;Ⅲ级为间变性星形细胞瘤,恶性度较高,肿瘤进展较快;Ⅳ级为胶质母细胞瘤,恶性度最高,预后最差[12]。2016年WHO分类将分子病理信息加入到胶质瘤的病理分型中。H3F3A或HISTIH3B/C中H3 K27M突变的弥漫性中线胶质瘤被认为是一种新的实体,即H3 K27M突变弥漫中线胶质瘤,不管其他组织学特征如何,这个新实体被归类为IV级胶质瘤,包括丘脑、脑桥和脊髓等部位肿瘤[13]。2021年WHO中枢神经系统肿瘤分类根据IDH、MYB/MYBL1、H3K27、H3G34等分子指标变异类型,将星形细胞瘤分为:成人型弥漫性胶质瘤(星形细胞瘤,IDH突变型;胶质母细胞瘤,IDH野生型)、儿童型弥漫性低级别胶质瘤(弥漫性星形细胞瘤,MYB/MYBL1变异型;弥漫性低级别胶质瘤,MAPK通路变异型)、儿童型弥漫性高级别胶质瘤(弥漫性中线胶质瘤,H3 K27变异型;弥漫性半球胶质瘤,H3G4突变型;弥漫性儿童高级别胶质瘤,H3野生和IDH野生型)[14]。但上述的分类主要依据脑肿瘤的研究进展,除携带H3 K27M突变的脊髓星形细胞瘤可明确诊断为儿童型弥漫性高级别胶质瘤(弥漫性中线胶质瘤,H3 K27变异型外),其余脊髓星形细胞瘤的诊断还有待进一步研究明确。根据目前有限的证据显示,脊髓胶质瘤有着独特的分子病理特征,脊髓星形细胞瘤IDH突变型几乎没有报道[4,15],且H3 K27M突变发生率远低于弥漫内生性脑干胶质瘤(脊髓星形细胞瘤42.1%vs.弥漫内生性脑干胶质瘤80%)[16-17]。
综上所述、与弥漫脑胶质瘤相比,脊髓星形细胞瘤因其发生部位不同,有着独特的临床病理特征,且在分子遗传表型方面有较大差异(表1)。脊髓星形细胞瘤在疾病诊断治疗方面也不同于弥漫脑胶质瘤,仍需进一步探究。此外,从WHO神经系统肿瘤分类的更新中不难看出,分子遗传学的发展正在改变人们对肿瘤的认识,分子病理在指导肿瘤诊断、治疗以及基础实验研究中发挥着越来越重要的作用,分子病理研究可能是进一步理解脊髓胶质瘤的有效突破口。

Table 1 Summary of differences between spinal cord astrocytoma and diffuse glioma表1脊髓星形细胞瘤与弥漫脑胶质瘤差异性总结
2 脊髓星形细胞瘤的诊断与治疗
脊髓星形细胞瘤的术前诊断主要依赖于核磁共振,磁共振成像(MRI)显示星形细胞瘤不均匀增强,通常有不对称性,轻微偏离中心位置,T1加权像通常呈低或等信号,T2加权像通常为高信号[18]。然而,仅凭MRI很难将星形细胞瘤和一些非典型表现髓内肿瘤以及脊髓炎性疾病区分开来,组织活检仍然是诊断金标准[19]。近年来,液体活检技术的发展为肿瘤检测提供了新的思路,脑脊液ctDNA检测可用于脊髓星形细胞瘤术前检测及术后检测,未来可能广泛应用于临床[20-21]。
目前脊髓星形细胞瘤没有专门治疗指南,临床上以手术治疗为主导。根据国家综合癌症网络(NCCN)指南,高级别胶质瘤术后需辅以标准化放疗与化疗,然而,脊髓星形细胞瘤放化疗效果并不确切,根据一项临床病例分析,无论是低级别还是高级别脊髓星形细胞瘤,替莫唑胺化疗和放疗对总生存期(OS)均无显著影响[8]。因此,脑胶质瘤的治疗可能并不适合脊髓胶质瘤,制定一系列规范的脊髓胶质瘤治疗方案以及开展更有效的治疗方法才可能使脊髓胶质瘤患者获得有效治疗。
3 脊髓星形细胞瘤的治疗进展
3.1 分子靶向药物
靶向药物是针对肿瘤特异性分子和基因开发的,它能够结合肿瘤细胞或组织特有的异常靶点,阻断某一特定通路,从而杀灭肿瘤细胞或阻止其生长。相比传统细胞毒性化疗药,具有特异性强、敏感性高、毒副作用小等优点[22]。分子靶向药的应用在多种肿瘤治疗中取得重大进展。雌激素受体(ER)靶向药和人表皮生长因子受体2(HER2)靶向药是ER阳性和HER2阳性乳腺癌的主要治疗手段[23];酪氨酸激酶抑制剂(TKI)的出现改变了慢性粒细胞白血病的治疗,成为其一线治疗方案[24];表皮生长因子受体(EGFR)靶向药已广泛应用于非小细胞肺癌[25];血管内皮生长因子(VEGF)靶向药在晚期结直肠癌治疗中效果显著[26]。
靶向药物在脊髓星形细胞瘤治疗的研究也有报道。Noorani等[27]通过条件突变小鼠EGFR基因启动脑和脊髓胶质瘤的发生,并在体内外实验中证实EGFR靶向药对EGFR扩增脑脊髓胶质瘤的抑制作用。Chamberlain等[28]通过一个6名患者的回顾性研究队列发现,在手术切除、放疗和替莫唑胺治疗后仍表现出持续进展的脊髓胶质瘤中,贝伐珠单抗(VEGF靶向药)的使用具有姑息性影响。Balasubramanian等[29]发现,BRAF和MEK酪氨酸激酶抑制剂在一例BRAF V600E突变的低级别脊髓星形细胞瘤患者的治疗中有较好反应。对于伴有H3 K27M突变的脊髓星形细胞瘤,去甲基化酶抑制剂成为一种治疗可能,HDAC及EZH2抑制剂在脑干胶质瘤异种移植模型中有良好的效果[30-32]。
分子靶向药在广泛应用中也很快暴露出来一些问题。一方面,由于肿瘤异质性的存在,靶向药物往往需多药联用,或与传统药物联用,增加患者药物代谢负担;另一方面,多种靶向药在治疗过程中很快产生肿瘤耐药反应,甚至发生恶性进展。
3.2 免疫治疗
正常情况下,人体免疫系统可及时识别并清除肿瘤细胞维持机体健康,但肿瘤在发生过程中可以通过多种途径使人体免疫系统受到抑制,从而在抗肿瘤免疫应答的各阶段得以幸存,甚至促进肿瘤的发生[32-33]。肿瘤免疫治疗的重点在于激活免疫系统,促进自体免疫细胞对肿瘤的清除作用,恢复机体正常的免疫应答。随着对免疫逃逸机制的深入了解,各种免疫疗法应用于肿瘤治疗研究,包括细胞因子疗法、免疫检查点抑制剂、细胞免疫疗法、肿瘤新抗原疫苗等。
虽然免疫疗法已广泛应用于中枢神经系统肿瘤,但由于生长环境及分子遗传学的不同,脊髓胶质瘤的免疫疗法很少报道,但是嵌合抗原受体T细胞(CAR-T)免疫疗法在弥漫中线胶质瘤(DMG)的成功为脊髓星形细胞瘤的免疫治疗提供了临床基础。2018年美国斯坦福大学Mount等[34]首次报道了伴H3 K27M突变弥漫中线胶质瘤的抗GD2 CAR-T细胞免疫疗法。该团队发现,在患者来源的H3 K27M突变的胶质瘤细胞培养物表现出均匀的、高表达的二醛基胶质苷GD2。抗GD2 CAR-T细胞在体外表现出强大的抗原依赖性细胞因子生成和对DMG细胞的杀伤,在5个独立的患者衍生的H3 K27M DMG原位异种移植模型中(包括1例脊髓弥漫中线胶质瘤),全身给予GD2靶向的CAR T细胞可以有效清除移植的肿瘤。2022年该团队在《自然》(Nature)杂志报道了抗GD2 CAR-T细胞的Ⅰ期临床试验效果,经CAR-T细胞免疫治疗4名患者中有3名表现出临床和影像学的改善,其中包括1例脊髓星形细胞瘤[35]。
除了CAR-T细胞治疗外,治疗性疫苗的使用在免疫治疗文献中也引起了相当大的关注。Ochs等[36]发现,H3组蛋白K27M突变体的多肽疫苗能够在一个主要组织相容性复合体(MHC)人类化的小鼠模型中诱导有效的、突变特异性的、细胞毒性T细胞介导的免疫反应,为H3 K27M新抗原疫苗临床试验的开展提供了实验基础。
虽然免疫疗法在胶质瘤的治疗中已表现出巨大潜力,但多数治疗靶点主要发生在颅内,由于肿瘤微环境的不同,可能并不适用于脊髓星形细胞瘤。当前关于伴H3 K27M突变弥漫中线胶质瘤的免疫治疗研究主要在弥漫脑干胶质瘤开展,应用于脊髓胶质瘤还需考虑可行性、有效性、安全性等众多问题。
3.3 基于干细胞的基因导向酶前药疗法
使用基因工程神经干细胞(NSCs)治疗星形细胞瘤是胶质瘤治疗的另一种可行方法[37]。神经干细胞的肿瘤趋向性使其成为一种局部传递抗癌基因和药物的强大载体[38]。Ropper等[39]根据神经干细胞治疗颅内胶质瘤的经验,运用基因工程技术将hNSCs设计成只表达胞嘧啶脱氨酶基因和胸苷激酶双基因,将良性的5-氟胞嘧啶和更昔洛韦分别转化为瘤细胞5-氟尿嘧啶和更昔洛韦-3磷酸。在大鼠脊髓胶质瘤模型进行工程化干细胞治疗,明显延长脊髓星形细胞瘤大鼠生存期,自主神经功能明显改善,肿瘤生长速度降低。
4 脊髓星形细胞瘤研究面临的挑战
虽然多种治疗手段已应用于胶质瘤的临床治疗,但新兴疗法应用于脊髓星形细胞瘤还面临诸多困难。脊髓星形细胞瘤发生于椎管内髓内,此处解剖结构脆弱,高级别肿瘤沿脊髓浸润性生长。以目前的手术技术,在使患者不出现神经功能损伤的情况下肿瘤很难达到全切除,术后的放化疗以及其他综合治疗是至关重要的。
实验模型的缺乏严重制约了脊髓胶质瘤的研究进展,目前脊髓星形细胞瘤治疗实验多依赖于颅内肿瘤模型,然而由于肿瘤分子遗传背景以及肿瘤微环境的不同,颅内肿瘤模型并不能反映脊髓星形细胞瘤的治疗效果。Hsu等[40]通过直接将胶质瘤或胶质母细胞瘤多形性神经球细胞注射到大鼠中下段脊髓水平,可再生髓内生长的胶质瘤。Ropper等[39]改进上述方法,将G55或U87人星形细胞瘤细胞注射于C6大鼠髓内,并在实验中检测了肿瘤生长及脊髓损伤造成的大鼠自主神经功能障碍。该实验方法模拟了髓内肿瘤生长方式,再现了星形细胞瘤脊髓浸润的过程,但实验模型中注射肿瘤细胞均来源于脑胶质瘤,无法模拟具有脊髓星形细胞瘤分子遗传学特征的肿瘤对治疗的敏感性。Noorani等[27]通过基因工程小鼠条件突变EGFR使小鼠发生脊髓胶质瘤。该方法使小鼠自发成瘤,为靶向治疗提供了良好的实验模型,但是经该基因工程改造的小鼠仍与人来源脊髓星形细胞瘤的分子遗传学改变有较大区别,该模型不能客观反映脊髓星形细胞瘤对药物的响应。Mount等[34]将患者来源脊髓星形细胞瘤细胞SU-pSCG1原位注射于NSG小鼠脊髓髓质作为治疗模型,该模型在免疫缺陷鼠上较好模拟了人脊髓星形细胞瘤的生长。然而该操作十分困难,无论是患者来源脊髓星形细胞瘤细胞获取,还是肿瘤细胞原位注射,都需专业操作,且失败率较高,推广研究较难。综合考量肿瘤学动物和细胞实验模型,脊髓星形细胞瘤因较低的发病率和较难获得病理样本,患者来源原代细胞PDCs(patientderived tumor cells)以 及 小 鼠PDX(patientderived tumor tissue xenografts)模型都较难构建成功(表2)。

Table 2 Experimental animal and cell models of spinal cord astrocytoma表2脊髓星形细胞瘤动物细胞实验模型
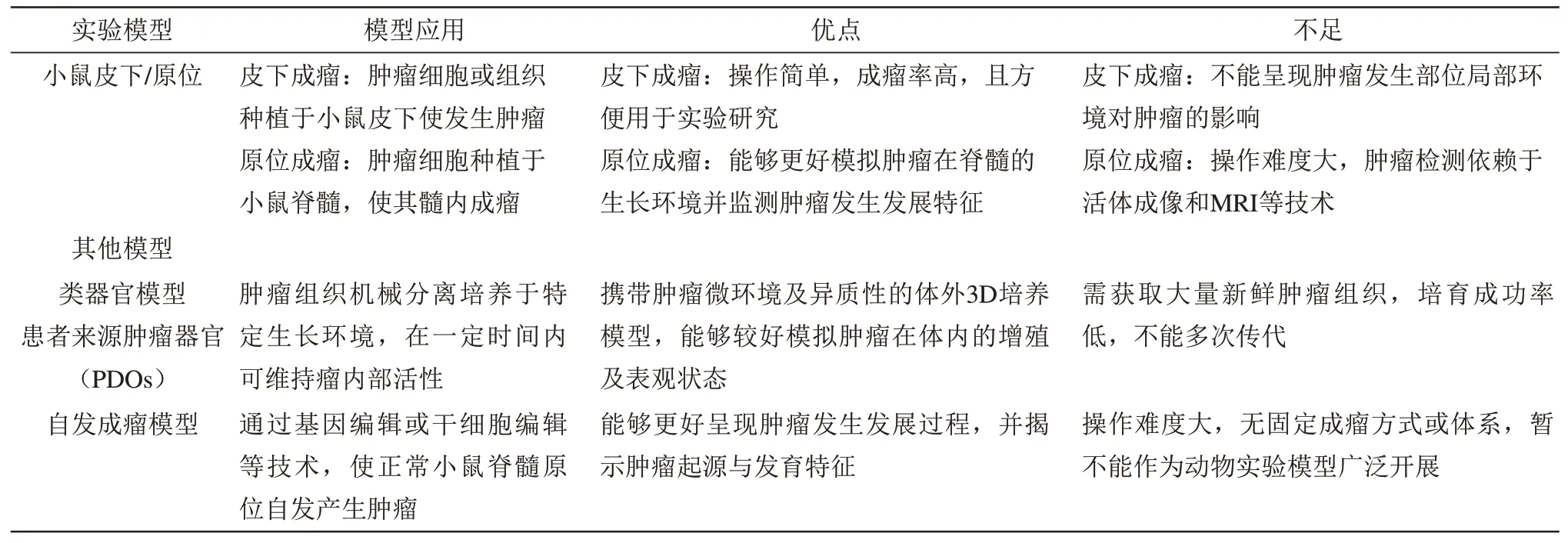
续表2
此外,新药及新疗法应用于脊髓星形细胞瘤的安全性需要更全面的考量,脊髓做作为人体重要解剖结构,一旦发生意外患者生存质量将显著降低。血-脑脊液屏障的存在也阻碍了很多药物的递送,对药物研发构成困难。
5 小 结
综上,脊髓星形细胞瘤是一种髓内罕见恶性肿瘤,因其发病率低,长期以来未能引起国内外学者关注,然而,其高致残率及致死率给患者及家庭带来极大负担,脊髓星形细胞瘤患者的有效治疗是亟需解决的临床问题。近年来,随着分子病理的发展,脊髓星形细胞瘤的研究也取得一些成果,但由于脊髓星形细胞瘤临床病理样本的缺乏,现阶段得出的结论都局限于少数病例研究,无法进行大样本验证,结论尚不可靠。未来脊髓星形细胞瘤的研究中,实验模型的建立尤为重要,合理的细胞模型及动物模型可提供更全面的临床前证据,极大推进临床转化治疗进程。同时,分子靶向治疗、免疫治疗、干细胞基因治疗以及电场治疗等多种治疗手段也应在脊髓星形细胞瘤积极开展,希望之后的新技术、新疗法能尽快应用于脊髓星形细胞瘤,实现脊髓星形细胞瘤有效治疗,使患者获益。
