肠神经胶质细胞在维持肠黏膜稳态与调控炎症中的作用*
2022-11-22刘黎黎
李 礼 刘黎黎
(北京大学第一医院儿科,北京 100034)
神经胶质细胞是神经系统生理学的基础,胶质细胞在维持中枢神经系统内稳态中起到诸多重要作用,如星形胶质细胞,对于调节神经元微环境和神经网络功能至关重要。在肠神经系统,肠神经胶质细胞(enteric glial cells,EGC)被认为与星形胶质细胞功能相似,但功能上却不尽相同,肠道具有多种不同细胞类型,尤其在最接近肠腔的黏膜层,近年研究表明,肠神经胶质细胞与肠黏膜层的多种非神经元细胞(如上皮细胞、血管内皮细胞、肠内分泌和免疫细胞等)具有相互作用关系,从而发挥调节肠道局部功能作用,故而备受关注。研究表明,肠黏膜层神经胶质细胞(mucosal enteric glial cells,mEGCs)不仅与正常肠道功能密切相关,而且可能与各种肠道疾病发生发展有关,如炎症性肠病、肠易激综合征、帕金森病、先天性巨结肠等[1-2]。本文将总结mEGCs在维持肠黏膜稳态与调控炎症中的作用。
1 肠神经胶质细胞分型与功能
在胚胎发生早期,神经嵴细胞填充肠道并形成肠神经系统(ENS),其中肠神经胶质细胞与神经元比例约为6∶1。首先,肠道存在不同的组织学分层,可分为黏膜层、黏膜下层、肌层和浆膜层,多数肠神经胶质细胞分布在黏膜下层和肌层神经元富集的神经丛。在成年小鼠的胃肠道中,根据细胞形态和不同解剖层分布,EGC可分为I~IV亚型。其中mEGCs具有长而细的分支结构,沿着神经纤维走行,终止于黏膜上皮[3]。目前发现的mEGCs功能涉及维持肠道屏障、调节免疫应答、调控神经内分泌信号传递等。这些显然与星形胶质细胞等其他类型的胶质细胞功能不同。转录组研究表明,尽管EGC表达了许多与星形胶质细胞、少突胶质细胞和施旺细胞相同的基因,但EGC的转录组足迹与其他胶质细胞亚型并不相同。此外,根据单细胞测序结果分析,EGC具有复杂的异质性,如神经胶质细胞标记物(SOX10、S100β、胶质纤维酸性蛋白(GFAP))在不同的EGC亚型中有差异表达[4-5],故目前采用形态与解剖定位的EGC分型并不准确,鉴于EGC在形态和分子水平上的复杂性,在研究领域对其分类仍有待达成共识,本文主要讨论mEGCs在黏膜层与邻近细胞、肠道菌群的相互作用(图1)。
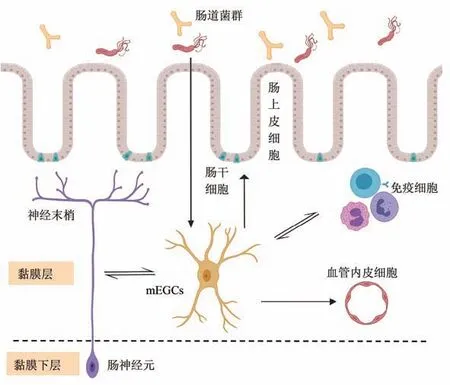
Fig.1 Intestinal mucosal enteric glial cells(mEGCs)interact with intestinal epithelial cells,immune cells,intestinal flora,etc图1肠黏膜层神经胶质细胞(mEGCs)与肠上皮细胞、免疫细胞、肠道菌群等相互作用
2 mEGCs与肠上皮细胞
mEGCs是肠黏膜水平上唯一的神经元型细胞,被认为是肠上皮屏障功能的有效调节剂,mEGCs将分支延伸至黏膜隐窝和绒毛顶端,包裹着参与控制黏膜吸收、分泌等功能的神经元轴突。目前认为,mEGCs主要功能之一是维持肠上皮屏障,研究表明mEGCs可影响上皮细胞成熟、凋亡及肠上皮细胞通透性,在炎症性肠病和其他消化系统疾病中,肠屏障功能受损在疾病进展中起重要作用[6-7]。胶质细胞源性神经营养因子(GDNF)有助于肠上皮细胞成熟,因此可能是EGC在这一过程中的主要介导因子。EGC与Caco2细胞共培养促进肠上皮细胞成熟,当GDNF从EGC上清液中耗尽或在EGC中被敲除或GDNF受体RET被阻断时,肠上皮细胞成熟延迟。此外,EGC上清液或重组GDNF可减轻TNF-α诱导的Caco2细胞和类器官肠上皮细胞屏障功能的丧失[8]。
在右旋糖酐硫酸钠(DSS)诱导的小鼠结肠炎模型中,敲除肠胶质细胞可加重肠黏膜损伤,并显著延迟黏膜愈合时间[9],mEGCs可通过分泌促表皮生长因子促进肠上皮细胞增殖及黏膜修复。Grubisic等[10]发现mEGCs可以通过腺苷2B受体(A2BR)调节邻近细胞炎症,敲除mEGCs的A2BR可减低小鼠DSS结肠炎后的屏障功能障碍。在患有炎症性结肠炎的小鼠中,这种嘌呤能信号激活EGC以增加NO和ATP的释放,从而导致神经炎症和细胞死亡[11]。此外,神经胶质细胞在体外释放屏障增强因子,包括15-羟基二十碳四烯酸、S-亚硝基谷胱甘肽和GDNF[12],这些因子在炎症性肠病(IBD)中的水平均有所降低,表明mEGCs功能改变可能导致肠道上皮屏障功能受损。但mEGCS在体内对于维持肠屏障功能的贡献存在一定争议,有研究表明,在干扰mEGCs信号传导的转基因小鼠模型及敲除mEGCs的无菌小鼠中,肠屏障功能不受影响[13]。小鼠可以耐受mEGCs的大量丢失,这使得难以推断mEGCs对肠上皮屏障完整性和功能的贡献。最近发表的单细胞测序研究表明,肠道隐窝处特定mEGCs亚群对于肠干细胞修复具有调节作用,GFAP+mEGCs可表达多种Wnt配体以促进LGR5+的肠干细胞增殖,在肠道上皮稳态和慢性肠道炎症调节中,mEGC可能具有动态异质性,是上皮细胞再生和炎症调控生态位的重要组成[14]。
3 mEGCs与血管内皮细胞
Liu等[15]通过对mEGCs进行S100β标记,借助3D共聚焦显微镜成像,发现mEGCs不仅伴行神经纤维,与周围其他类型细胞存在密切接触,如血管内皮细胞、淋巴内皮细胞等[15],说明mEGCs在黏膜层可能直接与邻近细胞发生相互作用。推测mEGCs可能参与向肠神经细胞提供营养和/或在其延伸过程以包裹小血管排出代谢废物,然而这两种作用目前均未经过证实。此外,尚不清楚mEGCs是否同星形胶质细胞一样在黏膜局部稳态中起主要作用,诸如离子稳态、pH调节、化学递质平衡、血管内皮屏障、局部血流调节等。
4 mEGCs与免疫细胞
肠道是最大的免疫器官,EGC处于调控中心位置[16-17],可以桥接免疫系统和神经系统之间的相互作用。然而,关于EGC和免疫细胞之间的双向相互作用及涉及的具体机制,还知之甚少。体外脂多糖刺激EGC可诱导与免疫反应相关的基因表达增加,在这些基因中的许多反映了对固有免疫应答的调节作用。研究显示,在小鼠慢性结肠炎模型中,EGC可通过Cx43和M-CSF促进肌层巨噬细胞促炎表型转化[18]。同时,EGC可调节适应性免疫反应,并在体外对T细胞具有免疫抑制作用。mEGCs可表达主要组织相容性复合物II类(MHC-II)[19],这些结果表明EGC在抗原呈递、免疫调节等机制中发挥作用。
在克罗恩病(CD)的患者中发现,Peyer氏结中mEGCs的数量增多可增加肠黏膜通透性,并且与周围固有层和对照组相比,CD患者的Peyer氏结中EGC的数量更高,研究表明mEGCs数量增多对肠屏障功能存在有害影响[20],Peyer氏结为黏膜层淋巴组织,推测可能有免疫因素等其他机制参与,所以mEGCs调控黏膜屏障可能存在更复杂机制,其功能仍需进一步研究。
值得注意的是,在不同疾病的背景下,EGC可能发生显著变化。尤其是肠道炎症受累明显的黏膜层,mEGCs可能具有不同的反应性,例如在寄生虫感染或溃疡性结肠炎情况下,EGC显示干扰素刺激基因的高表达。研究提出EGC中的IFN-γ信号传导是肠道内稳态的核心,并揭示了IFN-γ-EGC-CXCL10轴在感染性后的免疫应答和组织修复中的关键作用[21]。通过研究EGC自身免疫功能及与募集来的免疫细胞相互作用机制,深入了解可能为疾病治疗提供更广阔的思路。
5 mEGCs与肠道菌群
Kabouridis等[22]研究表明,小鼠mEGCs在出生以后由肌间和黏膜下神经丛的EGC迁移而来,这一过程主要受到肠道菌群的刺激,并且mEGCs稳态取决于出生后微生物群的定植,而在应用抗生素处理后,肠道mEGCs明显减少,而人类胎儿的mEGC在宫内孕12~18周时在黏膜固有层、隐窝周围已经存在并建立神经网络系统[23],在这一时期宫内肠腔内并不存在细菌,说明其发育和维持似乎独立于管腔微生物群。通过单细胞测序结果分析表明,人和小鼠的mEGCs mRNA表达谱不完全一致,不同物种间mEGCs的功能可能存在差异[4-5,14]。同时,mEGCs可表达微生物模式识别受体(如TLR2和TLR4)[24],因此肠腔内微生物群可能直接或间接方式影响mEGCs功能。
6 总 结
mEGCs已经逐渐成为肠道黏膜中具有中心调控作用的细胞类型,表1列举了EGC研究的重要里程碑,最初仅认为EGC具有支持肠道神经元的单一作用,到不断揭示这类胶质细胞在黏膜稳态和宿主防御方面的多种作用。配合单细胞测序技术,进一步支持了该细胞亚群功能多样性的观点。了解mEGCs在不同病生理过程中的特殊作用具有重要意义,是未来研究的主要方向。

Table 1 Research milestone of EGC表1 EGC研究里程碑
