大鼠消化系统中器官组织差异性VOCs检测分析
2022-11-22李爱悦刘亚伟黄超群沈成银储焰南
刘 玥,柯 立,陆 燕,张 兵,邹 雪,夏 磊,李爱悦,刘亚伟,黄超群,沈成银,储焰南*
(1.安徽大学 物质科学与信息技术研究院,安徽 合肥 230601;2.中国科学院合肥物质科学研究院 健康与医学技术研究所,医学物理与技术安徽省重点实验室,安徽 合肥 230031;3.中国科学技术大学附属第一医院 胸外科,安徽 合肥 230001;4.中国科学院 合肥肿瘤医院,安徽 合肥 230031)
挥发组学(Volatolomics)是分析生命系统的挥发性有机物(volatile organic compounds,简称VOCs)及其生物代谢过程[1]的科学.检测并识别内源性VOCs,研究疾病所引起的VOCs异常及其生化机制,是建立有效的挥发性生物标志物的基础[2].消化系统从口腔到大肠,负责食物消化、吸收和排泄,作为消化道外的器官——肝脏分泌胆汁帮助消化.
人体组织VOCs的研究中,在胃肠道癌症患者的呼气及其离体癌组织中同时检测到了偏高的同种VOCs,例如,胃癌中的丙酮、异丙醇、乙醇和乙酸乙酯[3]与结直肠癌中的苯甲醛、乙苯和吲哚[4].这些研究为呼气VOCs诊断器官病变提供了可能性依据.此外,在炎症性肠病、肠易激综合征、坏死性小肠结肠炎、感染性腹泻和肝病有关的消化系统疾病的代谢VOCs研究中,也获得了一系列的潜在生物标志物,并发现肠道微生物菌群失调可以解释疾病引起的VOCs改变[5].
关于动物的消化系统、器官的VOCs研究,Reade等[6]采用气相色谱质谱(gas chromatography-mass spectrometry, 简称GC-MS)技术检测结肠炎模型小鼠的粪便和结肠内容物,通过非靶向VOCs分析,发现急性炎症时醛类升高,慢性炎症则酮类增加.Kistler等[7]研究了C57Bl/6N雄性小鼠的多种组织挥发物特征,质子转移反应飞行时间质谱(proton transfer reaction time-of-flight mass spectrometry, 简称PTR-TOF-MS)测量实验发现肝脏释放的丙酮浓度最高,盲肠内容物挥发出的最多的是甲醇,并认为盲肠是系统性甲醇的最可能来源.因为使用的检测技术PTR-TOF-MS是一种在线质谱,因而只能对被选择的特定质子数/电荷数(m/z)的比值所对应的有限VOCs进行靶向性监测,例如丙酮和甲醇.
笔者以大鼠作为模型动物,期望获得健康器官的差异性VOCs特征,为器官病变引起的VOCs异常提供参考.考虑大鼠与人类具有基因的高度相似性,该研究工作对Wistar大鼠消化系统离体组织的VOCs进行非靶向分析,通过固相微萃取气相色谱质谱(solid phase microextraction-gas chromatography-mass spectrometry, 简称SPME-GC-MS)技术的顶空检测,结合检验和判别分析,以获取各种器官组织的差异性VOCs,并对其可能的代谢过程进行讨论.
1 实验方法
1.1 实验大鼠
根据动物实验4R 原则尽量少用动物(reduction)的倡议,考虑初步研究的相关参数平均值对数据点个数的基本要求,实验将使用8只成年Wistar大鼠(8周龄,180~220 g,SPF级,雌雄各4只),均购自山东省济南朋悦实验动物繁育有限公司[SCXK(鲁)20190003].动物实验通过了中国科学院合肥物质科学研究院伦理委员会审查(批准号:SWYX-DW-2021-50).
1.2 组织取样
实验开始前,8只Wistar大鼠在温度(25±2)℃、湿度50%~60%、明暗各12 h循环的空调环境中适应性饲养7 d,并用SPF级饲料和实验室标准纯化水喂养.适应期结束后,大鼠禁食不禁水再饲养72 h,采取脊椎脱臼法处死并进行解剖,分离出的待测器官(肝、胃、小肠、盲肠、大肠)用生理盐水冲洗掉血液和内容物后用滤纸擦干,冲洗时长2~3 s.每个器官取(60±0.5)mg组织并置于15 mL玻璃瓶中,在4 ℃环境下存放以备下一步检测分析.实验室空气、鼠粮和垫料采用同样的方式进行检测以排除对器官组织VOCs分析的干扰.
1.3 VOCs测量
在37 ℃的恒温箱中对装有定量组织的瓶进行顶空VOCs固相微萃取(solid-phase microextraction, 简称SPME),萃取纤维(65 μm厚聚二甲基硅烷/二乙烯基苯(PDMS/DVB))穿过瓶盖深入瓶内进行40 min萃取.在萃取之前,SPME纤维在200 ℃的气相色谱进样口预处理30 min,以去除可能残留的物质.
组织顶空SPME的VOCs检测在气相色谱三重四级质谱仪(TSQ Quantum XLS, Thermo Fisher, USA)上进行.色谱柱(TG-624SILMS,Thermo,USA)规格30 m×0.32 mm×1.80 μm,载气为高纯氦气(99.999%),流量是1.5 mL·min-1,实验中采用不分流进样模式.进样口温度设置为200 ℃,SPME纤维解析时间为30 s,色谱柱升温程序是:初始40 ℃保持1 min,然后以5 ℃·min-1升至180 ℃并保持2 min.质谱仪操作条件与笔者之前的工作相同[8].NIST质谱数据库用于器官组织VOCs的定性,当反向搜索指数(reverse search index, 简称RSI)超过800时予以确认.
1.4 非靶向统计
首先对组织的SPME-GC-MS检测数据进行处理,使用软件Xcalibur 2.2(Thermo,USA)导出色谱峰面积,对色谱峰面积大于1×105的所有VOCs进行非靶向统计分析,为矫正不同实验引起的色谱峰漂移,每个色谱峰在保留时间±0.01 min范围内进行确认.为了寻找某个器官差异性的VOCs,将8只大鼠的该器官组织作为测试组,其他的4种器官组织作为对照组进行比较,考虑到每种器官的8个样本要取VOCs色谱峰面积平均值进行分析,因此采用Mann-Whitney U检验比较两组之间的差异性,当p<0.05时被认为具有统计学意义;筛选出p<0.05的VOCs再进行逐步判别分析,以确定显著性差异的VOCs.统计分析使用IBM SPSS STATISTICS 22.
2 结果与讨论
2.1 器官组织的差异性VOCs
消化系统的器官组织挥发物GC-MS检测实验中,满足峰面积条件的色谱峰共有147个,按照上述实验方法,对每种器官组织VOCs进行非靶向统计分析,获得的各器官差异性物质结果如表1所示.
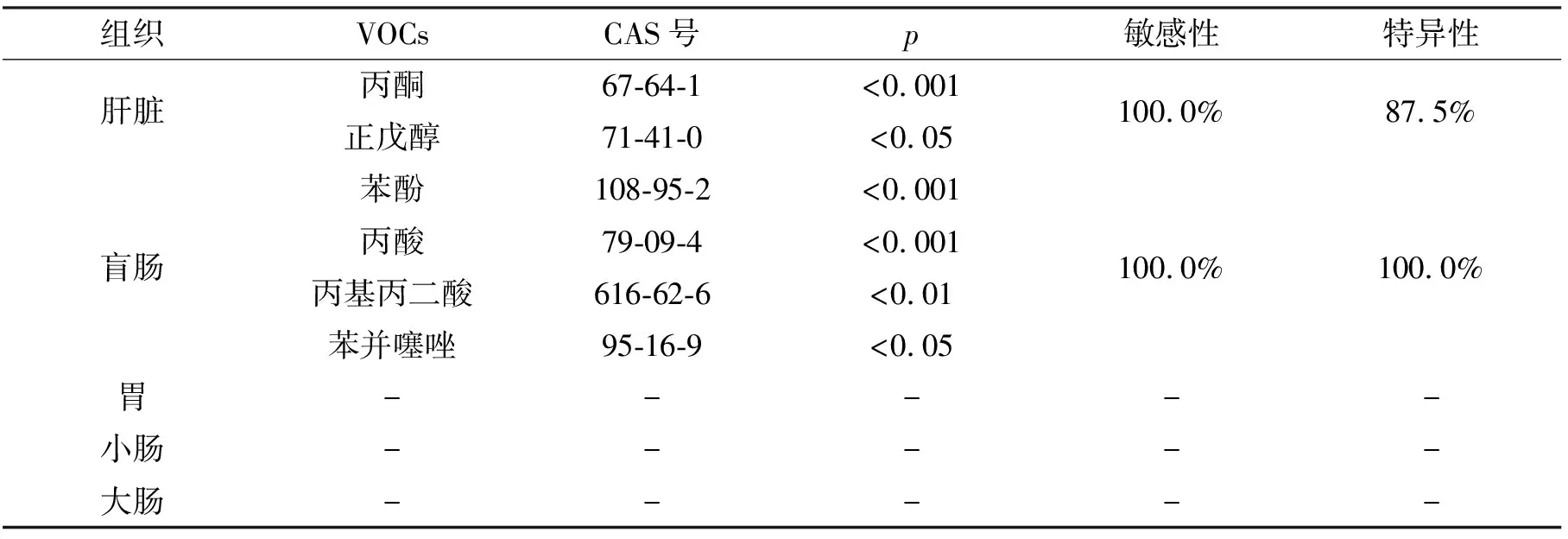
表1 统计分析得到的消化系统器官组织的特异性VOCs
通过这些具有显著性差异的VOCs反映肝脏和盲肠的敏感度为100.0%、特异度为87.5%~100%.但是,在胃、小肠、大肠组织中均未得到显著性差异的VOCs.
2.2 差异性VOCs可能来源
2.2.1 肝脏差异性VOCs
大鼠肝脏组织差异性VOCs为丙酮和正戊醇,如图1所示.
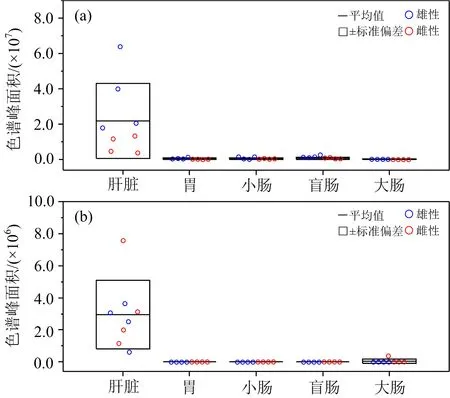
图1 肝脏差异性挥发物丙酮(a)和正戊醇(b)及其源于其他组织的色谱峰面积
由图1可知,每只大鼠肝脏中测得的丙酮含量均高于其他器官组织,且丙酮的含量也远高于另一种差异性VOC正戊醇.
丙酮是酮体(β-羟丁酸、乙酰乙酸和丙酮)的主要成分,已有研究表明肝脏中的脂肪酸分解并生成酮体[9].在之前的鼠类研究中,丙酮也曾在Wistar大鼠呼气中被检测到[10],肝脏是机体挥发物中丙酮的主要来源.在人体疾病研究中,糖尿病[11]、非酒精性脂肪肝(NAFLD)[12]、肝硬化和肝癌[13]、结直肠癌[14]、食管胃癌[15],甚至新冠肺炎患者呼气[16]中也观察到丙酮含量偏高.值得注意的是,节食和运动也能消耗脂肪从而使呼出的丙酮增加[17],因此,一旦丙酮作为疾病标志物时,有必要考虑患者的饮食不佳或者营养的过度消耗所带来的影响.此外,大鼠摄入丙酮实验发现肝微粒体和过氧化物酶体随之上调,促进脂肪酸氧化,并进一步合成葡萄糖,表明丙酮也是糖异生的重要前体[18].在大鼠及其肝细胞实验中,通过14C标记发现丙酮可形成葡萄糖为组织提供能源,丙酮有两种代谢途径:血液中低浓度丙酮经C3(甲基乙二醛和1,2-丙二醛)途径代谢,该途径在缺乏葡萄糖的情况下可以作为替代能源;而高浓度丙酮则通过醋酸盐代谢,最终转换成丙酮酸/乳酸进入三羧酸循环为机体供能[19].图1显示肝脏中丙酮含量具有性别差异,雄性大鼠肝脏中的丙酮均高于雌性大鼠,这可能与大鼠体重有关,实验中雄性大鼠体重较大且活动程度较为活跃,能量消耗可能较大,故代谢产生丙酮较多.
正戊醇是一种短链脂肪醇,被认为是猪肝脏制品脂源性挥发物[20].在全身性炎症[21]和出血性休克低血压[22]模型大鼠呼气VOCs研究中,正戊醇的含量都显著升高.在鸡的胚肝原代细胞中,发现正戊醇可以使5-氨基乙酰丙酸合成酶活性增加[23],该合成酶是血红素生物合成的限速酶,而肝脏是血红素合成的主要器官,血红素负责与氧结合并输送氧气.猜测肝内正戊醇含量的增加可能与血红素与氧的结合与运输有关.
2.2.2 盲肠差异性VOCs
大鼠盲肠组织差异性VOCs是苯酚、丙酸、丙基丙二酸和苯并噻唑(图2),其中,丙基丙二酸和苯并噻唑是首次在鼠类组织中被检测到.
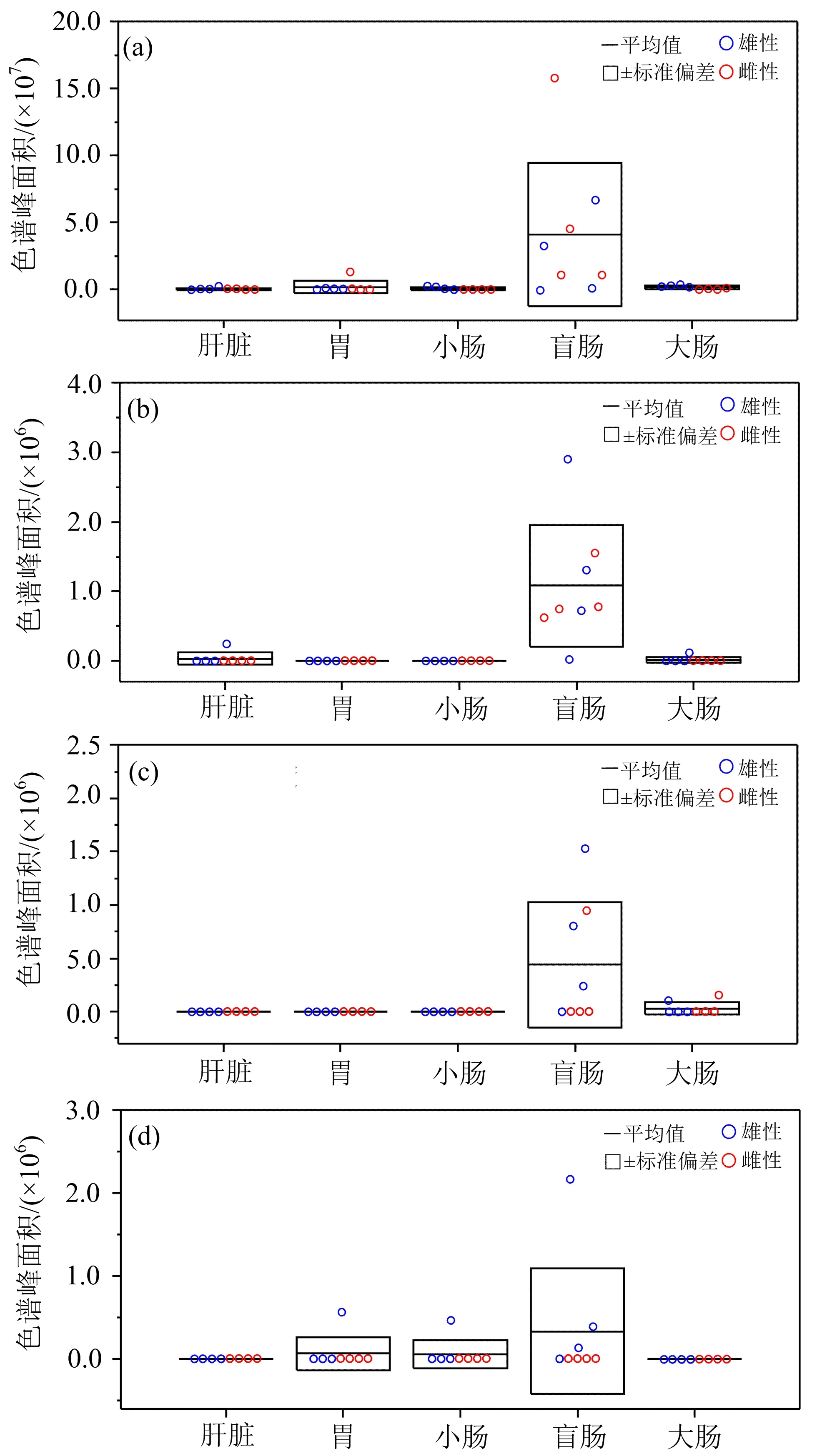
图2 盲肠差异性挥发物苯酚(a)、丙酸(b)、丙基丙二酸(c)和苯并噻唑(d)及其源于其他组织的色谱峰面积
肠道是一个复杂的微生态系统,盲肠处于小肠和大肠交汇处,储存着机体的排泄物.苯酚是肠道内兼性厌氧菌分解酪氨酸形成的代谢物[24],肠杆菌科(Enterobacteriaceae)中部分菌株也可以产生苯酚,例如产酸克雷伯氏菌(Klebsiellaoxytoca)、产气肠杆菌(Enterobacteraerogenes)等[25].在添加酪氨酸饮食的大鼠实验中,发现大鼠粪便、盲肠内容物和血清中的酚类(苯酚和对甲酚)含量会增高,且血清与盲肠内容物中的酚类浓度有相关性,因而血液中酚类被认为是来自于盲肠的内容物[26],这与笔者实验观测结果一致.在硫酸镁诱导的渗透性腹泻模型小鼠中,发现小鼠粪便中的苯酚增加[6].对人体的研究表明,人的粪便[27]和呼气[28]中含有苯酚,且胃食管癌患者呼出的苯酚浓度显著增加[29].苯酚异常与肠道微生物变化相关[28],可作为监测肠道菌群紊乱的标志物.此外,酚类物质的增加还可以通过血液循环在皮肤中积累,损害皮肤角质形成细胞的分化,导致干燥等皮肤问题[30],还有假说认为胃肠道菌群活动产生的苯酚是白血病的致病因素之一[31].
前人在大鼠盲肠内容物中也观测到了包括丙酸在内的短链脂肪酸(short-chain fatty acids, 简称SCFAs)[32],并且盲肠内容物产生的SCFAs是乙状结肠/直肠内容物的8倍[33].人体研究表明,作为一种短链脂肪酸,丙酸主要来源于肠道细菌分解发酵肠道中的膳食纤维(多糖、低聚糖和抗性淀粉)[34],因此,测量呼气中的丙酸可以了解膳食纤维代谢状况[35]或者监测肠道菌群分布[36].
丙基丙二酸在接种炭疽菌(Colletotrichumgloeosporioides)的芒果中被检测到,被认为是有毒真菌感染的标志物[37].大鼠盲肠内丙基丙二酸的产生可能是来自肠道中微生物的发酵,其生化机制还需要进一步研究.
苯并噻唑是一种双环结构分子,具有抗癌、抗菌、抗炎、抗病毒等活性,也是治疗药物合成的前体物[38].苯并噻唑曾在健康人呼气中被观测到[39],有证据表明苯并噻唑来自半胱氨酸和苯醌衍生物的加成合成[40].苯并噻唑类化合物可以改善高脂模型小鼠的抗氧化能力[41],苯并噻唑衍生物对金黄色葡萄球菌、大肠杆菌等具有抗菌活性[42].
3 结束语
笔者采用SPME-GC-MS对Wistar大鼠消化系统主要器官组织的VOCs进行了检测,通过色谱峰的非靶向统计分析,获得了6种差异性VOCs,即肝脏中的丙酮、正戊醇以及盲肠中苯酚、丙酸、丙基丙二酸、苯并噻唑,并对这些差异性VOCs的生化来源、相关标志物进行了讨论.
通过离体实验获取大鼠在健康状况下消化系统器官的差异性VOCs,期望为人体消化系统的器官的异常VOCs研究提供参考.但该研究也存在一定的局限性,进行的是大鼠解剖后的离体器官VOCs测量,而不是在体原位检测,获得的结果与活体器官可能存在一定差异.在147个色谱峰的非靶向分析中,只开展了单个消化系统的器官差异性VOCs的统计,未来有必要对每种器官释放的VOCs进行详细分析研究,结合大鼠呼气实验,为疾病的呼气VOCs标志物研究提供模型动物实验依据.
