正丁酸钠对肺腺癌细胞增殖、凋亡和Notch信号通路的影响
2022-11-22罗美玲廖小娟
罗美玲 廖小娟
(1 郴州市第一人民医院呼吸内科,湖南省郴州市 423000; 2 湖南中医药大学第二附属医院中医科,湖南省长沙市 410005)
近年来,随着环境污染的加剧及吸烟人数的急剧上升,肺癌患者逐年增加,肺腺癌已经成为我国最常见的肺癌类型之一[1-2]。目前肺腺癌的治疗方法主要以手术治疗及放化疗为主[3-4]。临床上常使用相关药物辅助化疗,以增强化疗对癌细胞的杀伤能力。正丁酸钠是具有提高组蛋白乙酰化水平的组蛋白去乙酰化抑制剂,Shi等[5]发现,正丁酸钠可以抑制胃癌细胞的增殖和迁移;罗娟等[6]发现,正丁酸钠可以抑制宫颈癌细胞的增殖并促进其凋亡;刘恒铫等[7]的研究表明,肺癌的恶性生物学特征与Notch信号通路关系密切。因此,我们推测正丁酸钠对肺腺癌细胞的增殖和凋亡也有一定的影响,其作用机制可能与Notch信号通路相关。故本研究探讨正丁酸钠对肺腺癌细胞增殖、凋亡和Notch信号通路的影响。
1 材料与方法
1.1 主要材料 肺腺癌细胞购于中国科学院细胞库;正丁酸钠购自Aladdin公司(CAS号:107-92-6;产品编号:B110442),Ki-67抗体(货号:ab205718)、增殖性细胞核抗原(proliferating cell nuclear antigen,PCNA)抗体(货号:ab205871)、Notch受体1(NOTCH1)抗体(货号:ab52627)、Hes家族BHLH转录因子1(Hes family BHLH transcription factor 1,HES1)抗体(货号:ab108937)、周期素D3(cyclin D3)抗体(货号:ab183338),GAPDH(货号:ab8245)均购自Abcam公司,B细胞淋巴瘤-2(B-cell lymphoma-2,Bcl-2)抗体(货号:sc-7382)、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)抗体(货号:sc-7480)均购自Santa Cruz公司,MTT试剂(货号:YB111105-500)购自Ybscience公司,RPMI 1640 培养基、胎牛血清均购自HyClone公司,二甲基亚砜(货号:D2650)购自Sigma公司,Annexin Ⅴ-FITC细胞凋亡检测试剂盒(货号:XG-X6556)购自上海西格生物科技有限公司,碘化丙啶(货号:YT8633)购自北京伊塔生物科技有限公司。WMJ-9688正置金相显微镜购自上海无陌光学仪器有限公司,CytoFLEX流式细胞仪购自贝克曼有限公司,SpectraMax iD3多功能酶标仪购自美国Molecular Devices公司。
1.2 实验方法
1.2.1 细胞培养及传代:肺腺癌细胞培养于含10%胎牛血清、100 U/mL 青霉素/链霉素的RPMI 1640培养基中,置于37 ℃、5% CO2培养箱中培养,细胞融合约90%时传代培养,取第3代细胞进行实验。
1.2.2 MTT法检测正丁酸钠对肺腺癌细胞生长抑制效果:将肺腺癌细胞以5 000个/孔的密度接种于96个孔板中,细胞贴壁生长后每孔分别加入正丁酸钠,使其终浓度分别为0 mmol/L、1.25 mmol/L、2.50 mmol/L、5.00 mmol/L、10.00 mmol/L、20.00 mmol/L、40.00 mmol/L,置于培养箱继续培养(培养条件同1.2.1),分别于培养24 h、48 h、72 h后加入10 μL MTT溶液孵育4 h,再加入100 μL二甲基亚砜孵育0.5 h,使用SpectraMax iD3型酶标仪检测570 nm波长处的光密度(A)值。计算抑制率,抑制率=[(1-不同浓度正丁酸钠组A值)/0 mmol/L正丁酸钠组A值]×100%。实验重复6次。
1.2.3 分组及药物干预:根据1.2.2肺腺癌细胞生长抑制情况,将5.00 mmol/L、10.00 mmol/L、20.00 mmol/L正丁酸钠作为后续实验的干预浓度,干预时间为72 h(实验组);同时设置对照组,不进行任何干预。
1.2.4 Western blot检测蛋白表达水平:提取1.2.3干预后的各组肺腺癌细胞总蛋白[8],采用Bradford法测定各组细胞蛋白浓度,取70 μg蛋白,通过SDS-PAGE分离等量蛋白并转至PVDF膜上,5%脱脂奶粉室温密封2 h, TBST洗膜4次,10 min/次,然后加入Ki-67抗体、PCNA抗体、Bcl-2抗体、Bax抗体、NOTCH1抗体、HES1抗体、cyclin D3抗体和GAPDH抗体(均加入8 mL,稀释比均为1 ∶500),4 ℃摇床孵育过夜,TBST洗膜4次,10 min/次,加入8 mL经辣根过氧化物酶标记的上述抗体二抗(稀释比为1 ∶500),室温继续孵育1 h,TBST洗膜4次,10 min/次,化学反应显影曝光后,采用DNR Bio Imaging System软件分析目标蛋白与内参蛋白GAPDH条带的灰度值比值。实验重复6次。
1.2.5 克隆形成实验:取1.2.3处理后的各组肺腺癌细胞,培养2周(培养条件同1.2.1),多聚甲醛固定15 min,0.1%结晶紫染色30 min,然后在显微镜下统计克隆细胞数目,克隆形成率=(实验组克隆细胞数目/对照组克隆细胞数目)×100%。实验重复6次。
1.2.6 流式细胞术检测细胞凋亡率:取1.2.3处理后的各组肺腺癌细胞,使用0.25%不含乙二胺四乙酸的胰蛋白酶对细胞进行消化2 min,在4 ℃下以1 000 r/min离心5 min后弃上清,用PBS清洗2次(1 min/次)后再加入Binding Buffer悬浮细胞,加入5 μL Annex Ⅴ-FITC和10 μL 碘化丙啶,避光静置30 min,采用流式细胞仪检测细胞凋亡率。
1.3 统计学分析 采用SPSS 22.0软件进行统计学分析,采用GraphPad Prism 5软件进行图像处理。计量资料以(x±s)表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验;重复测量资料的比较采用重复测量方差分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 不同浓度正丁酸钠对肺腺癌细胞的抑制效果 各组肺腺癌细胞的抑制率比较,差异有统计学意义(F组间=3 632.000,P组间<0.001);各组肺腺癌细胞的抑制率均有随培养时间增长而升高的趋势(F时间=106.800,P时间<0.001);分组与时间有交互效应(F交互=18.860,P交互<0.001)。其中,培养24、48、72 h后,5.00 mmol/L正丁酸钠组、10.00 mmol/L正丁酸钠组、20.00 mmol/L正丁酸钠组、40.00 mmol/L正丁酸钠组肺腺癌细胞的抑制率均高于0 mmol/L正丁酸钠组(均P<0.05);5.00 mmol/L正丁酸钠组、10.00 mmol/L正丁酸钠组、20.00 mmol/L正丁酸钠组、40.00 mmol/L正丁酸钠组肺腺癌细胞培养72 h后的抑制率均高于同剂量组培养24 h和48 h后的抑制率(均P<0.05),见表1。由此说明正丁酸钠作用72 h后,对肺腺癌细胞的抑制效果较24 h、48 h更显著,且正丁酸钠浓度为5.00 mmol/L、10.00 mmol/L、20.00 mmol/L时,表现出快速抑制肺腺癌细胞生长的趋势,故选择上述浓度和作用时间作为后续实验的干预条件。
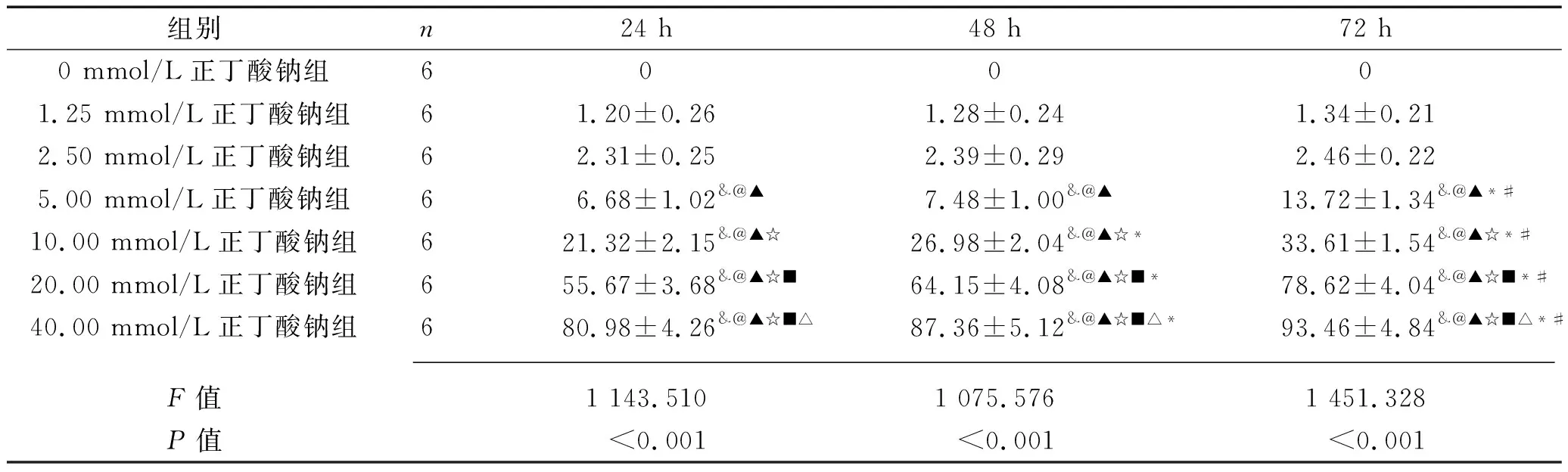
表1 不同浓度正丁酸钠对肺腺癌细胞抑制率的比较(x±s,%)
2.2 正丁酸钠对肺腺癌细胞增殖相关蛋白表达水平及克隆形成率的影响 对照组、5.00 mmol/L正丁酸钠组、10.00 mmol/L正丁酸钠组、20.00 mmol/L正丁酸钠组的Ki-67、PCNA蛋白表达水平和克隆形成率均依次降低(均P<0.05)。见图1、图2、表2。
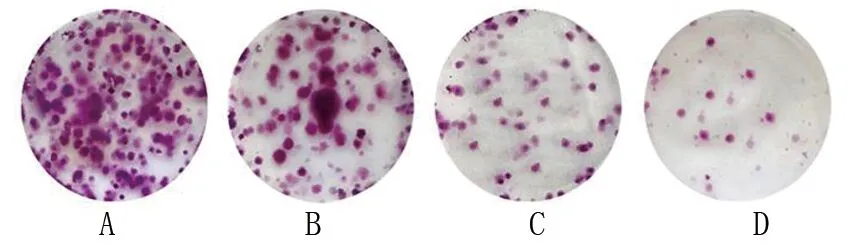
图1 不同浓度正丁酸钠组肺腺癌细胞的克隆形成情况
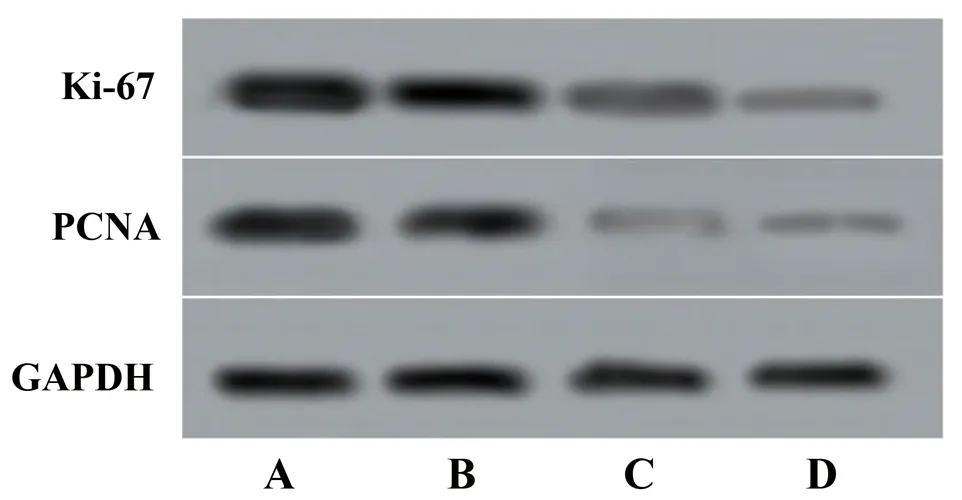
图2 不同浓度正丁酸钠组肺腺癌细胞增殖相关蛋白的表达情况

表2 不同浓度正丁酸钠组肺腺癌细胞增殖相关蛋白相对表达水平及克隆形成率的比较(x±s)
2.3 正丁酸钠对肺腺癌细胞凋亡相关蛋白表达水平及凋亡率的影响 对照组、5.00 mmol/L正丁酸钠组、10.00 mmol/L正丁酸钠组、20.00 mmol/L正丁酸钠组的Bax蛋白表达水平、细胞凋亡率均依次升高,Bcl-2蛋白表达水平依次降低(均P<0.05)。见图3、表3。
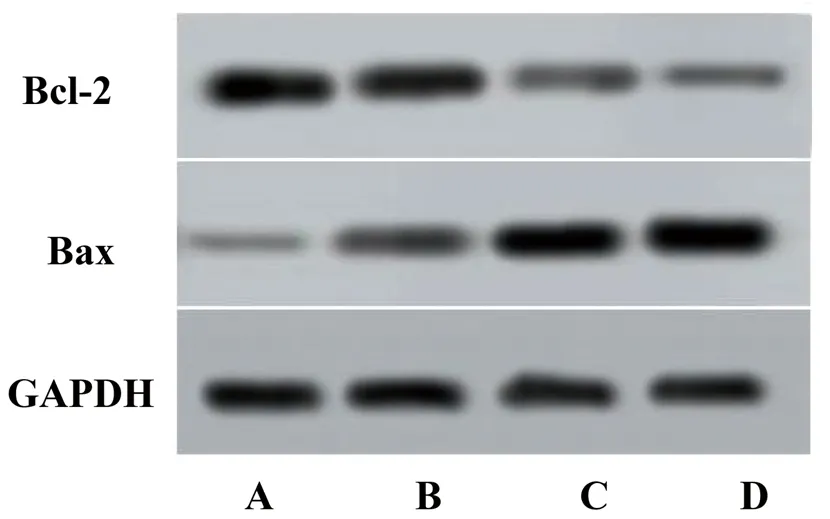
图3 不同浓度正丁酸钠组肺腺癌细胞凋亡相关蛋白的表达情况

表3 不同浓度正丁酸钠组肺腺癌细胞凋亡相关蛋白相对表达水平及凋亡率的比较(x±s)
2.4 正丁酸钠对肺腺癌细胞Notch信号通路相关蛋白的影响 对照组、5.00 mmol/L正丁酸钠组、10.00 mmol/L正丁酸钠组、20.00 mmol/L正丁酸钠组的NOTCH1、HES1和cyclin D3蛋白表达水平均依次降低(均P<0.05)。见图4和表4。
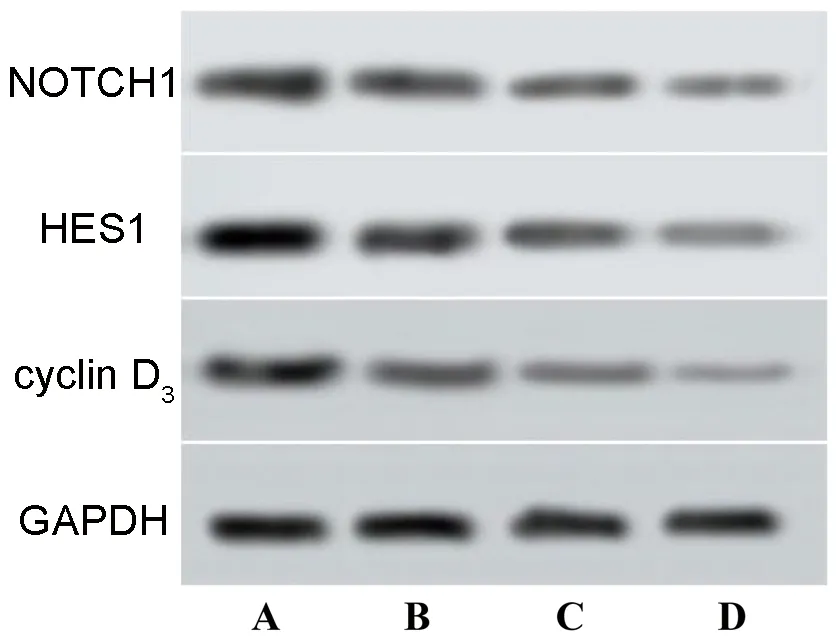
图4 不同浓度正丁酸钠组肺腺癌细胞Notch信号通路相关蛋白的表达情况

表4 不同浓度正丁酸钠组肺腺癌细胞Notch信号通路相关蛋白相对表达水平的比较(x±s)
3 讨 论
肺癌是常见的恶性肿瘤之一,非小细胞肺癌是肺癌的主要病理类型,肺腺癌属于非小细胞肺癌[9]。肺癌的病死率较高,其原因与肺癌细胞的恶性生物学特征,尤其是肺癌细胞的恶性增殖有关[10]。本研究结果显示,随着药物浓度的升高和培养时间的增长,正丁酸钠对肺腺癌细胞的抑制率逐渐升高(P<0.05),说明正丁酸钠可抑制肺腺癌细胞的生长,且具有浓度依赖性和时间效应。
肿瘤细胞的恶性生长是增殖、凋亡和侵袭等多种因素影响的结果,受到细胞增殖、细胞周期等相关基因和蛋白的调节[11]。研究表明,PCNA参与细胞周期的调控过程,Ki-67是反映细胞G1~S期增殖状态的敏感标志物,两者均可反映细胞增殖能力[12-13]。本研究结果显示,干预72 h后,对照组、5.00 mmol/L正丁酸钠组、10.00 mmol/L正丁酸钠组、20.00 mmol/L正丁酸钠组的Ki-67、PCNA蛋白表达水平和克隆形成率均依次降低(均P<0.05),与既往研究结果[14]相似,说明正丁酸钠可能是通过抑制PCNA、Ki-67蛋白的表达水平来发挥抑制肺腺癌细胞增殖的作用。
加快肿瘤细胞凋亡可以抑制其恶性生物学行为[15],细胞凋亡受多种基因、蛋白和信号通路的调节,包括Caspase、Bcl-2蛋白家族[16],而Bcl-2和Bax蛋白互相拮抗并共同调节细胞凋亡途径[17]。本研究结果显示,干预72 h后,对照组、5.00 mmol/L正丁酸钠组、10.00 mmol/L正丁酸钠组、20.00 mmol/L正丁酸钠组的Bax蛋白表达水平、细胞凋亡率均依次升高,Bcl-2蛋白表达水平依次降低(均P<0.05),与既往研究结果[6,18]相似,说明正丁酸钠可以通过调节Bcl-2家族蛋白表达水平来诱导肺腺癌细胞凋亡。
Notch信号通路参与细胞的生长、发育过程[19]。有研究表明,某些转录因子可以通过调节Notch信号通路加快肺腺癌的进展[20]。NOTCH1是Notch受体之一,刺激NOTCH1可以提高表皮生长因子受体的表达水平,从而促进肿瘤细胞的增殖[21]。在肿瘤细胞增殖过程中,cyclin D3蛋白是重要的周期蛋白,可以启动细胞周期的G1/S期,促进细胞的过度增殖[22]。HES1是典型的 Notch信号通路抑制因子,也是评估Notch信号通路活性的重要标志物。Notch可促进HES1诱导磷脂酰肌醇-3-激酶/蛋白激酶B信号通路的激活,抑制肿瘤细胞凋亡[23]。本研究结果显示,干预72 h后对照组、5.00 mmol/L正丁酸钠组、10.00 mmol/L正丁酸钠组、20.00 mmol/L正丁酸钠组的NOTCH1、HES1和cyclin D3蛋白表达水平均依次降低(P<0.05),说明正丁酸钠可能通过抑制Notch信号通路相关蛋白的表达,发挥抑制肺腺癌细胞增殖的作用。
综上所述,正丁酸钠可抑制肺腺癌细胞的生长、增殖并促进其凋亡,这可能与其抑制增殖相关蛋白和Notch信号通路相关蛋白的表达,以及促进凋亡相关蛋白的表达有关。
