屠宰场鸡源碳青霉烯耐药大肠埃希菌的耐药特征分析
2022-11-21孙乃岩龚倩梅胡建春李帆刘永仕黄金虎王丽平王晓明
孙乃岩,龚倩梅,胡建春,李帆,刘永仕,黄金虎,王丽平,王晓明*
(1.南京农业大学动物医学院,江苏 南京 210095;2.江苏省盐城市农业农村局,江苏 盐城 224005)
大肠埃希菌(Escherichiacoli)能引起人和动物多种感染,对养殖业和人类健康造成巨大威胁[1]。而抗生素的不合理和大量使用,导致大肠埃希菌耐药菌株尤其是多重耐药菌株不断出现。只有全面了解细菌耐药性产生和传播的机制,我们才能积累更多经验,挖掘出更多潜在的药物作用靶点,为新药研发提供参考,同时为合理用药及相关耐药菌的控制提供科学依据。因此,加强对耐药大肠埃希菌的监测以掌握其流行规律,深入研究阐明其耐药性产生和传播机制,仍是目前相关领域的研究重点。
碳青霉烯类抗生素为非典型β-内酰胺抗生素,具有抗菌谱广、抗菌活性强等特征,被誉为人医临床控制多重耐药革兰阴性菌感染的“防线”级药物[2],目前临床上常用的碳青霉烯类抗生素主要为美罗培南、亚胺培南、帕尼培南和厄他培南等。该类抗生素因其对产超广谱β-内酰胺酶(extended spectrum beta-lactamases,ESBL)和AmpC酶的肠杆菌科细菌具有非常好的治疗效果,被作为治疗重症革兰阴性杆菌感染的首选药物[3]。随着近年来碳青霉烯类抗生素的广泛应用,碳青霉烯耐药肠杆菌科菌株(carbapenem-resistant Enterobacteriaceae,CRE)不断出现,给临床感染治疗带来严峻挑战[4]。2017—2020年中国细菌耐药监测结果显示,肠杆菌科细菌对亚胺培南、美罗培南及厄他培南耐药率整体呈上升趋势,其中大肠埃希菌对亚胺培南和美罗培南的耐药率分别上升到2.0%和2.1%[5-7]。该类抗生素虽然未被批准用于动物养殖业,但是有研究表明blaNDM已在动物源细菌中出现,存在引起重大公共卫生事件的潜在风险[8-10],故引起世界各国研究者的极大关注。
本研究对2019年鸡源碳青霉烯耐药大肠埃希菌的流行情况和耐药分子特征进行研究,旨在了解动物源碳青霉烯耐药大肠埃希菌的耐药现状和分子遗传特征,进一步探索认识其分子遗传规律,从而为养殖场的合理用药提供科学依据。
1 材料与方法
1.1 材料
1.1.1 样品来源于2019年10月至11月江苏省常州市某屠宰场累计采集鸡盲肠样本共201份。MIC试验质控菌株为大肠埃希菌ATCC25922,接合试验受体菌大肠埃希菌J53为本课题组保存。
1.1.2 试剂和药物LB肉汤、LB琼脂、BHI肉汤、麦康凯琼脂、MH肉汤均购于青岛海博生物技术有限公司。恩诺沙星(E114258-25g)、环丙沙星(C119326-5g)购自Aladdin公司;头孢噻呋钠(S30940-5g)、替加环素(S24031-5g)购自源叶生物公司;硫酸庆大霉素(G810322-5g)、美罗培南(M861173-1g)、阿莫西林(A832367-5g)、氨苄西林(A830931-5g)购自Macklin公司。DNA 标准品、2×TaqPCR Master Mix和琼脂糖购自日本TaKaRa公司;溴化乙锭购自北京鼎国公司。
1.2 方法
1.2.1 细菌的分离与鉴定用无菌剪刀在鸡盲肠剪开一小口,用一次性接种环蘸取靠近盲肠端的内容物,于添加有万古霉素(30 μg·mL-1)和美罗培南(0.5 μg·mL-1)的麦康凯培养基上划线接种。挑取疑似单菌落克隆纯化培养3次。通过基质辅助激光解吸飞行时间质谱(MALDI-TOF-MS)进行菌株种属鉴定。具体操作方法参照文献[11]。获得的菌株通过16S rRNA基因扩增比对,引物参照文献[12]合成。序列为8F:5′-AGTTGATCCTGGCTCAG-3′,1492R:5′-TACGGCTACCTTGTTAGGACTT-3′,最后使用20%(体积分数)甘油保藏于-80 ℃冰箱。将分离株于LB平板上划线,37 ℃培养12~24 h复苏,挑单克隆用于后续研究。
1.2.2 碳青霉烯耐药基因检测水煮法提取细菌DNA,采用PCR法检测美罗培南耐药大肠埃希菌中碳青霉烯酶基因(NDM、KPC、VIM、OXA、IMP)的携带情况。参照文献[13]合成碳青霉烯耐药基因(blaNDM、blaKPC、blaVIM、blaOXA、blaIMP)引物序列(表1)。PCR反应体系(25 μL):正、反向引物(10 μmol L-1)各 1 μL,模板 2 μL,2×TaqMix 12.5 μL,无菌去离子水8.5 μL。PCR反应条件:95 ℃ 5 min;95 ℃ 15 s,55 ℃ 1 min,72 ℃ 1 min,32个循环;72 ℃ 10 min。PCR产物经15 g·L-1琼脂糖凝胶电泳,溴化乙锭染色后观察。阳性PCR产物送上海生工生物工程有限公司测序,测序结果提交NCBI进行比对,确定基因型。

表1 碳青霉烯耐药基因的引物对序列及预期产物大小Table 1 Primers pairs sequences and product size of carbapenem resistance genes
1.2.3 药物敏感性试验按照美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)[14]推荐的微量肉汤,稀释测定8种抗菌药对临床分离的大肠埃希菌及质控菌株大肠埃希菌ATCC25922的最小抑菌浓度(MIC),再根据CLSI的耐药折点进行结果判断。
1.2.4 接合试验接合转移试验及接合转移频率的计算参照朱家杭[15]的报道,以blaNDM阳性菌为供体菌,大肠埃希菌J53为受体菌,检测blaNDM在菌株间的转移情况。若在含有叠氮钠(100 μg·mL-1)和美罗培南(2 μg·mL-1)的双抗平板上有菌落生长,则挑取单克隆菌落于LB肉汤中,于37 ℃、180 r·min-1振荡培养。细菌培养物按照1.2.2节方法进行blaNDM基因的检测。接合转移频率(F)=接合子生长数量/受体菌生长数量。
1.2.5 体外适应性分析通过生长曲线的测定以及体外竞争试验来评估受体菌J53获得携带blaNDM的质粒是否产生适应性代价。随机挑选1株接合成功的供体菌EC1、受体菌J53及对应的接合子EC1-J53,在LB平板上划线培养后,分别挑取单菌落接种于1 mL LB肉汤中,培养过夜后,将菌液浓度调至D600=0.1。将调好浓度的菌液按照1∶1 000(体积比)加入到10 mL新鲜的LB肉汤中,37 ℃、180 r·min-1振荡培养。每隔1 h采集菌液测定其D600值,试验重复3次。使用SPSS 22.0软件对数据进行多重比较分析。体外竞争试验参照文献[16]的方法进行优化。取生长至对数末期的受体菌J53和接合子EC1-J53的培养液调节D600至0.1,等比例混合后再以1∶100(体积比)转接到10 mL 新鲜LB肉汤中培养24 h。将起点(0 h)和终点(24 h)的混合菌液梯度稀释至合适浓度后分别涂在LB平板和含有4 μg·mL-1美罗培南的LB平板,37 ℃培养24 h后计数平板上的菌落数。根据下列公式计算相对适应性值(W):
W=ln(RF/RI)/ln(SF/SI)。
式中:RI和SI分别代表接合子和受体菌的初始数量;RF和SF分别代表混合液培养24 h后接合子和受体菌的数量。
1.2.6 质粒稳定性试验将接合子EC1-J53划线接种到LB固体培养基,挑取单菌落于1 mL LB肉汤中,37 ℃、180 r·min-1振荡培养过夜后,按照1∶1 000(体积比)比例接种至新鲜LB肉汤中,于37 ℃、180 r·min-1振荡培养24 h后以相同的比例再转接于新鲜LB肉汤,连续传代30 d。每3 d取1次菌液均匀涂布于LB固体培养基,37 ℃培养过夜。随机挑取固体培养基上的单菌落至新鲜LB肉汤中培养,再采用表1中所列引物对blaNDM进行PCR扩增,以检测质粒是否丢失。质粒在连续传代后的保留率代表质粒的稳定性。质粒保留率=抗性平板的菌落数/无抗平板的菌落数×100%。每组3个平行,试验重复2次。
1.2.7blaNDM阳性菌株的MLST分型根据文献[17]报道的引物序列合成大肠埃希菌adk、fumC、gyrB、icd、mdh、purA和recA管家基因引物(表2),PCR扩增blaNDM阳性菌株的7个管家基因,PCR产物送至上海生工生物工程有限公司测序,将双向测序结果整理后与标准序列比对剪切,结果上传提交至大肠埃希菌MLST 数据库(http://mlst.warwick.ac.uk/mlst/dbs/E.coli),获得各菌株所对应的各等位基因值,从而确定其序列型和ST型克隆群(clonal complexes,CC)。将各菌株的等位基因序列按照顺序进行连接,采用MEGA 6.06软件构建系统进化树,分析各菌株间相互关系。

表2 大肠埃希菌多位点序列分型(MLST)引物对序列Table 2 Primers pairs sequence for multilocus sequence typing(MLST)of Escherichia coli
2 结果与分析
2.1 碳青霉烯耐药大肠埃希菌的分离和鉴定
对201份鸡盲肠样品进行碳青霉烯耐药大肠埃希菌的分离、鉴定和纯化,再利用MALDI-TOF MS和16S rRNA基因序列比对,最后分离得到37株碳青霉烯耐药大肠埃希菌,分离率为18.4%。
转场技巧运用得当,可以增加观赏性和流畅性,丰富微视频的表现力;但若运用不当则会画蛇添足。后期剪辑时不能被软件中绚丽的转场特效所吸引,肆意添加,喧宾夺主,以至于破坏整体风格和节奏。转场技巧的运用,只有在符合主题、内容要求的基础上,才能发挥应有的作用[3]。会声会影中除了常用的转场效果外,也可以根据微视频的主题和节奏,自己设计富有个性的转场效果。
2.2 药敏试验结果
37株大肠埃希菌对6类8种抗菌药物的MIC测定结果及耐药率统计见表3。结果显示:分离菌株对各种抗菌药物的耐药率从高到低依次为阿莫西林(100%)、氨苄西林(100%)、美罗培南(100%)、头孢噻呋(100%)、恩诺沙星(97.30%)、环丙沙星(94.59%)、庆大霉素(72.97%)、替加环素(0%)。分离菌株对阿莫西林、氨苄西林、头孢噻呋都属于高水平耐药,耐药菌株MIC均在256 μg·mL-1以上。统计37株大肠埃希菌对5类抗菌药物的多重耐药情况,结果显示,分离菌株均为多重耐药(耐受药物种类≥3)菌株,其中耐受3种药物的占27%(n=10),耐受4种药物的占73%(n=27)。

表3 分离大肠埃希菌对8种抗生素的耐药率及MIC值分布Table 3 The resistance rates of E.coli strains against eight antibiotics and the distribution of MIC
2.3 碳青霉烯耐药基因的检测及耐药基因的水平转移
对37株菌进行相关碳青霉烯酶基因检测,结果显示所有菌株均携带blaNDM,未检测到其他几种相关基因。PCR产物测序后通过NCBI数据库进行比对,发现此次分离菌株的blaNDM均为blaNDM-5亚型。
随机选取6株blaNDM阳性菌进行接合转移试验。结果显示,6株菌的blaNDM-5均可以在菌株间进行水平转移,接合频率较高,为1.5×10-6~3.8×10-5。该结果也表明blaNDM-5是位于可接合质粒上,可以随质粒在菌株间进行水平转移。
2.4 体外适应性和竞争力分析
以培养时间为横坐标,D600值为纵坐标,使用GraphPad Prism 5.0 绘制生长曲线,结果见图1。使用SPSS 22.0软件进行方差分析和多重比较,发现接合子EC1-J53和受体菌J53的生长曲线无显著差异(P>0.05)。
受体菌与接合子按照1∶1(体积比)的比例混合培养24 h后,所获得的体外相对竞争生长力结果如图2所示。与亲本菌株J53相比,接合子EC1-J53存在一定的适应性代价(W=0.94)。
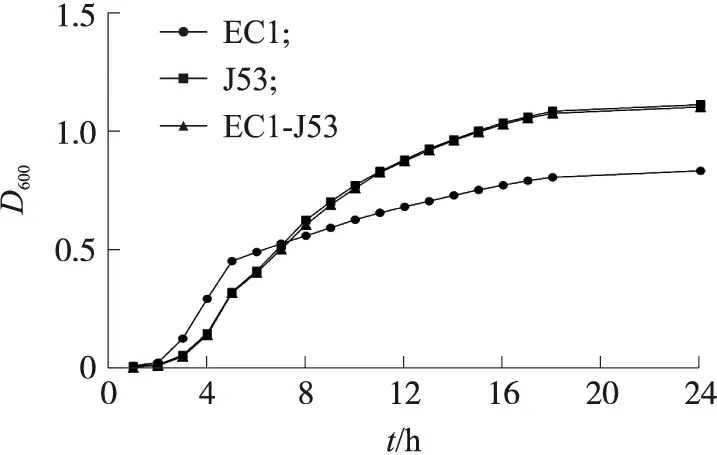
图1 受体菌、供体菌和接合子的生长曲线Fig.1 The growth curves of donor,recipient and transconjugant

图2 接合子的体外相对适应性值(W)Fig.2 Relative competitive fitness cost(W)of the transconjugant with the recipient
2.5 携带blaNDM的质粒在宿主菌中的稳定性
将接合子在LB肉汤中连续传代29 d后,发现携带有blaNDM的质粒仍稳定存在,在第30天时方可检测到丢失,但保留率仍高达98%。
2.6 blaNDM阳性菌株的MLST分型

图3 大肠埃希菌7个管家基因的PCR产物电泳图Fig.3 PCR products of 7 house-keeping genes of E.coli

表4 37株大肠埃希菌的MLST分型Table 4 MLST types of 37 strains of E.coli
2.7 种群进化分析
利用MEGA 6.06软件对37株12种ST型(每个ST的7个管家基因按一定的顺序进行拼接)进行MLST分型并绘制系统进化树(maximum likelihood tree)。结果(图4)显示:ST101与ST7593亲缘性较高,分为一组;ST354、ST362、ST2895亲缘性较高,分为一组;其他几种ST型无近缘关系。该研究结果表明碳青霉烯耐药大肠埃希菌的ST型呈多样性,部分菌株具有一致的ST型,证明blaNDM菌株可在不同动物间进行克隆传播。

图4 37株碳青霉烯耐药大肠埃希菌的MLST系统进化树Fig.4 MLST phylogenetic tree for the 37 strains of carbapenem-resistant E.coli
3 讨论
碳青霉烯耐药大肠埃希菌的出现及传播是全球面临的严峻问题[18],了解该类细菌的耐药情况、碳青霉烯耐药基因的分布特点及多位点序列分型,对于临床抗菌药物的选择及感染控制措施的制定具有很好的指导意义。
本研究显示碳青霉烯耐药大肠埃希菌不仅对碳青霉烯类抗菌药物耐药,而且对常用于治疗大肠杆菌感染的恩诺沙星、环丙沙星和庆大霉素等药物也呈高度耐药,与以往的报道一致[19-20]。由此可见,碳青霉烯耐药菌株多数会表现出多重耐药表型,需引起重视,这将会导致临床可供选择的抗CRE感染的药物谱不断变窄,对人和动物健康造成极大威胁。虽然本研究分离的碳青霉烯耐药大肠埃希菌仍对替加环素敏感,但是Sun等[21]研究结果显示共同携带有新型介导替加环素耐药的外排泵tmexCD1-toprJ1和介导碳青霉烯耐药的blaNDM基因的肺炎克雷伯菌可从鸡和病人体内分离得到。因此,对于由该类细菌造成感染的治疗可考虑采用替加环素联合用药治疗的策略。
产金属β-内酰胺酶(NDM)是引起大肠埃希菌对碳青霉烯耐药的主要机制[22]。本研究分离的菌株均检测到blaNDM-5,进一步证实blaNDM对碳青霉烯耐药并在大肠埃希菌中广泛存在,在动物源细菌中也逐渐扩散。blaNDM-5于2011年由Hornsey等[23]首次在大肠埃希菌中发现,随即引起广泛关注。与NDM-1相比,NDM-5有2个氨基酸位点发生了替换(88位Val→Leu和154位Met→Leu),这种替换使NDM-5水解 β-内酰胺类抗生素的能力显著增强[24]。目前,blaNDM-5已成为流行广泛的blaNDM变型体之一[24-26]。blaNDM可位于IncX3、IncA/C、IncL/M、IncF 和IncHI2等不相容质粒[27],并可通过接合方式在菌株之间进行水平传播。本试验结果也表明blaNDM-5是可转移的,推测位于可接合质粒;此外,宿主菌在获得该类质粒后仅表现为较小的适应性代价,与未获得质粒菌株在相同生长环境下有相当的体外相对竞争力,且该质粒即使在无抗菌药物时仍能稳定存在不易丢失,为blaNDM广泛而快速的传播创造了条件。因此需加强感染控制措施,防止该类基因的播散。
MLST作为一种有效的细菌基因分型方法,可以反映细菌种群内的进化关系。本试验MLST基因分型结果显示,37株blaNDM阳性大肠埃希菌的ST分型呈多样化并且分别属于不同的克隆群,表明该类细菌的播散复杂多样化,不同克隆群之间存在的水平传播使敏感菌成为耐药菌,部分ST型菌株间存在克隆传播。接合试验证实本次分离的菌株blaNDM基因均存在于可接合质粒上,表明可转移质粒在blaNDM基因的扩散中起重要作用。流行病学调查发现,ST131型大肠埃希菌是国际常见克隆流行株[28],我国流行的是ST167型,且发现ST167大肠埃希菌是blaNDM-5的主要宿主菌[29],但本研究未检出这2种优势ST型。本研究发现携带blaNDM-5的主要克隆型ST101,也曾在国外报道[30],并且国内王警等[31]从奶牛分离到1株携带有blaNDM-5大肠埃希菌为ST101型,提示ST101型大肠埃希菌可能是NDM-5型碳青霉烯酶的重要宿主菌之一。除此之外,还有13.5%(n=5)的大肠埃希菌为ST156型大肠埃希菌。目前ST156型大肠埃希菌已经传播到许多国家,并且可以从多种宿主中分离到。Sun等[32]从宠物猫样品中分离到1株同时携带blaNDM和mcr-1的ST156型大肠埃希菌,且这2个耐药基因共同位于一个IncX3-X4的杂合型质粒中。Yang等[33]从番鸭体内分离到1株携带blaNDM-5的ST156型大肠埃希菌,Tang等[34]首次从蛋鸡粪便中分离到 1株携带blaNDM-5的ST156型大肠埃希菌。表明大肠埃希菌ST156有可能在blaNDM-5基因的传播中发挥重要作用。从本研究构建的系统发育树可以看到,分离菌株遗传相似性较差,在进化上,ST101与ST7593亲缘性较高,ST354、ST362、ST2895亲缘性较高,其他几种ST型无近缘关系。
综上,本次从江苏省某屠宰场分离得到的鸡源碳青霉烯耐药大肠埃希菌对临床常用多种抗菌药物高度耐药,产生NDM-5酶是分离菌株对碳青霉烯类抗生素产生耐药的主要机制,且其编码的基因主要存在于可接合质粒上,易在大肠埃希菌中扩散。携带blaNDM的动物源大肠埃希菌可能会通过污染养殖场周围环境如土壤、水源以及农作物等,进而通过食物链威胁到人类健康和公共卫生安全,因此应加强动物源碳青霉烯耐药大肠埃希菌的常规监测,并深入开展该类菌耐药性产生和传播机制的基础性研究。
