SLE合并恶性淋巴瘤患者血清sIL-2R、HMGB1、25(OH)D3水平变化的意义及其与SLEDAI积分的相关性*
2022-11-21林福安黄晓璐郭月丽陈宏浦
林福安,黄晓璐,赵 婷,郭月丽,陈宏浦△
1.福建医科大学附属漳州市医院风湿免疫科,福建漳州 363000;2.漳州卫生职业学院,福建漳州 363000
系统性红斑狼疮(SLE)是一种多系统损害的慢性自身免疫性疾病,由于自身免疫系统紊乱,且长期服用激素和免疫抑制药物,SLE容易合并其他疾病,如恶性肿瘤,尤其是血液系统肿瘤[1-3]。恶性淋巴瘤(ML)是一种起源于淋巴组织或淋巴结的血液系统恶性肿瘤,当SLE合并ML时因二者临床表现相似,病情复杂难辨[4],因此,临床上迫切希望能找到对SLE合并ML有用的临床早期预警指标或是血清标志物。研究表明,某些细胞因子分泌紊乱可促进肿瘤细胞生长,其中可溶性白细胞介素2受体(sIL-2R)在B淋巴细胞生长、分化及成熟中发挥至关重要作用,参与免疫调节、肿瘤发生及生长,为关键的肿瘤生长因子[5-6];高迁移率族蛋白B1(HMGB1)在多种实体肿瘤组织及细胞中表达丰富,与肿瘤的发生、侵袭转移等生物学行为关系密切[7-8];维生素D作为人体内多种细胞的转录因子,可诱导肿瘤细胞分化,抑制肿瘤细胞增殖,加速肿瘤细胞凋亡,以及免疫调节等作用[9-10]。本研究通过观察SLE合并ML患者血清sIL-2R、HMGB1、25-羟维生素D3[25(OH)D3]水平,分析其与系统性红斑狼疮疾病活动指数(SLEDAI)积分的相关性,旨在为SLE合并ML的临床诊疗提供依据。
1 资料与方法
1.1一般资料 回顾性选取2015年1月至2015年12月福建医科大学附属漳州市医院收治的30例SLE合并ML患者作为观察组,另选取同期收治的30例未合并ML的SLE患者作为对照组。纳入标准:SLE诊断满足中华医学会风湿病学分会2010年发布的《系统性红斑狼疮诊断及治疗指南》中的SLE诊断标准[11];ML诊断符合2008年世界级卫生组织造血和淋巴组织肿瘤分类中ML诊断标准[12]。排除标准:纳入前3个月内接受活性维生素D、糖皮质激素类药物治疗患者;合并其他慢性疾病,如干燥综合征、类风湿关节炎、系统性硬化症、炎性肌病等患者;伴有严重感染患者;合并严重心肝肾疾病患者;伴有严重神经系统病变患者;哺乳期或妊娠期妇女。本研究获福建医科大学附属漳州市医院伦理委员会审核批准(批准号:漳医伦2015023号)。
1.2方法 抽取所有受试者清晨空腹状态下静脉血3 mL,以转速3 500 r/min、离心半径9.5 cm高速离心10 min,分离血清,将血清置于-80 ℃环境下保存待检;以双抗体夹心酶联免疫吸附试验测定sIL-2R、HMGB1、25(OH)D3水平,相应试剂盒均购自上海一研生物科技有限公司,操作严格遵循试剂盒说明书进行。
1.3观察指标 收集两组的临床资料,比较两组临床资料及血清sIL-2R、HMGB1、25(OH)D3水平,分析SLE合并ML的影响因素,评价SLEDAI积分、sIL-2R、HMGB1、25(OH)D3对SLE合并ML的诊断价值,并进行个体值预测验证,分析sIL-2R、HMGB1、25(OH)D3与SLEDAI积分相关性。

2 结 果
2.1两组临床资料及血清sIL-2R、HMGB1、25(OH)D3水平比较 两组年龄、性别、体质量指数(BMI)、SLE病程、吸烟史、饮酒史比较,差异无统计学意义(P>0.05);观察组SLEDAI积分及血清sIL-2R、HMGB1水平明显高于对照组,25(OH)D3水平明显低于对照组,差异均有统计学意义(P<0.05)。见表1。

表1 两组临床资料及血清sIL-2R、HMGB1、25(OH)D3水平比较或n(%)]
2.2SLE合并ML影响因素的Logistic回归模型分析 以SLE患者是否合并ML为因变量(否=0,是=1),以SLEDAI积分、sIL-2R、HMGB1、25(OH)D3作为自变量(赋值以各指标均值为界,≤均值=0,>均值=1),构建Logistic回归模型,分析结果显示,SLEDAI积分、sIL-2R、HMGB1是SLE合并ML的独立危险因素,25(OH)D3是SLE合并ML的独立保护因素(P<0.05)。见表2。

表2 SLE合并ML影响因素的Logistic回归模型分析
2.3SLEDAI积分、sIL-2R、HMGB1、25(OH)D3对SLE合并ML的诊断价值 以观察组作为阳性样本,对照组作为阴性样本,绘制ROC曲线,结果显示,SLEDAI积分、sIL-2R、HMGB1、25(OH)D3单独诊断SLE合并ML的AUC分别为0.728、0.779、0.741、0.711;利用Stata10.0软件中Predict pre1命令,将SLEDAI积分、sIL-2R、HMGB1、25(OH)D3经Logistic回归模型拟合生成联合预测因子,使用roctab sepsis pre1,d命令,列出联合预测因子取不同值时对应的灵敏度、特异度和预测准确率,取约登指数为最大值时联合预测因子所对应的数值作为最佳临界值(即0.045),得到SLEDAI积分、sIL-2R、HMGB1、25(OH)D3联合诊断SLE合并ML的AUC为0.868,其较各指标单独诊断的价值明显提高。见表3、图1。
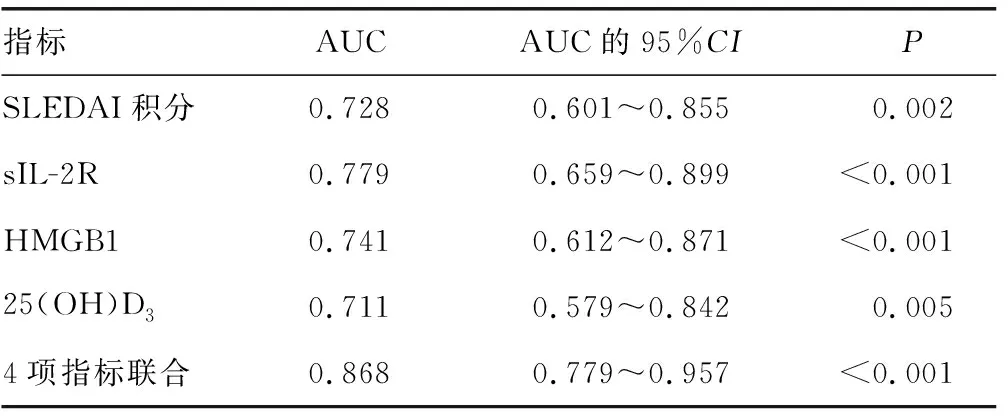
表3 SLEDAI积分、sIL-2R、HMGB1、25(OH)D3对SLE合并ML的诊断价值
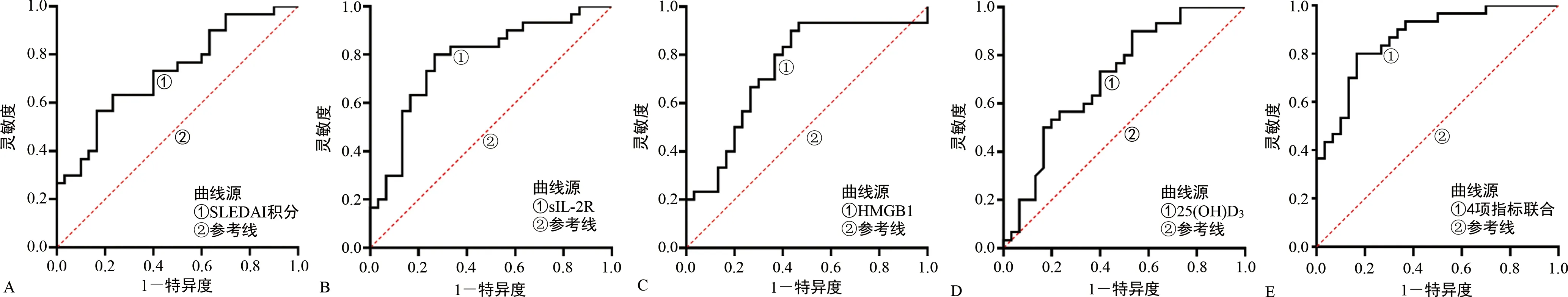
注:A、B、C、D分别为SLEDAI积分、sIL-2R、HMGB1、25(OH)D3单独诊断SLE合并ML的ROC曲线,E为4项指标联合诊断SLE合并ML的ROC曲线。图1 SLEDAI积分、sIL-2R、HMGB1、25(OH)D3诊断SLE合并ML的ROC曲线
2.4个体值预测验证 将原Logistic方程变形后得到个体的预测概率方程为P=1/{1+e-[-4.107+2.708×SLEDAI积分+2.589×sIL-2R+2.729×HMGB1-1.299×25(OH)D3]},其中e为自然对数的底数,保留3位小数点e=2.718。随机抽取1例患者,其各自变量取值为SLEDAI积分=1;sIL-2R=0;HMGB1=1;25(OH)D3=0,代入概率预测方程得到概率值P=0.265,大于最佳临界值,故在预测准确率为85.41%的条件下,该患者会发生ML,且符合临床实际。
2.5SLE合并ML患者血清sIL-2R、HMGB1、25(OH)D3水平与SLEDAI积分的相关性分析 Pearson相关分析结果显示,SLE合并ML患者血清sIL-2R、HMGB1水平与SLEDAI积分呈正相关(r=0.740、0.760,P<0.05),25(OH)D3水平与SLEDAI积分呈负相关(r=-0.745,P<0.05),见图2。
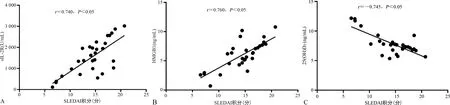
注:A为sIL-2R与SLEDAI积分间关系散点图;B为HMGB1与SLEDAI积分间关系散点图;C为25(OH)D3与SLEDAI积分间关系散点图。图2 sIL-2R、HMGB1、25(OH)D3与SLEDAI积分间关系的散点图
3 讨 论
近年来,随着临床对风湿免疫性疾病研究的不断深入,逐渐发现风湿免疫性疾病与恶性肿瘤之间存在着越来越多的联系,特别是关于原发性干燥综合征合并ML已有诸多报道,但对于SLE与恶性肿瘤,尤其是合并ML报道相对较少。相关研究指出,恶性肿瘤发生、发展过程中,可模拟风湿免疫性疾病表现,致使临床诊治延迟,而风湿免疫性疾病治疗期间大量应用细胞毒性药物及免疫抑制剂,也可明显增加恶性肿瘤患病风险[13]。国外学者对SLE患者随访发现,SLE患者肿瘤发生风险约为普通人群的1.4倍,并认为SLE主要与血液系统肿瘤有关[14]。因此,临床早期预警、诊断SLE合并ML尤为关键。
白细胞介素-2(IL-2)作为CD4淋巴细胞释放的淋巴因子,可增强自然杀伤细胞活性、促进T细胞增殖及细胞毒性T细胞的杀伤性,但IL-2只有结合IL-2R后才可发挥其生物学功能,当机体受到变应原入侵后,淋巴细胞被激活,大量分泌IL-2R,释放入血液中形成sIL-2R,故sIL-2R是反映淋巴细胞是否被抗原激活的敏感性标志物[15-16]。sIL-2R作为一种复合性黏蛋白,同时也是一种重要的免疫抑制剂,可减弱机体内分泌效应,抑制已活化T细胞克隆化扩增[17]。本研究中SLE合并ML患者血清sIL-2R水平明显高于SLE患者(P<0.05),sIL-2R主要由肿瘤细胞生成并释放入血,其表达水平反映机体免疫状态,推测sIL-2R可为SLE合并ML诊断提供重要参考。进一步研究显示,sIL-2R诊断SLE合并ML的AUC为0.779,充分证实上述观点,说明sIL-2R用于诊断SLE合并ML具有一定诊断效能。此外,本研究中SLE合并ML患者sIL-2R水平与SLEDAI积分呈正相关(r=0.740,P<0.05),提示随SLEDAI积分增加,SLE患者sIL-2R水平明显升高。
HMGB1是一种广泛存在于真核生物细胞内的非组蛋白染色质核蛋白,其过表达可抑制细胞凋亡、诱导细胞分化、促进细胞迁移及增殖等作用[18]。近年来,在肿瘤领域的研究发现,HMGB1在肺癌、结肠癌、胰腺癌、白血病、前列腺癌等恶性肿瘤中均呈现为高表达状态,与新生血管形成、肿瘤细胞增殖、侵袭转移及凋亡等密切相关[19-20],这提示HMGB1可能在肿瘤的发生过程中发挥至关重要的作用。本研究中SLE合并ML患者血清HMGB1水平明显高于SLE患者(P<0.05),其诊断SLE合并ML的AUC为0.741,提示HMGB1对SLE合并ML具有一定诊断效能,可为该病早期预警、诊断提供依据。另有研究指出,HMGB1高水平可抑制细胞凋亡,相反,抑制HMGB1分泌可促进细胞凋亡[21],提示HMGB1与恶性肿瘤病情程度有关。本研究中SLE合并ML患者HMGB1水平与SLEDAI积分呈正相关(r=0.760,P<0.05),说明随SLE疾病活动度增加,HMGB1水平明显升高,二者均与ML发病密切相关。
25(OH)D3作为体内维生素D主要存在形式,通常用于测定体内维生素D状态。现阶段有关维生素D的研究不断增加,发现其除了维持体内钙磷平衡的作用外,同时还存在诸多潜在的调节其他细胞功能,如血管生成、细胞凋亡、分化及免疫调节等[22-23]。25(OH)D3可在肾脏、淋巴瘤细胞等其他组织中经1-α羟化酶作用下转化为1,25(OH)2D3,而后者可通过结合维生素D转录因子受体发挥作用,进而调节将近200个基因表达[22]。此外,造血系统中维生素D受体表达于各种造血前体、单核细胞、部分胸腺细胞及活化的B、T淋巴细胞[24]。本研究中,SLE合并ML患者血清25(OH)D3水平明显低于SLE患者(P<0.05),表明维生素D水平在SLE合并ML患者体内明显下降,分析原因,可能是由于ML患者体内维生素D与造血系统中维生素D受体结合,发挥抑制肿瘤细胞增殖、促进凋亡的作用,导致维生素D消耗明显增加。同时,25(OH)D3诊断SLE合并ML的AUC值为0.711,且其水平与SLEDAI积分呈负相关(r=-0.745,P<0.05),充分证实维生素D可作为SLE合并ML疾病活动情况判断的一个标志物,并提示其可能是该疾病治疗的一个靶点。
进一步研究显示,SLEDAI积分、sIL-2R、HMGB1、25(OH)D3联合诊断SLE合并ML的AUC最大,且经个体值预测验证,4项指标联合诊断效能良好。
综上所述,SLE合并ML患者血清sIL-2R、HMGB1水平明显升高,25(OH)D3水平明显下降,且均与SLEDAI积分有关。检测血清sIL-2R、HMGB1、25(OH)D3水平,有助于早期预警、诊断SLE合并ML,并为临床诊疗提供依据。
