载药微球联合肝动脉化疗栓塞术对原发性肝癌患者的疗效观察
2022-11-21代树本李海霞王秀香
代树本,李海霞,王秀香,李 辉
沧州市第三医院介入科,河北沧州 061001
原发性肝癌(PHC)居于我国恶性肿瘤第4位,死亡率位于第3位[1]。PHC恶性程度较高,早期没有明显症状,肝功能轻微受损,而大部分中晚期患者失去了外科手术指征。肝动脉化疗栓塞术(TACE)是治疗PHC非手术治疗首选标准方式,经证实能缩小肿瘤体积,改善患者生存情况[2-3]。既往研究结果显示,TACE疗效并不稳定,PHC患者1年总体生存率为70.30%,2年为51.58%,3年为40.40%,5年仅有32.40%[4],亟待提升。载药微球是一种新型技术,属一种不可降解型载药微球[5],它通过加载正电荷蒽环类化疗药并促使其缓慢释放到病灶部位,进而辅助提升局部化疗药物浓度。目前关于载药微球联合TACE治疗PHC的研究已有报道,但未能完全明确其疗效。本研究探讨载药微球联合TACE治疗PHC的疗效,现将结果报道如下。
1 资料与方法
1.1一般资料 选择沧州市第三医院2019年9月至2021年2月诊治的134例PHC患者作为研究对象,使用随机数字表法将患者分成C-TACE组及D-TACE组,每组67例。C-TACE组中男性40例,女性27例;年龄41~73岁,平均(58.50±4.15)岁;临床分期(TNM):Ⅰ~Ⅱ期11例,Ⅲ~Ⅳ期56例;肝功能分级(Child-Pugh分级):A级59例,B级8例;病灶数目:多发20例,单发47例。D-TACE组,男性41例,女性26例;年龄40~77岁,平均(58.51±4.19)岁;TNM分期:Ⅰ~Ⅱ期10例,Ⅲ~Ⅳ期57例;Child-Pugh分级:A级61例,B级6例;病灶数目:多发22例,单发45例。两组患者性别、年龄、TNM分期、Child-Pugh分级及病灶数目比较,差异均无统计学意义(均P>0.05),具有可比性。纳入标准:(1)符合PHC规范化诊治专家共识中相关诊断标准;(2)无肝外转移;(3)患者知情同意;(4)预计生存期大于3个月。排除标准:(1)合并其他恶性肿瘤患者;(2)伴有心脑血管疾病患者;(3)合并门静脉主干癌栓或梗阻性黄疸患者;(4)妊娠期、哺乳期患者;(5)严重癌因疲乏患者。本研究经沧州市第三医院医学伦理委员会审核批准(审批号:20BZX072)。
1.2治疗方法 C-TACE组进行传统TACE治疗,治疗期间隔4周,在数字减影心血管造影设备监测下,导管经右侧股动脉插管进入肠系膜上动脉。造影后根据肿瘤大小及供血情况进行碘化油(上海万代制药有限公司,国药准字H20064893,规格10 mL)栓塞治疗,多次交替注射丝裂霉素(江苏恒瑞医药股份有限公司,国药准字H20023070,规格2 mg)10~15 mg、吡柔比星(浙江海正药业股份有限公司,国药准字H20045983,规格10 mg)20~40 mg、5-氟尿嘧啶(海南中化联合制药工业股份有限公司,国药准字H20051627,规格0.5 g,按氟尿嘧啶计)500~1 000 mg。治疗后7 d进行常规保肝治疗。D-TACE组使用载药微球联合TACE治疗,TACE治疗方案同C-TACE组。载药微球使用CalliSpheres微球(苏州恒瑞迦利生物医药科技有限公司),在栓塞时向动脉内缓慢推注,直至达到栓塞终点。终点标准:肿瘤血管血流变缓,2~5个心跳造影剂消失。
1.3评价指标
1.3.1标本采集 治疗前1 d及治疗结束后6个月时抽取两组患者外周肘静脉血8 mL,3 000 r/min离心处理10 min,取上层血清保存待检。
1.3.2肝功能指标检测 使用全自动生化分析仪(NSA-400型,沈阳东软医疗系统有限公司)检测血清丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、总胆红素(TBIL)水平。
1.3.3肝癌细胞活力指标检测 使用酶联免疫吸附试验检测血清甲胎蛋白异质体3(AFP-L3)、高尔基体跨膜糖蛋白73(GP73)、α-L-岩藻糖苷酶(AFU)水平。AFP-L3试剂盒(货号EY2683)购于上海一研生物科技有限公司,GP73试剂盒(专利产品号200710107505.1)购于北京热景生物技术有限公司。αAFU试剂盒(货号FY-A014459)购于上海富雨生物科技有限公司。
1.3.4不良反应 统计两组患者恶心呕吐、发热、腹痛发生情况。
1.3.5近期疗效 治疗结束后随访6个月时,采用实体瘤疗效评价标准(mRECIST)评定近期疗效。完全缓解(CR):肝癌肿瘤消失至少4个月。部分缓解(PR):肝癌肿瘤缩小50%及以上至少4个月。病灶稳定(SD):肝癌肿瘤缩小不足50%或增大不足25%。疾病进展(PD):肝癌肿瘤增大25%及以上,或者出现一个或多个肝癌新病灶。临床总有效率=(CR例数+PR例数)/总例数×100%。

2 结 果
2.1两组近期疗效比较 D-TACE组临床总有效率高于C-TACE组,差异有统计学意义(P<0.05),见表1。
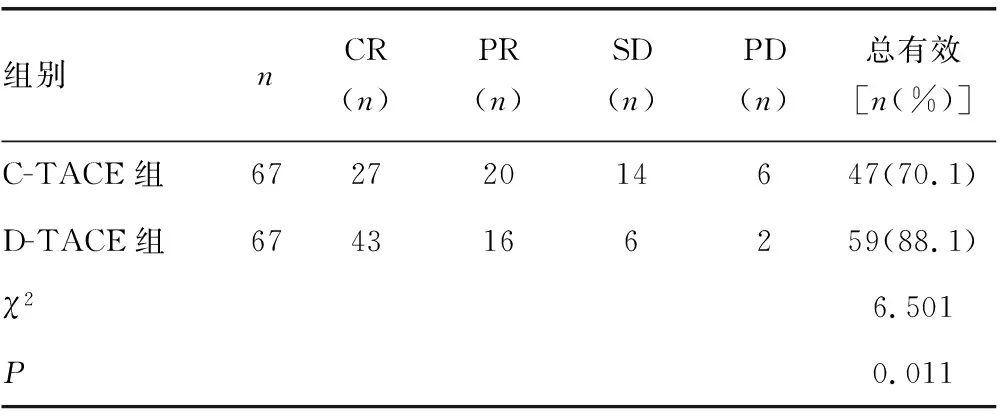
表1 两组近期疗效比较
2.2两组肝功能比较 治疗前,两组ALT、AST、TBIL水平差异均无统计学意义(P>0.05);治疗后,D-TACE组ALT、AST、TBIL水平低于C-TACE组,差异均有统计学意义(P<0.05),见表2。
表2 两组患者肝功能比较
2.3两组肝癌细胞活力比较 治疗前,两组AFP-L3、GP73、AFU水平差异均无统计学意义(P>0.05);治疗后,D-TACE组AFP-L3、GP73、AFU水平低于C-TACE组,差异均有统计学意义(P<0.05),见表3。

表3 两组肝癌细胞活力比较
2.4两组不良反应发生情况比较 D-TACE组患者不良反应发生率低于C-TACE组,差异有统计学意义(P<0.05),见表4。

表4 两组不良反应发生情况比较
3 讨 论
PHC发生机制较复杂,与多种因素有关,包括致癌基因、抑癌基因、吸烟、饮酒及遗传。对于PHC治疗以手术、栓塞为主[6-7]。中晚期不能进行手术的患者可以进行TACE治疗[8-9]。多项研究表明,TACE为主的综合治疗可以延长中晚期PHC患者生存时间,改善生存质量[10-11]。既往研究表明,TACE在促使肿瘤完全坏死上的有效率可高达20%,对PHC患者疗效较确切[12]。虽然TACE治疗可以控制PHC发展,延长患者生命,但反复TACE治疗会导致肝功能恶化,最终加重病情[13]。VOGL等[14]认为,TACE治疗后肝癌组织会发生广泛性缺氧,诱导血管内皮生长因子的激活和血管化,导致复发和转移。故而本研究建议使用TACE联合其他方式进行治疗。目前市场上的载药微球主要有生物降解型、非生物降解型两种,我国临床主要使用非生物降解型微球[15-16]。HepaSphere微球从药代动力学上可获得良好的栓塞效果,且释放药物能力突出。CalliSpheres载药微球是一种新型药物运输系统,通过向肿瘤体内注入相对大剂量的化疗药物,可以延迟药物释放时间,减少化疗药物进入全血系统引起的不良反应,可以同时发挥栓塞剂的栓塞作用和化疗药物的局部毒性,肿瘤的局部反应明显优于TACE。本次治疗使用50~100 μm 规格HepaSphere微球,经加载药物后其粒径达到了200~300 μm。
李富永等[17]的研究发现,使用载药微球联合TACE治疗后PHC患者AST、ALT及TBIL水平明显降低,总有效率为89.47%,该研究得出PHC患者治疗后的肝功能结果及近期疗效与本研究一致。TACE可抑制肝癌细胞活力,诱导肝癌细胞发生凋亡。载药微球具有较好韧性及可塑性,对肿瘤病灶供血血管的栓塞作用更好。载药微球用于TACE能更有效地诱导肝癌细胞发生凋亡,进而抑制肝癌细胞活力,本研究中D-TACE组AFP-L3、GP73、AFU水平较C-TACE组低,也证实了该结论。同时,D-TACE组患者不良反应率为6.0%,明显低于C-TACE组的25.4%(P<0.05),也低于蒲长宇等[18]报道的21.36%。常规TACE栓塞剂由碘化油及化疗药物混合而成,碘化油乳剂随血液进入全身循环系统,从而增加了恶心呕吐、发热、腹痛等不良反应。同时病灶部位局部药物浓度降低,肿瘤周围侧支循环冲刷碘化油,引起栓塞不彻底,进而影响预后效果。载药微球配合TACE的加载药物量大,能满足治疗需求,其位置相对固定,不易随血流移动,既能提高肿瘤组织内的药物浓度,延长化疗药物作用时间,也能减少相应化疗药物进入人体循环系统[19-20],减轻不良反应。
综上所述,载药微球联合TACE治疗PHC,既能改善肝功能,提升近期疗效,又能抑制肝癌细胞活力,减轻不良反应。
