基于免疫检查点抑制剂靶向胰腺癌微环境的联合免疫治疗策略
2022-11-21雷静玉罗宝花赵菊梅师长宏
雷静玉,罗宝花,赵菊梅,师长宏
(1.延安大学医学院,陕西 延安 716000;2.空军军医大学实验动物中心,西安 710032;3.广州中医药大学科技创新中心,广州 510405)
胰腺癌(Pancreatic cancer,PC)是一种较为难治且恶性程度极高的肿瘤,其发病隐匿,进展迅速[1-4]。 手术切除是目前治疗胰腺癌的主要手段,然而,即使是接受手术治疗的患者其术后5 年生存率不超过20% ~ 25%[5-6],因此,迫切需要寻找新的治疗方式来提高胰腺癌的治疗效果。 免疫治疗是继手术、放疗、化疗后的一种新的抗肿瘤治疗方式,其中以免疫检查点抑制剂的治疗效果最为突出,其在非小细胞肺癌、黑色素瘤、淋巴瘤、肾细胞癌等恶性肿瘤中已显示出良好的治疗效果[7-11]。 但临床数据显示,单一的免疫检查点抑制剂对治疗胰腺癌患者并没有起到良好的抗肿瘤作用,这可能与其独特的肿瘤微环境(tumor microenvironment,TME) 有关[12]。 胰腺癌微环境中存在致密的基质成分并有广泛的免疫抑制细胞浸润,被认为是一种免疫学上的“冷”肿瘤[13-15]。 应用联合疗法,促使低免疫反应的“冷”肿瘤转变成对免疫治疗敏感的“热”肿瘤将是肿瘤免疫治疗的下一步发展方向[16]。 针对胰腺癌微环境的特定位点进行靶向调节,从而改善胰腺癌肿瘤微环境的状态,促使肿瘤微环境由免疫抑制状态向免疫激活状态转变,激活大量免疫效应细胞并浸润到肿瘤微环境中,可能能够增强免疫检查点抑制剂的抗肿瘤效果。 因此,联合免疫检查点抑制剂和靶向治疗可能是延长胰腺癌患者生存期的有效策略。
1 免疫检查点抑制剂
目前常用的免疫检查点主要有细胞毒性T 淋巴细胞相关抗原4(cytotoxic T lymphocyte associated antigen-4,CTLA-4)、程序性死亡受体-1(programmed death-1,PD-1)及其配体(programmed death ligand-1,PD-L1)等[17]。 应用免疫检查点抑制剂能够增强效应T 细胞的活性,进而增强抗肿瘤效应[18]。 临床数据表明,免疫检查点抑制剂对于部分肿瘤具有显著的抑瘤作用,然而在胰腺癌的治疗中,治疗效果并不明显[19-20]。 在一项Ⅱ期临床试验中,27 名胰腺癌患者接受抗CTLA-4 单抗Ipilimumab 的治疗后患者情况未见缓解[21],在另一项抗PD-L1 单抗治疗的Ⅰ期临床试验中,14 名胰腺癌患者在接受单药治疗后的效果同样令人失望[22],这些研究结果表明胰腺癌患者对单一免疫检查点抑制剂治疗的获益甚微。 单一的免疫检查点抑制剂对胰腺癌的疗效不佳,这很可能与胰腺癌独特的肿瘤微环境有关。
2 胰腺癌的肿瘤微环境
胰腺癌的肿瘤微环境是一个相对复杂且有利于肿瘤细胞生长的内环境,其微环境的一个显著特点就是存在大量致密的基质成分,包括成纤维细胞、血管、胰腺星状细胞(pancreatic stellate cell,PSC)等物质,这些致密的基质成分为胰腺癌细胞的生长提供了有利条件[23]。 此外,胰腺癌的肿瘤微环境中还存在着多种具有不同功能的免疫细胞[24],如具有抗肿瘤效应的CD4+/CD8+效应T 细胞、自然杀伤细胞(natural killer cell,NK cell)以及树突状细胞(dendritic cell,DC)等,这些免疫细胞在肿瘤微环境中含量较少;而具有免疫抑制功能的调节性T 细胞(regulatory T cells, Tregs)、 髓 源 性 抑 制 细 胞(myeloid-derived suppressor cells,MDSCs)以及肿瘤相关巨噬细胞(tumor associated macrophages,TAMs)在肿瘤微环境中大量存在,它们的功能十分活跃,能够分泌大量IL-10、IL-23、TGF-β、IDO 等免疫抑制因子,形成胰腺癌免疫抑制型肿瘤微环境,抑制免疫应答,造成免疫逃逸,从而影响胰腺癌的免疫治疗效果[25]。 胰腺癌独特的肿瘤微环境很可能是导致胰腺癌单一免疫检查点抑制剂治疗效果不佳的重要因素。 有研究表明,使用联合治疗策略能够逆转胰腺癌微环境的免疫抑制状态,使其对免疫检查点抑制剂产生应答[26]。 因此,基于免疫检查点抑制剂联合靶向胰腺癌肿瘤微环境的药物,很可能会是一种提高胰腺癌免疫治疗效果的有效策略。
3 基于免疫检查点抑制剂的靶向联合治疗策略
胰腺癌在免疫学上被认为是一种“冷”肿瘤,使用联合治疗可逆转其处于抑制的微环境状态,使其变成“热”肿瘤,对免疫治疗产生反应。 大量临床前动物模型和临床试验显示,免疫检查点抑制剂与放化疗联合应用仅略微的提高了患者的生存率,但却产生了显著的毒副作用[27-28]。 靶向治疗是一种在细胞分子水平进行的治疗方式,针对某些特定的致癌物质或者信号通路设计相对应的治疗药物,药物进入体内后会与相对应的位点发生特异性的结合,造成肿瘤细胞特异性的死亡而不会对周围正常细胞造成损伤[29],与传统放化疗相比,其特异性与安全性更高。 胰腺癌的肿瘤微环境主要由肿瘤细胞、免疫细胞及其周围的基质成分组成,研究证实,靶向TME 中的成分可诱导有效的免疫反应,改善胰腺癌的免疫治疗效果[30],因此,在使用免疫检查点抑制剂的基础上,可以靶向肿瘤细胞,也可以靶向胰腺癌肿瘤微环境中的相关免疫细胞和基质成分,从而达到增强免疫治疗疗效的目的(见表1)。
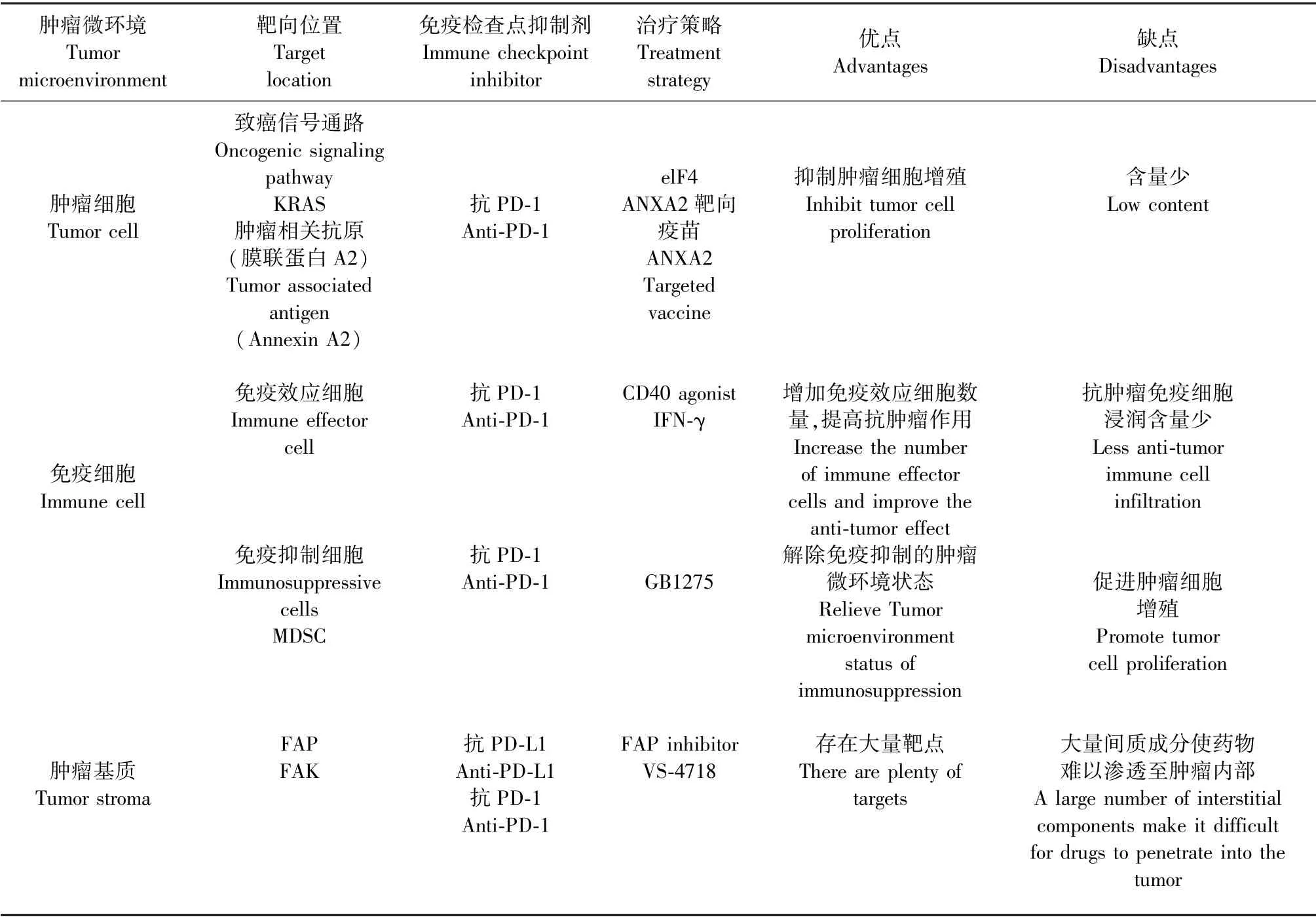
表1 靶向胰腺癌肿瘤微环境的免疫治疗策略Table 1 Immunotherapy strategies for targeting tumor microenvironment in pancreatic cancer
3.1 靶向肿瘤细胞
在胰腺癌的肿瘤微环境中存在大量处于增殖状态的肿瘤细胞,对肿瘤细胞增殖相关的多种途径进行抑制能够减少肿瘤细胞的生成。
3.1.1 致癌信号通路
KRAS 突变在胰腺癌的进展中发挥着重要作用,突变的KRAS 会造成ARF6 和MYC 过表达,促进癌细胞的增殖,因此,通过靶向相应的信号通路,控制致癌信号的传导, 可减慢胰腺癌进展。Hashimoto 等[31]在胰腺癌KPC 小鼠模型中发现,应用elF4A 抑制剂靶向突变的KRAS 能够抑制ARF6和MYC 的过表达,提高抗PD-1 相关免疫检查点抑制剂的疗效。 2019 年Pu 等[32]发现细胞内源性PD-1 可通过Hippo 通路调节CYR61/CTGF 信号,从而促进胰腺癌的进展,对BXPC3 细胞系给予Hippo抑制剂与抗PD-1 抗体干预后,肿瘤细胞的生长受到了明显的抑制。 既往研究发现,NSG3 在胰腺癌患者中表达较低,过表达NSG3 能够抑制胰腺癌细胞的增殖、侵袭和迁移。 2021 年Xia 等[33]发现过表达NSG3 能够阻止Erk1/2 磷酸化,抑制PD-L1 的表达,从而增强胰腺癌免疫反应,作者构建了一个稳定过表达NSG3 的小鼠胰腺癌细胞系PANC02 后皮下移植到C57BL/6 小鼠后用抗PD-1 抗体治疗,小鼠肿瘤生长速度明显减慢。 这些研究结果表明靶向致癌信号通路具有增强免疫检查点抑制剂抗肿瘤疗效的潜力。
3.1.2 肿瘤相关抗原
胰腺导管癌是一种免疫原性和肿瘤突变负荷(tumor mutational burden,TMD)相对较低的肿瘤,由于低TMD 会阻碍新抗原的释放和呈现,从而导致较少的淋巴细胞浸润和较低的免疫检查点抑制剂敏感性。 已证实膜联蛋白A2(annexin A2,ANXA2)是PDAC 相关肿瘤抗原,在一项临床前实验中,Kim等[34]用一种以ANXA2 为靶向的疫苗进行治疗后,不仅延长了PDAC 小鼠模型的生存期,而且更重要的是,当其和抗PD-1 抗体联合治疗后发现ANXA2特异性T 细胞的IFN-γ 的表达显著增高,增强对免疫检查点抑制剂的敏感性。
3.1.3 细胞周期
细胞周期蛋白依赖性激酶(cyclin dependent kinase,CDK)调控细胞周期,在癌细胞中CDK 常被过度激活,因此,抑制细胞周期相关蛋白可有效的抑制癌细胞的增殖。 胰腺癌细胞对CDK4/6 抑制剂非常敏感,2021 年Knudsen 等[35]发现,在PDX 小鼠胰腺癌模型中,将MEK 抑制剂与CDK4/6 抑制剂联合使用后调节了PDAC 的微环境,增加了对免疫检查点抑制剂的敏感性,CDK4/6 和MEK 抑制剂与抗PD-L1 联合使用可使小鼠的CD8+T 细胞明显增加,抑制肿瘤生长。
3.1.4 凋亡与自噬
声动力学疗法(sonodunamic therapy,SDT)作为一种新型的靶向抗癌方法,其利用超声激活致敏剂后与分子氧或者生物底物相互作用,产生活性氧(ROS),通过诱导细胞凋亡引起肿瘤细胞的死亡。2021 年Nesbitt 等[36]在小鼠胰腺癌肿瘤模型中发现SDT 联合抗PD-L1 治疗后,与未治疗组进行对比,联合治疗组肿瘤体积明显减少,肿瘤内浸润的CD8+T 和CD4+T 细胞数量明显增加。
3.2 靶向免疫细胞
胰腺癌的肿瘤微环境中存在着大量的免疫细胞,其中包括免疫效应细胞和免疫抑制细胞。 通过促进效应T 细胞及树突状细胞的激活和呈递,抑制免疫抑制细胞的活性,可增强免疫检查点抑制剂的抗肿瘤效果。
3.2.1 激活免疫效应细胞
胰腺癌的肿瘤微环境中具有抗肿瘤效应的CD4+/CD8+效应T 细胞、NK 细胞以及DCs 细胞含量较少,且功能受到抑制,因此,通过各种途径增加细胞毒性免疫细胞的浸润及活化,可增强胰腺癌抗肿瘤免疫反应。 CD40 在多种免疫细胞上表达,包括DCs、B 细胞以及NK 细胞等,激活后可增强免疫细胞的抗肿瘤的作用,Ma 等[37]在转移性胰腺癌小鼠模型中使用T 细胞诱导疫苗联合CD40 激动剂和抗PD-1 单抗进行三联治疗后发现TME 中的细胞毒性T 淋巴细胞(cytotoxic T lymphocyte,CTL)浸润增加,IFN-γ、颗粒酶B(granzyme B,GZMB)数量增加,MDSCs 数量明显减少,肿瘤生长受到明显抑制。ATM 在电离辐射后的DNA 双键断裂中起着关键作用,当ATM 损伤后可引起STING/TBK1 的激活,从而激活先天性免疫系统。 2019 年Zhang 等[38]在小鼠皮下胰腺癌肿瘤模型中发现,ATM 抑制剂能够增强免疫检查点抑制剂的敏感性,当其与抗PD-L1 抗体联合使用后,CD8+T 细胞数量明显增加,肿瘤生长受到明显抑制。 IFN-γ 是先天性和适应性免疫中的关键细胞因子,IFN-γ 通过激活细胞因子来诱导杀伤细胞。 2019 年Ding 等[39]通过皮下注射BXPC3 细胞到裸鼠体内建立皮下PDAC 小鼠模型后,给予IFN-γ 和纳武利尤单抗联合治疗能够增强抗肿瘤疗效。
新抗原靶向疫苗已被证明可以在具有免疫原性的肿瘤中诱导T 细胞的反应,单用免疫检查点抑制剂对胰腺癌的治疗甚微,但可以通过接种疫苗使肿瘤微环境变得“热”起来,从而产生免疫应答。Kinkead 等[40]设计了一种新抗原靶向疫苗PancVAX,在PDAC 皮下肿瘤模型中,将其与抗PD-1 抗体以及OX40 激动剂进行三联用药后发现,与对照组和单药治疗组相比,三联用药后通过诱导疫苗特异性肿瘤浸润淋巴细胞( tumor-infiltrating lymphocytes,TIL)从而产生显著的抗肿瘤效应,小鼠的生存率提高了30%。 另外在2019 年Bassani-Sternberg 等[41]开展的一项Ⅰb 期临床试验中,在对三例胰腺癌患者接种疫苗后给予纳武利尤单抗治疗,发现能够诱导和激活疫苗特异性TIL 的产生。
3.2.2 减少免疫抑制细胞浸润
在胰腺癌微环境中存在着广泛的免疫抑制细胞浸润,包括Tregs、MDSCs、TAMs 等,这些细胞能够分泌免疫抑制因子TGF-β、IL-10 等,抑制CD8+T 细胞的增殖和IFN-γ 的产生,从而形成免疫抑制的肿瘤微环境。 靶向这些免疫抑制细胞,使其在TME 中的活性受到抑制,能够解除免疫抑制的肿瘤微环境状态。
在胰腺癌TME 中,MDSCs 向TME 的迁移和招募的过程是由CD11b/CD18 整合素异源二聚体介导的,GB1275 是一种CD11b 的调节剂,有研究发现,在小鼠胰腺癌模型中使用GB1275 治疗后,在减少MDSCs 数量的同时能够增加活化的CD103+DCs 和CD8+T 细胞的数量,在小鼠PDAC 模型联合使用抗PD-1 抗体和GB1275 治疗后,与对照组相比,联合治疗组小鼠的生存期显著延长[42]。
在胰腺癌TME 中,肿瘤相关中性粒细胞(tumor-associated neutrophil,TAN)分为抗肿瘤型的N1 型肿瘤相关中性粒细胞和促肿瘤型的N2 型肿瘤相关中性粒细胞,Nielsen 等[43]在PDAC 小鼠模型中发现非受体酪氨酸激酶洛拉替尼能够抑制TME 中N2 型肿瘤相关中性粒细胞的浸润,从而抑制胰腺癌的生长。 此外,作者应用原位胰腺癌KPC小鼠模型发现洛拉替尼与抗PD-1 抗体联合治疗后小鼠肿瘤内中性粒细胞的数量减少,且显著增加了CD8+T 细胞的浸润,肿瘤生长速度显著减慢,表明洛拉替尼能够改善PDAC 对免疫治疗的反应。
肿瘤相关巨噬细胞 ( tumor associated macrophages,TAMs)包括抑制肿瘤生长的M1 型和促进肿瘤侵袭的M2 型两种类型,在胰腺癌微环境中常表现为M2 型TAMs,形成PDAC 免疫抑制的微环境。 2020 年Lu 等[44]发现IL-20 高表达胰腺癌患者预后较差,应用KPC 和原位PDAC 两种胰腺癌模型进行研究,发现靶向IL-20 后能够减少原位PDAC模型中M2 型TAMs 的浸润,将IL-20 的拮抗剂7E与抗PD-1 抗体联合治疗后在减少M2 浸润的同时还增加了CD8+T 细胞的浸润,削弱了肿瘤微环境免疫抑制,抑制了肿瘤生长,显著延长了小鼠生存期。
3.3 靶向肿瘤基质
大量致密的基质成分是胰腺癌微环境的显著特点,约占TME 的80%,从而形成了一个物理屏障,呈现出免疫抑制肿瘤微环境,有利于胰腺肿瘤的进展,是导致耐药性和免疫治疗效果较差的主要原因。 在胰腺癌间质中,有大量肿瘤相关成纤维细胞(cancer-associated fibroblasts,CAFs)被激活,CAFs 产生的细胞外基质可引起纤维化,抑制肿瘤免疫细胞浸润。 靶向破坏胰腺癌基质成分,使癌细胞暴露出来,有利于免疫效应物质进入杀伤癌细胞。 细胞外基质主要由胶原蛋白、纤维连接蛋白、糖胺聚糖、透明质酸和蛋白酶组成[45],因此,免疫治疗联合针对TME 中的肿瘤间质可能会对胰腺的治疗产生效果。
成纤维活化蛋白(fibroblast activation protein,FAP)是一种CAFs 细胞的活化标志物,在胰腺肿瘤TME 中过表达,与患者的不良预后有关。 在小鼠胰腺癌模型中发现,FAP 抑制剂和抗PD-L1 抗体联合使用能减少抑制因子CXCL12 的产生,从而减缓PDAC 的进展,能延长荷瘤小鼠的生存期[46]。
局部粘着斑激酶(focal adhesion kinase,FAK)是一种非受体酪氨酸蛋白激酶,是细胞与其外基质之间的接触点,在胰腺癌等多种恶性肿瘤中过表达。有研究发现FAK 在调节肿瘤间质纤维化和胰腺癌免疫抑制微环境中发挥重要作用,并且与效应T 细胞的低浸润有关。 Symeonides 等[47]在PDAC 小鼠模型中发现,抑制FAK 能够有效的减少胶原蛋白和其他细胞外基质成分,这些变化能够改善胰腺癌TME 的状态,有利于发挥抗肿瘤效应。 进一步将FAK 抑制剂、吉西他滨与抗PD-1 抗体联合使用后显示出了强大的抗肿瘤效应,小鼠的生存期明显延长。 类似的研究也被Jiang 等[48]所报道,他们在KPC 小鼠模型中将FAK 抑制剂VS-4718、吉西他滨与抗PD-1 抗体进行三要联合,实验发现FAK 抑制剂作用后能够抑制胰腺间质的纤维化,促进胰腺癌对免疫治疗的反应,显著抑制肿瘤的生长,延长荷瘤小鼠的生存期。
IL-6 主要来源于胰腺星状细胞,并且通过STAT信号通路在TME 中排泄乳酸,对PDAC 的进展具有重要作用。 2020 年Kesh 等[49]发现,在皮下小鼠胰腺模型中使用IL-6 抑制剂能够有效抑制微环境中乳酸排泄,减少肿瘤内CD133+的数量,增强胰腺肿瘤对抗PD-1 的敏感性。 Mace 等[50]报道了相似的研究,他们发现在自发胰腺癌小鼠模型KPC-Brca2中使用IL-6 抑制剂和抗PD-L1 抗体后能够对胰腺肿瘤的生长产生明显的抑制作用,并且肿瘤内效应T 细胞的数量明显增加。
4 展望
总之,单一免疫检查点抑制剂治疗对胰腺癌患者的治疗效果非常有限,通过联合治疗促使肿瘤微环境由免疫抑制状态向免疫激活状态转变,促进免疫效应细胞的浸润,可有效提高免疫治疗效果。 除此之外,胰腺癌肿瘤微环境潜在的治疗靶点还有很多,比如在肿瘤基质中大量存在的透明质酸、VEGF、血管等这类物质,设计对其进行靶向治疗的药物,并与免疫检查点抑制剂联合起来也可能是治疗胰腺癌的潜在策略。 此外,随着对免疫治疗深入研究,人们发现肠道微生物群与肿瘤免疫反应密切相关,在已确诊的胰腺癌患者中,相比短期生存者,那些具有丰富的肿瘤微生物多样性的患者生存率明显更长一些,而且通过调节肠道微生物群能够影响到胰腺癌肿瘤微环境中免疫细胞的浸润,因此,肠道微生物群也可能作为一种提高抗肿瘤疗效的潜在靶点,其与免疫检查点抑制联合应用也具有巨大的发展潜力[51-52]。 未来针对胰腺癌患者的治疗方式将会是多样化和个性化的,应根据每个患者自身特点,有针对性的选择合适的治疗方案才能达到更好的治疗效果,实现有效延长患者生存期的目的[53]。
参 考 文 献(References)
[ 1] Siegel RL, Miller KD, Fuchs HE, et al. Cancer statistics, 2021[J]. CA Cancer J Clin, 2021, 71(1): 7-33.
[ 2] Masiak-Segit W, Rawicz-Pruszyński K, Skórzewska M, et al.Surgical treatment of pancreatic cancer [J]. Pol Przegl Chir,2018, 90(2): 45-53.
[ 3] Goto Y, Nakamura A, Ashida R, et al. Clinical evaluation of intensity-modulated radiotherapy for locally advanced pancreatic cancer [J]. Radiat Oncol, 2018, 13(1): 118.
[ 4] Conroy T, Hammel P, Hebbar M, et al. Folfirinox or gemcitabine as adjuvant therapy for pancreatic cancer [J]. N Engl J Med, 2018, 379(25): 2395-2406.
[ 5] Vincent A, Herman J, Schulick R, et al. Pancreatic cancer[J]. Lancet, 2011, 378(9791): 607-620.
[ 6] Ibrahim AM, Wang YH. Viro-immune therapy: a new strategy for treatment of pancreatic cancer [J]. World J Gastroenterol,2016, 22(2): 748-763.
[ 7] Suresh K, Naidoo J, Lin CT, et al. Immune checkpoint immunotherapy for non-small cell lung cancer: benefits and pulmonary toxicities [J]. Chest, 2018, 154(6): 1416-1423.
[ 8] Willsmore ZN, Coumbe BGT, Crescioli S, et al. Combined anti-PD-1 and anti-CTLA-4 checkpoint blockade: treatment of melanoma and immune mechanisms of action [ J]. Eur J Immunol, 2021, 51(3): 544-556.
[ 9] Kuzume A, Chi S, Yamauchi N, et al. Immune-checkpoint blockade therapy in lymphoma [J]. Int J Mol Sci, 2020, 21(15): 5456.
[10] Gul A, Stewart TF, Mantia CM, et al. Salvage ipilimumab and nivolumab in patients with metastatic renal cell carcinoma after prior immune checkpoint inhibitors [J]. J Clin Oncol, 2020, 38(27): 3088-3094.
[11] Ribas A, Wolchok JD. Cancer immunotherapy using checkpoint blockade [J]. Sci, 2018, 359(6382): 1350-1355.
[12] Balachandran VP, Łuksza M, Zhao JN, et al. Identification of unique neoantigen qualities in long-term survivors of pancreatic cancer [J]. Nature, 2017, 551(7681): 512-516.
[13] Skelton RA, Javed A, Zheng L, et al. Overcoming the resistance of pancreatic cancer to immune checkpoint inhibitors [J]. J Surg Oncol, 2017, 116(1): 55-62.
[14] Amedei A, Niccolai E, Prisco D. Pancreatic cancer: role of the immune system in cancer progression and vaccine-based immunotherapy [J]. Hum Vaccin Immunother, 2014, 10(11):3354-3368.
[15] Steele CW, Karim SA, Leach JDG, et al. CXCR2 Inhibition profoundly suppresses metastases and augments immunotherapy in pancreatic ductal adenocarcinoma [J]. Cancer Cell, 2016, 29(6): 832-845.
[16] Principe DR, Narbutis M, Kumar S, et al. Long-term gemcitabinetreatmentreshapesthepancreatictumor microenvironmentandsensitizesmurinecarcinomatocombination immunotherapy [J]. Cancer Res, 2020, 80(15): 3101-3115.
[17] Disis ML. Mechanism of action of immunotherapy [J]. Semin Oncol, 2014, 41(5): S3-S13.
[18] Garris CS, Arlauckas SP, Kohler RH, et al. Successful anti-pd-1 cancer immunotherapy requires T cell-dendritic cell crosstalk involving the cytokines IFN-γ and IL-12 [J]. Immunity, 2018,49(6): 1148-1161.
[19] Henriksen A, Dyhl-Polk A, Chen I, et al. Checkpoint inhibitors in pancreatic cancer [J]. Cancer Treat Rev, 2019, 78: 17-30.
[20] Ott PA, Bang YJ, Piha-Paul SA, et al. T-cell-inflamed geneexpression profile, programmed death ligand 1 expression, and tumor mutational burden predict efficacy in patients treated with pembrolizumab across 20 cancers: keynote-028 [J]. J Clin Oncol, 2019, 37(4): 318-327.
[21] Hingorani SR, Zheng L, Bullock AJ, et al. Halo 202:randomized phase ii study of pegph20 plus nab-paclitaxel/gemcitabine versus nab-paclitaxel/gemcitabine in patients with untreated, metastatic pancreatic ductal adenocarcinoma [J]. J Clin Oncol, 2018, 36(4): 359-366.
[22] Brahmer JR, Tykodi SS, Chow LQ, et al. Safety and activity of anti-PD-L1 antibody in patients with advanced cancer [J]. N Engl J Med, 2012, 366(26): 2455-2465.
[23] Fan JQ, Wang MF, Chen HL, et al. Current advances and outlooks in immunotherapy for pancreatic ductal adenocarcinoma[J]. Mol Cancer, 2020, 19(1): 32.
[24] Balachandran VP, Beatty GL, Dougan SK. Broadening the impact of immunotherapy to pancreatic cancer: challenges and opportunities [J]. Gastroenterology, 2019, 156 (7): 2056-2072.
[25] Ren B, Cui M, Yang G, et al. Tumor microenvironment participates in metastasis of pancreatic cancer [J]. Mol Cancer,2018, 17(1): 108.
[26] Kabacaoglu D, Ciecielski KJ, Ruess DA, et al. Immune checkpoint inhibition for pancreatic ductal adenocarcinoma:current limitations and future options [J]. Front Immunol,2018, 9: 1878.
[27] Kang J, Hwang I, Yoo C, et al. Nab-paclitaxel plus gemcitabine versus FOLFIRINOX as the first-line chemotherapy for patients with metastatic pancreatic cancer: retrospective analysis [J].Invest New Drugs, 2018, 36(4): 732-741.
[28] McBride A, Bonafede M, Cai Q, et al. Comparison of treatment patterns and economic outcomes among metastatic pancreatic cancer patients initiated on nab-paclitaxel plus gemcitabine versus FOLFIRINOX [J]. Expert Rev Clin Pharmacol, 2017, 10(10): 1153-1160.
[29] Panchal K, Sahoo RK, Gupta U, et al. Role of targeted immunotherapy for pancreatic ductal adenocarcinoma (PDAC)treatment: an overview [J]. Int Immunopharmacol, 2021,95: 107508.
[30] Faurobert E, Bouin AP, Albiges-Rizo C. Microenvironment,tumor cell plasticity, and cancer [J]. Curr Opin Oncol, 2015,27(1): 64-70.
[31] Hashimoto A, Handa H, Hata S, et al. Inhibition of mutant KRAS-driven overexpression of ARF6 and MYC by an eIF4A inhibitor drug improves the effects of anti-PD-1 immunotherapy for pancreatic cancer [J]. Cell Commun Signal, 2021, 19(1): 54.
[32] Pu N, Gao S, Yin H, et al. Cell-intrinsic PD-1 promotes proliferation in pancreatic cancer by targeting CYR61/CTGF via the hippo pathway [J]. Cancer Lett, 2019, 460: 42-53.
[33] Xia X, Li R, Zhou P, et al. Decreased NSG3 enhances PD-L1 expression by Erk1/2 pathway to promote pancreatic cancer progress [J]. Am J Cancer Res, 2021, 11(3): 916-929.
[34] Kim VM, Blair AB, Lauer P, et al. Anti-pancreatic tumor efficacy of a listeria-based, annexin A2-targeting immunotherapy in combination with anti-PD-1 antibodies [J]. J Immunother Cancer. 2019, 7(1): 132.
[35] Knudsen ES, Kumarasamy V, Chung S, et al. Targeting dual signalling pathways in concert with immune checkpoints for the treatment of pancreatic cancer [J]. Gut, 2021, 70(1): 127-138.
[36] Nesbitt H, Logan K, Thomas K, et al. Sonodynamic therapy complements PD-L1 immune checkpoint inhibition in a murine model of pancreatic cancer [J]. Cancer Lett, 2021, 517: 88-95.
[37] Ma HS, Poudel B, Torres ER, et al. A CD40 Agonist and PD-1 antagonistantibodyreprogramthemicroenvironment of nonimmunogenic tumors to allow T-cell-mediated anticancer activity [J]. Cancer Immunol Res, 2019, 7(3): 428-442.
[38] Zhang Q, Green MD, Lang X, et al. Inhibition of ATM increases interferon signaling and sensitizes pancreatic cancer to immune checkpoint blockade therapy [J]. Cancer Res, 2019, 79(15):3940-3951.
[39] Ding G, Shen T, Yan C, et al. IFN-γ down-regulates the PD-1 expression and assist nivolumab in PD-1-blockade effect on CD8+T-lymphocytes in pancreatic cancer [J]. BMC Cancer, 2019, 19(1): 1053.
[40] Kinkead HL, Hopkins A, Lutz E, et al. Combining STINGbased neoantigen-targeted vaccine with checkpoint modulators enhances antitumor immunity in murine pancreatic cancer [J].JCI Insight, 2018, 3(20): e122857.
[41] Bassani-Sternberg M, Digklia A, Huber F, et al. A Phase ib study of the combination of personalized autologous dendritic cell vaccine, aspirin, and standard of care adjuvant chemotherapy followed by nivolumab for resected pancreatic adenocarcinoma-a proof of antigen discovery feasibility in three patients [J]. Front Immunol, 2019, 10: 1832.
[42] DeNardo DG, Galkin A, Dupont J, et al. GB1275, a first-inclassCD11bmodulator:rationaleforimmunotherapeutic combinations in solid tumors [J]. J Immunother Cancer, 2021,9(8): e003005.
[43] Nielsen SR, Strøbech JE, Horton ER, et al. Suppression of tumor-associated neutrophils by lorlatinib attenuates pancreatic cancer growth and improves treatment with immune checkpoint blockade [J]. Nat Commun, 2021, 12(1): 3414.
[44] Lu SW, Pan HC, Hsu YH, et al. IL-20 antagonist suppresses PD-L1 expression and prolongs survival in pancreatic cancer models [J]. Nat Commun, 2020, 11(1): 4611.
[45] Edwards P, Kang BW, Chau I. Targeting the stroma in the management of pancreatic cancer [J]. Front Oncol, 2021,11: 691185.
[46] Feig C, Jones JO, Kraman M, et al. Targeting CXCL12 from FAP-expressing carcinoma-associated fibroblasts synergizes with anti-PD-L1 immunotherapy in pancreatic cancer [J]. Proc Natl Acad Sci U S A, 2013, 110(50): 20212-20217.
[47] Symeonides SN, Anderton SM, Serrels A. FAK-inhibition opens the door to checkpoint immunotherapy in pancreatic cancer [J].J Immunother Cancer, 2017, 5: 17.
[48] Jiang H, Hegde S, Knolhoff BL, et al. Targeting focal adhesion kinase renders pancreatic cancers responsive to checkpoint immunotherapy [J]. Nat Med, 2016, 22(8): 851-860.
[49] Kesh K, Garrido VT, Dosch A, et al. Stroma secreted IL6 selects for “stem-like” population and alters pancreatic tumor microenvironment by reprogramming metabolic pathways [J].Cell Death Dis, 2020, 11(11): 967.
[50] Mace TA, Shakya R, Pitarresi JR, et al. IL-6 and PD-L1 antibodyblockadecombinationtherapyreducestumour progressioninmurinemodelsofpancreaticcancer[J].Gut,2018, 67(2): 320-332.
[51] Griffin ME, Espinosa J, Becker JL, et al.Enterococcuspeptidoglycan remodeling promotes checkpoint inhibitor cancer immunotherapy [J]. Science, 2021, 373(6558): 1040-1046.
[52] Luo B, Zhang Y, Zhang C, et al. Intestinal microbiota: A potential target for enhancing the antitumor efficacy and reducing the toxicity of immune checkpoint inhibitors [J]. Cancer Lett,2021, 509: 53-62.
[53] Zhang J, Wolfgang CL, Zheng L. Precision immuno-oncology:prospects of individualized immunotherapy for pancreatic cancer[J]. Cancers(Basel), 2018, 10(2): 39.
