布鲁氏菌外膜蛋白OMP25 诱导BALB/c 小鼠免疫反应的分析
2022-11-21王书利李志强魏淑娟司丽芳
王书利,李志强,魏淑娟,司丽芳
(1.河南科技大学动物科技学院,河南 洛阳 471003;2.商丘师范学院生物与食品学院,河南 商丘 476000)
布鲁氏菌病是由布鲁氏菌引起的细菌性人畜共患病,给许多发展中国家造成了巨大的公共卫生负担[1]。 人类通过接触受感染的动物或其产品而感染布鲁氏菌病[2]。 动物发病后主要表现为流产,而人类发病后会导致反复发热、脊柱炎、关节炎和骨髓炎等[3]。 Rev.1 是通过世界卫生组织和世界动物卫生组织认证的用于羊的疫苗株[4]。 Rev.1 为光滑型菌株,具有链霉素抗性[5]。 Rev.1 可诱导机体较强的免疫应答,保护羊免受布鲁氏菌的感染[6]。但这些疫苗也有一些缺点,如妊娠动物流产、干扰血清学诊断、通过气溶胶传播,及引起局部超敏反应等[7]。 因此,需要研制一种安全有效的疫苗。
重组亚单位疫苗是当前布鲁氏菌疫苗研发热点,该疫苗不存在毒性,不会引起感染。 外膜蛋白是布鲁氏菌保护性抗原。 OMP25 是布鲁氏菌的一种外膜蛋白,在多种布鲁氏菌属和菌株中具有高度保守性,与布鲁氏菌的肽聚糖层结合[8]。 OMP25 是布鲁氏菌毒力因子之一,可抑制TNF-α 产生,是布鲁氏菌潜在抗原[9-10]。 基于OMP25 在布鲁氏菌毒力中的意义,我们研究了羊种布鲁氏菌OMP25 作为布鲁氏菌病亚单位疫苗候选株的可行性。 由于重组蛋白亚单位疫苗的组成是已知的,且不能在宿主体内复制,免疫动物后不会致病,因此,亚单位疫苗被认为是新一代疫苗更好、更安全的选择。
本研究为了筛选布鲁氏菌亚单位疫苗株的候选抗原,对外膜蛋白OMP25 进行原核表达,并对其诱导机体产生的免疫反应进行检测,为亚单位疫苗候选抗原的筛选提供科学依据。
1 材料与方法
1.1 材料
1.1.1 实验动物
15 只SPF 级雌性BALB/c 小鼠,6 周龄,体重约为25 ~ 30 g,购于河南省实验动物中心【SCXK(豫)2017-0001】,饲养于商丘美兰生物工程有限公司动物实验室【SYXK(豫)2017-0006】。 饲养期间各组小鼠自由饮水,饲喂普通维持饲料由河南省实验动物中心【SCXK(豫)2017-0001】提供。 饲养环境:温度控制在22 ~ 25℃,湿度50% ~ 60%,自动光控(昼夜各半循环照明)。 所有操作均符合商丘师范学院实验动物伦理学要求(2021-5)。
1.1.2 主要试剂与仪器
T-Vector pMD 19(Simple) 载体(TaKaRa,日本);限制性内切酶BamH I(TaKaRa,日本);限制性内切酶SalI(TaKaRa,日本);DNA Ligation Kit Ver.2.1(TaKaRa,日本);DNA Marker (TaKaRa,日本);pET-32a 载体(Promega,美国);蛋白Marker(博士德,中国);2 × Taq PCR Mastermix(天根生化科技(北京)有限公司,中国);琼脂糖凝胶DNA 回收试剂盒(中科瑞泰(北京)生物科技有限公司,中国);高纯度质粒小提试剂盒(天根生化科技(北京)有限公司,中国);大肠杆菌(E.coli) DH5α 和BL21(DE3)感受态细胞(北京全式金生物技术有限公司,中国);IPTG 诱导剂(西格玛奥德里奇(上海)贸易有限公司,中国);蛋白纯化试剂盒(北京康为世纪生物科技有限公司,中国);氨苄霉素(西格玛奥德里奇(上海)贸易有限公司,中国);刀豆蛋白(ConA,上海源叶生物有限公司);NC 膜(北京索莱宝科技有限公司,中国);辣根过氧化物酶(HRP)标记的羊抗鼠IgG(EarthOx,美国);布鲁氏菌(外膜蛋白OMP25)特异性IgG ELISA 检测试剂盒(RD,美国);细胞因子ELISA 检测试剂盒(RD,美国);RPMI 1640 细胞培养液(Gibco 生命科技公司,美国);胎牛血清(Gibco 生命科技公司,美国);一次性细胞培养板(Gibco 生命科技公司,美国)。
微量移液枪(Eppendorf,德国);PCR 仪(nexus GSX1,Eppendorf,德国);凝胶成像系统(Gel Doc XR+, Bio-Rad, 美国); 高速离心机( MiniSpin,Eppendorf,德国);冷冻离心机(Centrifuge 5810R,Eppendorf,德国);电子分析天平(FA2204,上海舍岩仪器有限公司,中国);电热恒温培养箱(DNP-9052,上海舍岩仪器有限公司,中国);恒温摇床(OLB-200B,欧莱博,中国);电泳仪、电泳槽和半干式转膜系统(北京六一生物科技有限公司,中国);分子杂交箱(Big SHOT III,Boekel Scientific,美国);生物安全柜(BIO II A,Telstar,西班牙)。
1.2 方法
1.2.1 重组质粒的构建与鉴定
利用Primer5.0 软件,根据GenBank 登录的布鲁氏菌16M 的omp25 基因序列(BMEI1249)设计引物(表1)。 以布鲁氏菌16M 基因组为模板,PCR 扩增omp25 基因。 利用琼脂糖凝胶电泳对扩增产物进行检测,将扩增产物进行回收纯化后,克隆至pMD 19-T simple 载体,获得重组质粒。 采用限制性内切酶BamH I/SalI 对质粒进行酶切后与pET-32a载体相连,获得pET OMP25-32a 质粒。 质粒经BamH I/SalI 双酶切鉴定后,由公司测序鉴定。 转化鉴定正确的质粒至E.coliBL21 感受态细胞,获得克隆菌。
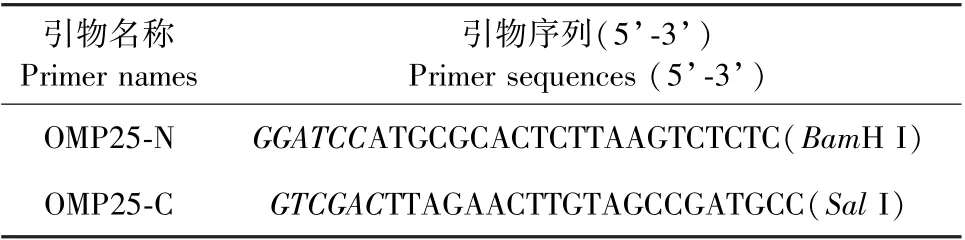
表1 omp25 基因的引物序列Table 1 Primers for the omp25
1.2.2 重组蛋白的表达与纯化
将克隆菌培养至OD600约为0.4 h,取2 mL 菌液后,在剩余菌液中加入终浓度1 mol/L 的IPTG 进行诱导,诱导2、4 和6 h 时各取2 mL 菌液,通过12%的聚丙烯酰胺凝胶电泳(SDS-PAGE) 检测OMP25 表达情况。 蛋白通过蛋白纯化试剂盒进行纯化后,利用SDS-PAGE 电泳对纯化效果检测。
1.2.3 免疫小鼠
参照相关文献[11]对BALB/c 小鼠进行免疫。将6 周龄雌性BALB/c 小鼠随机分为3 组,每组5只。 第1 组皮下注射弗氏佐剂乳化rOMP25(含50 μg 的rOMP25),免疫3 次,每次间隔2 周。 第2 组第只腹腔注射1 × 106CFU 的Rev.1,第3 组腹腔注射200 μL 的PBS。
1.2.4 rOMP25 蛋白免疫小鼠后诱导细胞因子水平分析
三免后第6 周处死小鼠,参照相关文献[12]无菌分离脾细胞,测定细胞因子的水平。 用rOMP25、ConA(阳性对照)或RPMI 1640 细胞培养液(阴性对照)刺激小鼠脾细胞,检测细胞因子IFN-γ 和IL-2的水平。
1.2.5 血清学分析
小鼠免疫后,采用鼠尾采血法于第2、4、6、8 周采集小鼠外周血,分离血清[13]。 参照相关文献[14],利用小鼠血清IgG 和IL-10 ELISA 检测试剂盒测定小鼠血清中IgG 和IL-10 水平。
1.2.6 Western Blot 分析
参考相关文献[15],取1 μg 纯化的rOMP25 蛋白,进行SDS-PAGE 电泳,将目的凝胶块切下,200 mA 电流转膜1 h,用5 mL 5%脱脂奶粉封闭1 h 后,以rOMP25、Rev. 1 和PBS 免疫小鼠的血清(1 ∶300)为一抗,以HRP 标记的羊抗鼠IgG(1 ∶2000)为二抗,经Western Blot 检测rOMP25 的反应原性。
1.3 统计学分析
2 结果
2.1 重组质粒(pET OMP25-32a)的构建与鉴定
利用PCR 扩增omp25 基因后,获得642 bp 的基因片段,与预期大小(642 bp)相符(图1),表明omp25 基因正确扩增。
将构建的重组质粒pET OMP25-32a 进行BamH I/SalI 双酶切后,发现两条条带,5900 bp 的条带系pET-32a,642 bp 的条带系omp25(图2),与载体片段及目的片段的预期大小(642 bp)一致,且公司测序结果与GenBank 中布鲁氏菌16M 菌株的omp25基因序列同源性达100%,未发生碱基错配,表明重组质粒pET OMP25-32a 构建正确。
2.2 rOMP25 的表达与纯化
将重组质粒pET OMP25-32a 转化至大肠杆菌BL21(DE3)进行表达,在菌液中加入IPTG 后进行SDS-PAGE 检测,rOMP25 在(40.8 × 103)处出现与预期蛋白分子质量(40.8 × 103)大小一致的蛋白条带(图3A),表明rOMP25 表达正确,且在IPTG 诱导6 h 时表达量最高。
菌体超声破碎后,经蛋白纯化试剂盒纯化后,SDS-PAGE 检测结果显示,在40.8 × 103处出现单一蛋白条带(图3B)。
2.3 rOMP25 可诱导细胞免疫反应
为了检测rOMP25 诱导的细胞免疫反应,rOMP25、Rev.1 和PBS 免疫小鼠6 周后,处死小鼠,无菌摘除脾,分离脾细胞,检测脾细胞中IFN-γ 和IL-2 水平。 免疫小鼠的脾细胞用rOMP25、ConA 或RPMI 1640 进行刺激。 当用ConA 刺激时,免疫rOMP25 小 鼠 脾 细 胞 IFN-γ 表 达 量 为 873.68 pg/mL,IL-2 的表达量为655.21 pg/mL,表达水平与免疫PBS 小鼠脾细胞产生IFN-γ 和IL-2 的水平相似(P> 0.05),免疫rOMP25 小鼠较免疫PBS 小鼠无显著性差异(图4)。 免疫Rev.1 小鼠脾细胞IFNγ 的表达量为879.98 pg/mL,IL-2 的表达量为761.16 pg/mL,表达水平与免疫PBS 小鼠脾细胞产生IFN-γ 和IL-2 的水平相似(P> 0.05),免疫Rev.1 小鼠较免疫PBS 小鼠无显著性差异(图4)。 当用RPMI 1640 刺激脾细胞时,各组产生的细胞因子较少(图4)。 当用rOMP25 刺激时,免疫rOMP25 小鼠脾细胞IFN-γ 的表达量为1655.98 pg/mL,IL-2 的表达量为1108.79 pg/mL,表达水平显著高于免疫PBS 小鼠脾细胞产生IFN-γ 和IL-2 的水平(P<0.01)(图4)。 免疫Rev.1 小鼠脾细胞IFN-γ 的表达量为1732.23 pg/mL,IL-2 的表达量为1215.15 pg/mL,表达水平显著高于免疫PBS 小鼠脾细胞产生IFN-γ 和IL-2 的水平(P< 0.01)(图4)。 表明小鼠免疫rOMP25 后,可诱导细胞免疫反应。
2.4 rOMP25 可诱导体液免疫反应
采集rOMP25、Rev. 1 和PBS 免疫小鼠后的血清,检测血清中IgG 水平。 发现rOMP25 和Rev. 1免疫组产生IgG 的水平较高,两组无显著性差异(P> 0.05),IgG 的水平在免疫后第6 周到达高峰(图5)。 但是注射PBS 的小鼠产生的IgG 较低(图5)。 表明rOMP25 可诱导体液免疫反应。
2.5 rOMP25 可抑制炎症反应
采集rOMP25、Rev.1 和PBS 免疫小鼠后不同时间点的血清,检测血清中抗炎因子IL-10 的水平。发现rOMP25 和Rev.1 免疫组产生IL-10 的水平较高,免疫rOMP25 小鼠较免疫Rev.1 小鼠无显著性差异(P> 0.05)(图6)。 但是注射PBS 的小鼠产生的IL-10 较低(图6)。 表明rOMP25 后可抑制机体的炎症反应。
2.6 rOMP25 的反应原性分析
为了检测 rOMP25 蛋白的反应原性, 以rOMP25、Rev.1 和PBS 免疫小鼠的血清作为一抗,以HRP 标记的羊抗鼠IgG 作为二抗,进行Western Blot 分析。 结果显示,rOMP25 和Rev.1 免疫的小鼠出现血清反应,但PBS 免疫的小鼠血清无反应(图7),表明rOMP25 具有良好的反应原性。
3 讨论
近年来,越来越多的研究者致力于布鲁氏菌亚单位疫苗的研发,外膜蛋白的疫苗潜力已受到人们的重视。 布鲁氏菌的外膜蛋白按其分子量可分为3组,其中第3 组(25 × 103~ 31 × 103)具有高度同源性,参与布鲁氏菌的毒力[16]。 OMP25 是布鲁氏菌的主要外膜蛋白之一,研究发现,OMP25 与毒力有关,牛种布鲁氏菌omp25 突变株在机体内是减毒的[17-19]。 用抗OMP25 的抗体对动物进行被动免疫,可提供较强的免疫保护力,进一步证实了OMP25 在布鲁氏菌毒力中的作用,以及OMP25 作为疫苗候选抗原的重要性[20]。 已有研究报道,将OMP25 DNA 疫苗免疫BALB/c 小鼠后,可保护小鼠免受羊种布鲁氏菌的侵袭[21]。 也有研究表明,牛种布鲁氏菌的重组OMP25 蛋白也可为BALB/c 小鼠提供保护力,抵抗牛种布鲁氏菌的感染[22]。 因此,OMP25 为较好的亚单位疫苗候选抗原。
由于布鲁氏菌为兼性胞内寄生菌,因此,细胞免疫是清除布鲁氏菌的关键[23]。 早期研究也证明,能够诱导较强的细胞免疫反应的疫苗株可有效地预防布鲁氏菌病[24]。 IFN-γ 是一种重要的效应细胞因子,它能刺激巨噬细胞有效地杀死和清除细胞内的布鲁氏菌[25]。 IL-2 为T 细胞生长因子,可促进Th1 型和Th2 型细胞分化,并激发B 细胞生长及抗体产生[26]。 在本研究中,我们探讨了rOMP25 免疫小鼠后,诱导机体产生的免疫应答情况。 从免疫rOMP25 小鼠中无菌分离脾细胞,并在体外用rOMP25 刺激,可产生较高水平的IFN-γ 和IL-2,表明rOMP25 可诱导机体产生强烈的细胞免疫应答。此外,在布鲁氏菌感染期间,体液免疫反应发挥重要重要作用[27]。 本研究发现,小鼠免疫rOMP25后,产生了较高水平的IgG,且在三免后第6 周达到高峰,表明rOMP25 可诱导机体产生体液免疫反应。IL-10 是一种介导免疫抑制的细胞因子,可促进B细胞增殖分化及抗体产生。 本研究发现,小鼠免疫rOMP25 后,可产生较高水平的IL-10,表明rOMP25可抑制机体的炎症反应。
目前,布鲁氏菌的许多外膜蛋白已被用于开发亚 单 位 疫 苗, 如 OMP10[28-29]、 OMP19[28-29]、OMP28[29]、OMP25c[30]以及OMP31[31]等。 这些亚单位除了产生免疫反应外,还具有一定的保护力。本研究发现rOMP25 可作为亚单位疫苗候选抗原,但还需进一步评价其产生的保护能力。
本研究成功表达并纯化了布鲁氏菌外膜蛋白OMP25,小鼠rOMP25 免疫后产生的免疫水平较高,且rOMP25 可抑制炎症反应。 此外,rOMP25 具有良好的反应原性。 因此,在布鲁菌亚单位疫苗抗原筛选中OMP25 是其理想的候选抗原。 然而,还需进一步检测rOMP25 的保护效果。
参 考 文 献(References)
[ 1] Singh D, Goel D, Bhatnagar R. Recombinant L7/L12 protein entrapping plga ( poly lactide-co-glycolide) micro particles protect BALB/c mice against the virulent b. abortus 544 infection[J]. Vaccine, 2015, 33(24): 2786-2792.
[ 2] Babaoglu UT, Ogutucu H, Demir G, et al. Prevalence ofBrucellain raw milk: an example from turkey [J]. Niger J Clin Pract, 2018, 21(7): 907-911.
[ 3] Glynn MK, Lynn TV. Brucellosis [J]. J Am Vet Med Assoc,2008, 233(6): 900-908.
[ 4] Mu˜nozPM,DeMiguelMJ,GrillóoMJ,etal.ImmunopathologicalresponsesandkineticsofBrucellamelitensisRev 1 infection after subcutaneous or conjunctival vaccination in rams [J]. Vaccine, 2008, 26(21): 2562-2569.
[ 5] Elberg SS, Faunce K Jr. Immunization againstBrucellainfection. VI. immunity conferred on goats by a nondependent mutant from a streptomycin-dependent mutant strain ofBrucellamelitensis[J]. J Bacteriol, 1957, 73(2): 211-217.
[ 6] Ebrahimi M, Nejad RB, Alamian S, et al. Safety and efficacy of reduced doses ofBrucellamelitensisstrain Rev. 1 vaccine in pregnant iranian fat-tailed ewes[J]. Vet Ital, 2012, 48(4):405-412.
[ 7] Schurig GG, Sriranganathann N, Corbel MJ. Brucellosis vaccines: past, present and future [J]. Vet Microbiol, 2002,90(1-4): 479-496.
[ 8] Cloeckaert A, Kerkhofs P, Limet JN. Antibody response toBrucellaouter membrane proteins in bovine brucellosis:immunoblotanalysisandcompetitiveenzyme-linked immunosorbent assay using monoclonal antibodies[J]. J Clin Microbiol, 1992, 30(12): 3168-3174.
[ 9] 乔凤. 外膜蛋白Omp25 在布鲁氏菌毒力及免疫保护中的作用研究 [D]. 长春: 吉林大学; 2009.Qiao F. Investigation on the role of outer membrane protein Omp25 in the virulence and immunological protection of B.melitensis [D]. Changchun: Jilin University; 2009.
[10] 吕亚辉. 布鲁氏菌Omp25 蛋白抑制巨噬细胞分泌TNF-α 的分子机制研究 [D]. 杨凌: 西北农林科技大学; 2013.Lv YH. Study on the molecular mechanism of inhibitory effects of brucella Omp25 protein on TNF-α secretion in macrophage [D].Yangling: Northwest A&F University; 2013.
[11] Li Z, ZhangH,ZhangJ,etal.Brucellaabortus phosphoglyceromutase and dihydrodipicolinate reductase induce Th1 and Th2-related immune responses [J]. World J Microbiol Biotechnol, 2018, 34(2): 22.
[12] Li Z, Wang S, Zhang H, et al. Immunization with recombinant GntR plasmid confers protection againstBrucellachallenge in BALB/c mice [J]. Microb Pathog, 2017, 111: 357-361.
[13] 杨健莉, 刘佳, 郑志红. 常用实验大小鼠采血方法及其对实验动物福利的影响 [J]. 中国比较医学杂志, 2019, 29(1):90-94.Yang JL, Liu J, Zheng ZH. Comparison and analysis of blood sampling methods from rats and mice [J]. Chin J Comp Med,2019, 29(1):90-94.
[14] Li Z, Wang S, Zhang H, et al. Development and evaluation of in murine model, of an improved live-vaccine candidate against brucellosis from toBrucellamelitensisvjbR deletion mutant [J].Microb Pathog, 2018, 124: 250-257.
[15] Li Z,WangS,ZhangJ,etal.brucellaabortus 2308ΔNodVΔNodW double-mutant is highly attenuated and confers protection against wild-type challenge in BALB/c mice[J]. Microb Pathog, 2017, 106: 30-39.
[16] Salhi I, Boigegrain RA, Machold J, et al. Characterization of new members of the group 3 outer membrane protein family ofBrucellaspp[J]. Infect Immun, 2003, 71(8): 4326-4332.
[17] Edmonds MD, Cloeckaert A, Booth NJ, et al. Attenuation of aBrucellaabortusmutant lacking a major 25×103outer membrane protein in cattle [J]. Am J Vet Res, 2001, 62(9): 1461-1466.
[18] Edmonds MD, Cloeckaert A, Hagius SD, et al. Pathogenicity and protective activity in pregnant goats of aBrucellamelitensisdeltaomp25 deletion mutant [J]. Res Vet Sci, 2002, 72(3):235-239.
[19] Edmonds MD, Cloeckaert A, Elzer PH. Brucella species lacking the major outer membrane protein Omp25 are attenuated in mice and protect against brucella melitensis andBrucellaovis[J]. Vet Microbiol, 2002, 88(3): 205-221.
[20] Bowden RA, Cloeckaert A, Zygmunt MS, et al. Outermembraneprotein-androughlipopolysaccharide-specific monoclonal antibodies protect mice againstBrucellaovis[J]. J Med Microbiol, 1995, 43(5): 344-347.
[21] Commander NJ, Spencer SA, Wren BW, et al. The identification of two protective DNA vaccines from a panel of five plasmid constructs encodingBrucellamelitensis16M genes [J].Vaccine, 2007, 25(1): 43-54.
[22] Goel D, Bhatnagar R. Intradermal immunization with outer membrane protein 25 protects BALB/c mice from virulent B.abortus 544 [J]. Mol Immunol, 2012, 51(2): 159-168.
[23] Baldwin CL, Goenka R. Host immune responses to the intracellular bacteriaBrucella: does the bacteria instruct the host to facilitate chronic infection? [J]. Crit Rev Immunol, 2006,26(5): 407-442.
[24] Yang X, Skyberg JA, Cao L, et al. Progress inBrucellavaccinedevelopment [J]. Front Biol, 2013, 8(1): 60-77.
[25] Murphy EA, Sathiyaseelan J, Parent MA, et al. Interferongamma is crucial for surviving aBrucellaabortusinfection in both resistant C57BL/6 and susceptible BALB/c mice [ J ].Immunology, 2001, 103(4): 511-518.
[26] Spolski R, Li P, Leonard WJ. Biology and regulation of IL-2:from molecular mechanisms to human therapy[J]. Nat Rev Immunol, 2018, 18(10): 648-659.
[27] Casta˜no-Zubieta MR, Rossetti CA, García-González DG, et al.Evaluation of the safety profile of the vaccine candidateBrucella melitensis16MDeltavjbR strain in goats [J]. Vaccine, 2021, 39(3): 617-625.
[28] Shim S, Soh SH, Im YB, et al. Elicitation of Th1/Th2 related responses in mice by chitosan nanoparticles loaded withBrucella abortusmalate dehydrogenase, outer membrane proteins 10 and 19 [J]. Int J Med Microbiol, 2020, 310(1): 151362.
[29] Im YB, Park WB, Jung M, et al. Comparative analysis of immune responses to outer membrane antigens OMP10, OMP19,and OMP28 of brucella abortus [J]. Jpn J Infect Dis, 2018, 71(3): 197-204.
[30] Paul S, Peddayelachagiri BV, Nagaraj S, et al. Recombinant outer membrane protein 25c fromBrucellaabortusinduces Th1 and Th2 mediated protection againstBrucellaabortusinfection in mouse model [J]. Mol Immunol, 2018, 99: 9-18.
[31] Shojaei M, Tahmoorespur M, Soltani M, et al. Immunogenicity evaluation of plasmids encodingBrucellamelitensisOmp25 and Omp31 antigens in BALB/c mice[J]. Iran J Basic Med Sci,2018, 21(9): 957-964.
