BRD4抑制剂JQ1及miR-141对膀胱癌细胞增殖和凋亡的影响及其机制
2022-11-21郭晓波赵宇峰赵波李岗
郭晓波 赵宇峰 赵波 李岗
(长治医学院附属和济医院泌尿外科,山西 长治 046011)
膀胱癌是泌尿系统最常见的恶性肿瘤类型,每年有57.3万新增病例,并导致超过21万人死亡〔1,2〕。手术和化疗是膀胱癌的主要治疗策略,但因其高复发率和远处转移率,导致治疗效果并不理想。因此,亟待寻找新型有效膀胱癌治疗方法。微小RNA(miRNA)是非编码、短链、单链RNA分子,其通过结合靶mRNA 3′非翻译区来调节目标蛋白表达,进而调节与肿瘤细胞增殖、侵袭、炎症反应和细胞凋亡相关的细胞信号通路,特定miRNA表达失调与肿瘤进展相关〔3〕。研究指出miR-141表达水平与膀胱癌肿瘤分级、分期及转移、预后情况存在相关性〔4,5〕。miR-141靶向runt相关转录因子(RUNX)3调控肿瘤细胞增殖和凋亡〔6〕。溴结构域蛋白(BRD)4是溴域外(BET)蛋白家族成员,其在恶性肿瘤中过度表达〔7〕。JQ1是一种BRD4选择性抑制剂,其通过诱导细胞凋亡和周期阻滞来抑制膀胱癌等多种实体瘤进展〔8,9〕。本研究探讨BRD4抑制剂JQ1联合下调miR-141对膀胱癌细胞增殖和凋亡的影响及潜在分子机制,以期为临床治疗膀胱癌提供新型策略。
1 资料与方法
1.1一般资料
1.1.1组织来源 90例膀胱癌组织及与之配对的癌旁组织取自2018年1月至2019年12月长治医学院附属和济医院确诊为膀胱癌并行手术的患者,男72例,女18例,年龄61~80岁,中位年龄70岁。纳入标准:术前未接受抗肿瘤治疗;未合并其他恶性肿瘤。所有患者在使用临床材料前签署知情同意书,本研究经医院伦理委员会批准。
1.1.2细胞和试剂 人膀胱癌细胞RT-4、改良Eagle培养基(DMEM)培养基、青链霉素、胎牛血清购自武汉普诺赛生命科技公司;miScript逆转录试剂盒购自德国QIAGEN公司;荧光定量聚合酶链反应(PCR)试剂盒购自美国Roche公司;Annexin V-FITC/碘化丙啶凋亡检测试剂盒购自南京凯基生物生物技术公司;CCK-8试剂盒购自上海吉满生物科技公司;兔源激活型天冬氨酸特异性半胱氨酸蛋白(caspase)-3单克隆抗体(AC033)、兔源B细胞淋巴瘤(Bcl)-2多克隆抗体(AB112)、兔源Bcl-2相关X蛋白(Bax)单克隆抗体(AF1270)、兔源蛋白激酶B(AKT)单克隆抗体(AF1777)、兔源β-actin单克隆抗体(AF5003)购自上海碧云天生物公司;兔源磷脂酰肌醇-3激酶(PI3K)多克隆抗体(ab226826)、羊抗兔二抗(ab205718)、兔源p-PI3K多克隆抗体(ab182651)、兔源p-AKT多克隆抗体(ab38449)购自上海艾博抗生物公司。
1.2RT-qPCR检测膀胱癌中miR-141表达 Trizol法提取组织样本的总RNA,用miScript逆转录试剂盒合成cDNA,根据荧光定量PCR试剂盒配制反应体系进行RT-qPCR。U6作为miRNA的内参,采用2-ΔΔCt法进行数据分析。
1.3细胞培养和分组 RT-4细胞接种于含1%青链霉素、1%胎牛血清的DMEM培养基,放入含95%空气、5% CO2、37℃培养箱孵育。在24孔板接种对数期RT-4细胞,Lipo 2000转染anti-miR-141、anti-miR-NC,用Opti-MEM培养基进行转染,培养4~6 h后用DMEM培养基代替,收集转染48 h细胞备用。用不同浓度(0.003 2、0.016 0、0.080 0、0.400 0、0.800 0、2.000 0、10.000 0 μmol/L)的JQ1处理RT-4细胞48 h,CCK-8法检测细胞存活率,计算IC50值为0.791,后续用0.800 0 μmol/L的JQ1进行下一步实验。正常培养的RT-4细胞为对照(Control)组;用含0.800 0 μmol/L JQ1的培养液孵育RT-4细胞48 h,记为JQ1组;转染anti-miR-141的RT-4细胞记为anti-miR-141组;用含0.800 0 μmol/L JQ1的培养液孵育转染anti-miR-NC、转染anti-miR-141的RT-4细胞48 h,记为JQ1+anti-miR-NC组、JQ1+anti-miR-141组。
1.4CCK-8法检测细胞增殖活力 将未转染RT-4细胞、转染RT-4细胞分别接种96孔板,根据1.3分组给予对应剂量的JQ1处理,孵育24、48、72 h时,用含10% CCK-8试剂的培养液替换原培养液,孵育2 h后,在450 nm处测量所有样品的光密度(OD)。
1.5集落形成实验检测细胞克隆能力 收集各组细胞并清洗,以1×103个/孔接种6孔板,培养14~16 d直到出现细胞集落,用70%乙醇固定细胞集落,然后用结晶紫溶液染色。计数50个以上细胞的集落数表示为克隆形成数。
1.6流式细胞术检测细胞凋亡率 收集各组细胞并清洗,用Annexin V-FITC/碘化丙啶凋亡检测试剂盒检测细胞凋亡。染色后,所有标本立即在FACSort流式细胞仪上进行检测,用Cell Quest3.0软件分析数据。
1.7Western印迹法检测PI3K/AKT通路和凋亡相关蛋白表达 收集各组细胞并清洗,将RIPA裂解液加入沉淀中,超声破碎细胞,离心吸取上清,获得蛋白样品。根据蛋白浓度,将蛋白样品与上样缓冲液混合沸水孵育5 min,使蛋白质变性。加样后进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)(80 V,30 min;100 V 60 min),恒定电流转膜(220 mA,60 min),然后将膜放入含5%脱脂牛奶中封闭1 h。按照抗体说明书稀释一抗和二抗,在室温下分别孵育膜2 h。滴适量电化学发光(ECL)液于膜上,用凝胶成像仪曝光,通过Image J软件采集图像,计算目的条带相对于内参β-actin的灰度值。
1.8统计学方法 采用SPSS21.0统计软件进行t检验、单因素方差分析。
2 结 果
2.1miR-141在癌组织和癌旁组织中的表达情况 膀胱癌组织中miR-141表达水平(2.33±0.36)显著高于癌旁组织(1.00±0.12;t=33.250,P<0.000 1)。
2.2BRD4抑制剂JQ1对膀胱癌细胞存活率的影响 用不同浓度(0.003 2、0.016 0、0.080 0、0.400 0、0.800 0、2.000 0、10.000 0 μmol/L)的JQ1处理RT-4细胞48 h,CCK-8法检测细胞存活率分别为(100.00±3.11)%、(95.36±7.22)%、(88.36±7.05)%、(73.47±6.27)%、(49.19±5.23)%、(37.33±4.04)%、(25.19±3.04)%,计算IC50值为0.791,选择0.800 0 μmol/L的JQ1进行后续实验。
2.3BRD4抑制剂JQ1联合anti-miR-141对膀胱癌细胞增殖的影响 与转染anti-miR-NC(1.00±0.12)比较,转染anti-miR-141后RT-4细胞miR-141表达(0.24±0.05)显著降低(P<0.05),表明转染anti-miR-141可抑制miR-141表达。与Control组比较,JQ1组、anti-miR-141组RT-4细胞活力(24 h、48 h、72 h)显著降低(P<0.05);与JQ1+anti-miR-141组比较,anti-miR-141组、JQ1组、JQ1+anti-miR-NC组RT-4细胞活力(48 h、72 h)显著升高(P<0.05),见表1。
表1 JQ1联合anti-miR-141对膀胱癌细胞OD值的影响
2.4BRD4抑制剂JQ1联合anti-miR-141对膀胱癌细胞菌落形成的影响 Control组、JQ1组、anti-miR-141组、JQ1+anti-miR-NC组、JQ1+anti-miR-141组克隆数分别为(346.56±41.16)个、(237.67±16.33)个、(212.22±28.77)个、(259.11±28.62)个、(148.00±13.88)个;与Control组比较,JQ1组、anti-miR-141组RT-4细胞克隆形成数显著减少(P<0.05);与JQ1+anti-miR-141组比较,anti-miR-141组、JQ1组、JQ1+anti-miR-NC组RT-4细胞克隆形成数显著增加(P<0.05),见图1。
2.5BRD4抑制剂JQ1联合anti-miR-141对膀胱癌细胞凋亡的影响 与Control组比较,JQ1组、anti-miR-141组RT-4细胞凋亡率及Cl-caspase-3、Bax蛋白水平显著升高,Bcl-2蛋白水平显著降低(P<0.05);与JQ1+anti-miR-141组比较,anti-miR-141组、JQ1组、JQ1+anti-miR-NC组RT-4细胞凋亡率及Cl-caspase-3、Bax蛋白水平显著降低,Bcl-2蛋白水平显著升高(P<0.05),见图2、表2和图3。
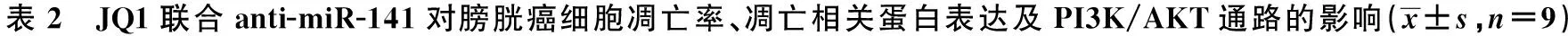
2.6BRD4抑制剂JQ1联合anti-miR-141对膀胱癌细胞PI3K/AKT通路的影响 蛋白免疫印迹检测相关蛋白表达与Control组比较,JQ1组、anti-miR-141组RT-4细胞p-PI3K和p-AKT蛋白表达水平显著降低(P<0.05);与JQ1+anti-miR-141组比较,anti-miR-141组、JQ1组、JQ1+anti-miR-NC组RT-4细胞p-PI3K和p-AKT蛋白表达水平显著升高(P<0.05),见表2和图3。
3 讨 论
miRNA通过与不同的靶基因结合参与调控肿瘤生长、转移等癌症进展多个环节,在人类癌症防治中具有潜在重要临床价值〔10〕。研究报道肝癌中miR-141表达下降,上调miR-141可影响肝癌细胞周期分布和凋亡,抑制体外增殖活力和迁移能力〔11〕。青藤碱通过下调lncRNA MALAT1表达、上调miR-141表达来抑制胃癌细胞恶性表型〔12〕。然而,miR-141在结肠癌中表达增加,可能作为癌基因参与结肠癌进展和转移过程,是结肠癌早期诊断和基因治疗的新靶点〔13,14〕。与之前研究结果一致〔5,6〕,本研究结果表明膀胱癌组织中miR-141表达增加,下调miR-141表达可抑制RT-4细胞增殖活力和克隆形成能力,诱导细胞凋亡,证实miR-141在膀胱癌中的致癌功能。BRD4抑制剂JQ1对多种人类癌症具有抑制作用,研究报道JQ1可阻止肾癌细胞增殖和上皮间质转化进展,诱导caspase-1依赖性细胞焦亡〔15〕。JQ1通过能力减弱DNA修复来增加宫颈癌细胞对放射治疗的敏感性〔16〕。JQ1联合阿霉素能够抑制骨肉瘤细胞生长,并诱导骨肉瘤细胞凋亡〔17〕。本研究发现JQ1可抑制RT-4细胞增殖活力,诱导细胞凋亡,与谭益帆等〔8〕研究结果吻合。JQ1与下调miR-141表达的抗肿瘤作用一致,本研究结果表明,JQ1联合下调miR-141具有更强的肿瘤抑制作用。Bcl-2家族蛋白通过调节线粒体外膜通透性、膜电位丧失水平,诱导细胞色素C的释放,促进凋亡复合物形成,激活caspase-9,Cl-caspase-9随后激活caspase-3,最终诱导凋亡过程〔18,19〕。本研究表明JQ1联合下调miR-141在膀胱癌中协同发挥抗肿瘤作用。
PI3K/AKT通路在信号转导调节中起重要作用,其介导肿瘤细胞增殖、代谢、凋亡和血管生成等多种生物学过程〔20,21〕。PI3K/AKT通路的过度激活与膀胱癌细胞快速生长、肿瘤进展和多药耐药密切相关〔20,22〕。研究报道JQ1通过PI3K/AKT通路诱导胶质瘤干细胞的周期停滞和凋亡〔23〕。本研究结果表明,JQ1联合下调miR-141可能通过抑制PI3K/AKT通路协同发挥抗膀胱癌作用。
综上,BRD4抑制剂JQ1联合下调miR-141可抑制膀胱癌细胞增殖并诱导细胞凋亡,其机制可能与抑制PI3K/AKT通路有关。因此,BRD4抑制剂JQ1联合下调miR-141可能是一种潜在有效的膀胱癌治疗策略。
