动物产品中腹泻性贝类毒素检测方法研究
2022-11-19胡忆文侯义宏禹思宇谭建锡唐连飞
陈 盼,胡忆文,侯义宏,禹思宇,陆 静,谭建锡※,唐连飞※
(1.长沙县食品药品安全检测中心,湖南 长沙 410010;2.长沙海关技术中心,湖南 长沙 410004)
冈田酸(Okadaic acid,OA),又被称为大田软海绵酸、黑海绵酸,是腹泻性贝类毒素的主要成分之一,属于脂溶性多环醚物质,主要由有毒藻类产生。腹泻性贝类毒素经食藻鱼类或贝类捕食有毒藻类后在其体内富集,但该类毒素对贝类等本身并不造成致死影响,当人类食用这些鱼类或贝类等动物产品后,可导致胃肠功能障碍等一系列中毒症状,如恶心、呕吐和腹泻等。除此之外,实验证明OA存在很强的慢性毒性,是一种强烈的致癌物质,可以诱导蛋白质过度磷酸化,促使细胞凋亡和诱导肿瘤形成,最终发生癌变。研究表明,腹泻性贝类毒素几乎在全球范围内都有分布。近年来因食用贝类等动物产品的中毒事件时有发生,己成为公共安全隐患[1-3]。因此,利用有效手段对OA进行检测,对保障环境和食品安全都有着重要的意义。
核酸适体(aptamer)是通过体外筛选技术-指数富集配体系统进化技术(Systematic evolution of ligands by exponcntial enrichment,SELEX),针对目的靶标筛选得到的特定单链寡核苷酸序列,但对靶标有更高的特异性和亲和力。且可在体外合成,具有热稳定性好、易于修饰、成本低等优点,基于其构建的生物传感器方法等得到广泛的研究及应用[4-6]。
本研究基于腹泻性贝类毒素冈田酸核酸适体,构建了特异性适体辅助识别体系平台,探讨小分子核酸适体快速检测水产品等动物产品中腹泻性贝类毒素冈田酸的有效方法,保障养殖业健康发展和食品安全。
1 材料与方法
1.1 材料与试剂
根据文献设计带有修饰标记的OA特异性适体序列[7],由上海生工生物股份有限公司合成。链霉亲和素标记微孔板购自美国Thermo公司。
体系缓冲溶液:50 mM Tris-HCL(pH7.6),5mM MgCl2溶液,150 mM NaCl溶液。洗涤缓冲溶液:PBST浓缩液(英国朗道公司)。
1.2 仪器与设备
冷冻离心机(美国sigma公司);恒温水浴锅(德国Memmer公司);多功能酶标仪(美国TECAN公司)。
1.3 溶液体系制备方法
核苷酸用去核酸水溶解成100 μM母液,后将母液进行稀释,置于4℃冰箱中保存备用。
1.4 体系包被处理
加入OA特异性适体与互补探针杂交(终浓度1 μM),体系缓冲溶液置于95℃中5 min。在链霉亲和素标记微孔板中加入30μL OA特异性适体与互补探针杂交溶液,置于37℃反应1 h后用洗涤缓冲液洗涤备用。
1.5 检测步骤优化
标准溶液浓度用体系缓冲液稀释后,分别吸取取100 μL加入到上述包被微孔板中,室温下孵育半小时后,用洗涤缓冲液洗涤;拍干后,接着加入链霉亲和素标记-HRP(50 μL/孔),于室温孵育半小时后移去反应液,用洗涤缓冲液洗涤;然后,加入底物显色液,反应半小时后观察颜色变化。最后,终止反应后用酶标仪测定其吸光度值。
1.6 实验可行性检测
a.空白组,微孔板包被处理后,加入0 mg/L的标准溶液100μL。
b.微孔板进行包被处理后,加入0.02 mg/L的标准溶液100 μL。
c.微孔板进行包被处理后,加入0.2 mg/L的标准溶液100 μL。
d.对照组,微孔板不包被处理,加入0 mg/L的标准溶液100 μL。
1.7 检测条件
设定酶标仪波长300 nm~600 nm,扫描测定体系溶液的波谱图,并根据测量吸光度值绘制吸光度与OA浓度线形图。
2 结果与分析
2.1 平台构建可行性
OA特异性适体与互补探针杂交,两者可形成复合物;并利用生物素(Biotin)修饰后,加入到链霉亲和素标记微孔板上,通过生物素和链霉亲和素两者之间的特异相互作用,可使复合物固定在链霉亲和素结合微孔板上。当存在OA时,特异性结合适体形成双链复合物,导致适体被脱离,无法结合HRP,从而不能催化底物显色。不存在OA时,形成复合物被固定于微孔板上,进而与HRP结合,底物被催化后由无色变为蓝色,反应被终止后溶液变成黄色。
2.2 检测实际应用可行性
显色体系底物在酶的催化下逐渐产生颜色,在优化的实验条件下,颜色逐渐变为淡蓝色。随着作用时间的延长,在未加入终止液时,体系颜色呈现淡蓝色并逐渐加深。且随着标准溶液浓度的增加,从0 mg/L~0.2 mg/L时,颜色也随之变浅。结果显示,在空白组微孔板只进行包被处理,然后加入0 mg/L标准溶液,体系颜色最深(a);在对照组体系,微孔板未进行包被处理,反应后溶液颜色最浅(d)。显色体系在未被终止前,由于蓝色产物辨识度相较于黄色产物更高,可用裸眼进行初步观察。在加入酸被终止后,溶液颜色变为黄色,在300 nm~600 nm波长进行扫描,最大吸收峰显示在450 nm波长处(见图1)。同时,通过图2中可以看到,随着浓度增加(0 mg/L~0.2 mg/L),体系在450 nm波长的吸光度值逐渐减小。在空白组a中获得最大吸光度值,在对照组d中获得最小吸光度值。从上面的结果可以推断,OA与核酸适体序列发生特异性识别,使其从双链复合物中被释放到体系中,导致可结合标记酶催化反应程度不同,从而产生不同程度的颜色反应,最终产生不同的吸光度值,并可从侧面反映出溶液中的靶标含量。
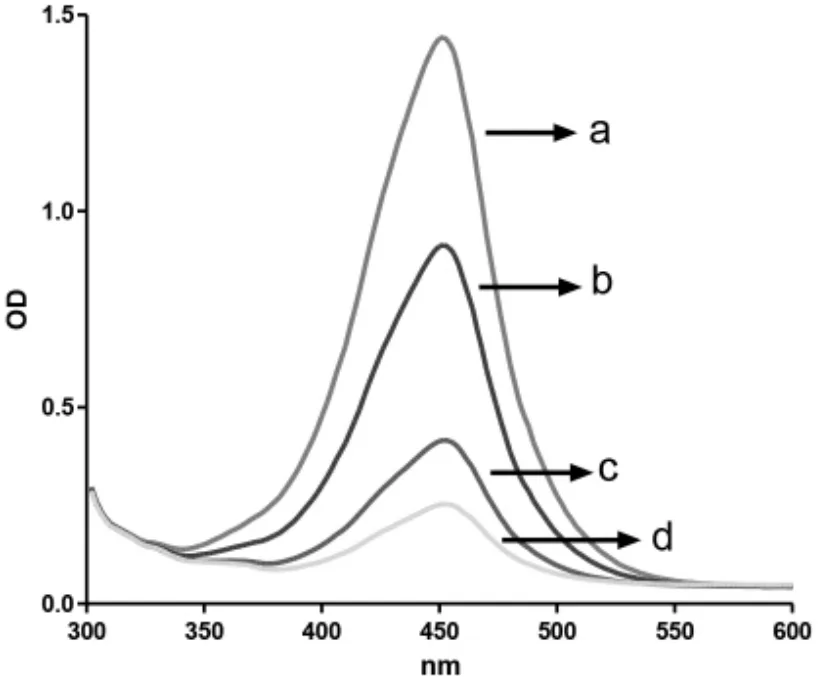
图1 不同波长对底物显色后的扫描结果Fig.1 Scanning resultsafter substrate color development at different wavelengths

图2 不同体系浓度孵育后吸光度值Fig.2 Absorbance values after incubation with different system concentrations
3 讨论
腹泻性贝类毒素的检测方法主要包括小鼠分析法、化学分析法、免疫分析法[8-10]。小鼠分析法曾作为美国官方分析化学师协会(AOAC)的标准方法使用,但由于小鼠的个体差异以及涉及到伦理问题,该方法已基本不再使用。化学分析法具有检测限低、准确性高、灵敏度好等优势,适于实验室较高精度需求,但通常需要高效液相色谱(HPLC)、高效液相色谱-质谱联用,仪器较为昂贵,在推广普及使用中存在困难。免疫分析法因具有特异性良好、灵敏度和稳定性高等优点,其应用较为广泛,但较易受到环境因素的干扰影响,如离子强度、pH等,在现场快速检测使用中存在局限性。
本研究基于核酸适体与靶标间的高特异性结合力,以OA适体为特异性识别元件,探讨基于小分子核酸适体快速检测动物产品中腹泻性贝类毒素的可行性。该方法可根据底物浓度不同,产生不同程度的颜色反应,用肉眼进行初步判断,具有操作步骤简便、成本低、对检测硬件要求低等优点,为基层养殖现场快速、简便初筛检测提供了全新的思路。
