miR-92b-3p/USF2/DNA损伤轴调节葡萄膜黑色素瘤增殖和侵袭
2022-11-18郝雅楠陈妍鹏仝真真赵晓敏
郝雅楠,陈妍鹏,仝真真,袁 沣,赵晓敏
(河北北方学院附属第一医院眼科,河北 张家口 075000)
葡萄膜黑色素瘤(uveal melanoma,UM)是成人中常见的原发性眼内恶性肿瘤,为起源于虹膜、睫状体和脉络膜内的黑色素细胞,发病率高,患者预后差[1]。UM早期症状无明显特异性,多数患者确诊时已处于中晚期,且UM具有极高的转移特性,多以肝转移为主,发生肝转移的患者生存率较低[2]。因此,探讨UM的发病机制对于该病的诊断和治疗有重要意义。微小RNA(microRNA,miRNA)是一种由20多个核苷酸组成的非编码单链小分子RNA,研究显示,miRNA在包括UM在内的多种人类恶性肿瘤中发挥促癌或抑癌作用[3-5]。既往研究显示,miR-26a在UM中低表达,上调miR-26a的表达可抑制UM细胞增殖、迁移和侵袭,并诱导凋亡,表明miRNA在UM恶性行为学中发挥重要作用[6]。miR-92b-3p属于miR-25家族,可调控细胞生长周期,促进肿瘤细胞增殖,有研究显示,miR-92b-3p可通过调节下游靶基因促进结直肠癌细胞增殖[7]。然而目前对于miR-92b-3p与UM的关系尚不清楚。上游刺激因子2(upstream stimulatory factor 2,USF2)是一种多功能的转录因子,在真核生物中广泛表达[8]。目前关于miR-92b-3p是否可通过靶向USF2调控UM细胞增殖和侵袭尚未可知。本研究初步探讨miR-92b-3p对UM细胞增殖和侵袭的影响,并初步分析其可能的作用机制,以期为临床治疗UM提供理论依据。
1 材料与方法
1.1 细胞、试剂与仪器
APRE-19、OCM-1A和MUM-213细胞株购自中国科学院上海生命科学研究院细胞资源中心;RNA提取试剂TRIzol及转染试剂LipofectamineTM2000均购自南京森贝伽生物科技有限公司;TaqManMicroRNA Reverse Transcription kit逆转录试剂盒购自上海妍琦生物科技有限公司;PCR试剂盒QuantiFast SYBR Green PCR kit购自武汉极捷生物科技有限公司;Cell Counting Kit-8(CCK-8)试剂盒购自深圳市纽邦生物技术有限公司;RPMI 1640培养基购自上海经科化学科技有限公司;胎牛血清购自爱必信(上海)生物科技有限公司;二喹啉甲酸(bisquinolinecarboxylic acid,BCA)蛋白浓度测定试剂盒、十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶配制试剂盒均购自北京伊塔生物科技有限公司;乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒购自上海吉至生化科技有限公司;免疫组化染色试剂盒购自上海沪峥生物科技有限公司;司美替尼和H2O2溶液购自美国Sigma公司;磷酸化组蛋白H2AX(phosphorylated H2AX,γH2AX)、Bcl-2相关X蛋白(Bcl-2 related X protein,Bax)、B细胞淋巴瘤/白血病-2(B cell lymphoma/leukemia-2,Bcl-2)、USF2和Ki67多克隆抗体以及辣根过氧化物酶标记的羊抗兔免疫球蛋白G二抗均购自上海科敏生物科技有限公司;DMEM高糖培养基购自上海李记生物科技有限公司;双荧光素酶报告基因系统试剂盒购自成都安森盛源科技有限公司;ST-360型酶标仪购自上海晚成医疗器械有限公司。
1.2 生物信息学分析
通过TCGA数据库下载UM临床样本数据,比较miR-92b-3p和USF2在UM患者不同临床病理特征间的表达情况。根据USF2在UM患者中的中位表达水平将UM患者分为USF2高表达患者和USF2低表达患者,并进行基因富集分析(gene set enrichment analysis,GSEA),以FDR q val<25%和/或nom P val<0.01的富集结果为差异有统计学意义。使用Kaplan-Meier数据库分析miR-92b-3p和USF2基因mRNA水平对UM患者生存期的影响。利用在线预测靶基因数据库StarBase v2数据库预测miR-92b-3p的靶基因。
1.3 细胞培养
将APRE、OCM-1A和MUM-213细胞接种至含10%胎牛血清的RPMI 1640培养基中,在37 ℃、5% CO2饱和湿度条件下培养,细胞为贴壁生长,待胰酶消化液消化后传代培养,实验取对数生长期细胞。
1.4 构建USF2过表达细胞模型
取处于对数生长期的OCM-1A和MUM-213细胞构建USF2过表达模型,将OCM-1A和MUM-213细胞分为Vector组和USF2组,根据Lipofectamine 2000说明书将USF2 NC质粒转染至Vector组细胞,将USF2 mimic质粒转染至USF2组细胞,24 h后更换为完全培养基。采用Western blot检测USF2蛋白表达水平,评估转染效率。将OCM-1A和MUM-213细胞分成miR-NC组、miR-92b-3p组和miR-92b-3p+USF2组;miR-NC组细胞转染miR-NC质粒,miR-92b-3p组转染miR-92b-3p mimic质粒,miR-92b-3p+USF2组转染miR-92b-3p mimic和USF2 mimic质粒。
1.5 RT-PCR检测细胞miR-92b-3p mRNA表达
采用TRIzol法提取APRE-19、OCM-1A和MUM-213细胞中总RNA,采用紫外分光光度计法测定RNA的浓度。按照TaqManMicroRNA Reverse Transcription kit逆转录试剂盒说明书以RNA为模板进行逆转录获得cDNA,4 ℃保存,进行荧光定量PCR扩增,置于PCR仪中测定,设置反应条件:95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火45 s,65 ℃延伸1 min,4 ℃扩增10 min,40个循环。以β-actin为内参,引物序列如下:miR-92b-3p上游引物序列5’-GTCCGCTATTGCACTCGTCCCGGCCTCC-3’,下游引物序列5’-GTGCGTGTCGTGGAGTC-3’;β-actin上游引物序列5’-CTCCATCCTGGCCTCGCTGT-3’,下游引物序列5’-GCTGTCACCTTCACCGTTCC-3’。采用2-ΔΔCT法计算miR-92b-3p mRNA的相对表达水平。
1.6 CCK-8检测细胞增殖
将转染48 h后的OCM-1A和MUM-213细胞消化离心(3 000 r/min,10 min)重悬,细胞以5×103/孔的密度接种于96孔板。采用LipofectamineTM2000进行转染后将细胞置于CO2培养箱中培养24 h,于0 d、1 d、2 d、3 d、4 d、5 d检测细胞增殖。每孔加入10 μL CCK-8溶液,于37 ℃孵育2 h,采用酶标仪于450 nm波长下检测细胞吸光度,以检测细胞增殖能力。
1.7 Transwell实验检测细胞侵袭
将OCM-1A和MUM-213细胞悬液接种于内铺Matrigel胶的Transwell小室中,下层添加含10%胎牛血清的培养基,于37 ℃、5% CO2培养箱中培养48 h,去除Transwell小室并倒去24孔板中的培养基,4%多聚甲醛固定10 min,结晶紫染色15 min,PBS洗3次,用无菌棉签移除未侵袭细胞,于倒置显微镜下观察,拍照并统计细胞数量。实验平行重复3次,取平均值。
1.8 CCK-8检测H2O2干预细胞后对细胞活性的影响
将OCM-1A和MUM-213细胞以5×103/孔的密度接种于96孔板,待细胞贴壁后,MUM-213细胞加入不同浓度(0 μmol/L、200 μmol/L、400 μmol/L、600 μmol/L和800 μmol/L)的H2O2,OCM-1A细胞加入不同浓度(0 μmol/L、250 μmol/L、500 μmol/L、750 μmol/L和1 000 μmol/L)的H2O2,37 ℃培养24 h,随后每孔加入10 μL CCK-8和90 μL DMEM培养基,于37 ℃孵化2 h。采用酶标仪于450 nm波长下测定OD值,计算细胞存活率。
1.9 CCK-8检测细胞转染USF2后对司美替尼化疗的敏感性
取处于对数生长期的OCM-1A和MUM-213细胞,待Vector组、USF2组细胞贴壁后,加入不同浓度(0 μmol/L、0.5 μmol/L、1 μmol/L、2 μmol/L、4 μmol/L和8 μmol/L)的司美替尼。各组细胞处理完后采用CCK-8检测细胞活性,详细步骤见1.8。
1.10 LDH活性检测
将细胞以2×105/mL的密度接种于6孔板,待细胞密度为60%~70%时,弃原培养基,消化离心(1 000 r/min,5 min),加入裂解液后离心(13 000 r/min,5 min)取上清液。按照LDH试剂盒说明书分别进行加样后,用酶联免疫检测仪在440 nm波长下测定OD值,计算LDH活性。
1.11 裸鼠移植瘤实验
10只裸鼠购自四川省医学科学院/四川省人民医院实验动物研究所,许可证号:SCXK(川)2018-15,饲养于20~25 ℃、相对湿度50%~60%的环境中,自由饮食饮水,光照/黑暗周期为12 h/12 h。将小鼠分为Vector组和USF2组,每组5只,分别于小鼠右侧腹股沟皮下接种0.2 mL转染USF2-NC的UM细胞和转染USF2的UM细胞,每2 d用微米级卡尺测量肿瘤体积,于第14天处死小鼠,剥离移植瘤并称重。
1.12 免疫组化染色
处死裸鼠后取出肿瘤组织,常规石蜡切片,烤片、脱蜡水化,PBS冲洗3次,每次5 min;微波修复15 min,切片用过氧化酶抑制剂室温处理10 min,PBS冲洗3次,每次3 min;滴加CBL抗体(1∶100),4 ℃孵育过夜;PBS冲洗3次,每次3 min;滴加辣根过氧化物酶标记的羊抗兔免疫球蛋白G,室温孵育10 min;PBS充分淋洗后,滴加H2O2-DAB显色液显色;复染,脱水透明,封片。阴性对照用PBS代替一抗。于显微镜下观察并拍照。
1.13 双荧光素酶报告基因实验
构建野生型报告基因载体USF2-WT与突变型报告基因载体USF2-MUT,分别与miR-NC或miR-92b-3p共转染到UM细胞中。置于37 ℃、5% CO2培养箱中培养48 h,用荧光素酶检测试剂盒测量各组细胞中的荧光素酶活性。
1.14 Western blot检测Ki67、Bax、Bcl-2和USF2蛋白表达
将各组处于对数生长期的OCM-1A和MUM-213细胞加入SDS Loading buffer,沸水浴中煮沸10 min,电压设置为60 V,溴酚蓝前端进入分离胶后,电压调整到120 V,溴酚蓝迁移到凝胶底部后,取出凝胶。将凝胶浸泡于转膜缓冲液中10 min,PVDF膜放在甲醇中平衡5 min,以200 mA的恒流转膜1 h。电转结束后取出PVDF膜,5%脱脂牛奶室温封闭1 h。加入封闭液稀释的抗体(1∶5 000),4 ℃孵育过夜。次日PBST洗涤6 min,重复3次,然后加入封闭液稀释的辣根过氧化物酶标记的羊抗兔二抗(1∶1 000),室温孵育60 min,PBST洗涤6 min,重复3次,ECL化学发光液显影,以β-actin作为内参,利用BCA蛋白检测试剂盒检测蛋白浓度,具体操作参照试剂盒说明书。
1.15 Western blot检测γH2AX蛋白表达
取处于对数生长期的OCM-1A和MUM-213细胞,将细胞分为Vector组、USF2组、H2O2组和USF2+H2O2组,Vector组不作处理,即正常培养;USF2组转染USF2 mimic质粒;H2O2组中MUM-213细胞以600 μmol/L H2O2处理,OCM-1A细胞以750 μmol/L H2O2处理;USF2+H2O2组中MUM-213细胞转染USF2 mimic质粒+600 μmol/L H2O2处理,OCM-1A细胞转染USF2 mimic质粒+750 μmol/L H2O2处理。采用Western blot检测各组细胞γH2AX蛋白表达,详细步骤见1.14。
1.16 统计学处理
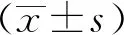
2 结果
2.1 USF2在UM细胞中低表达,且抑制UM细胞增殖并诱导凋亡
Western blot实验结果显示,MUM-213和OCM-1A细胞中USF2表达明显低于APRE-19细胞(P<0.05);与Vector组相比,USF2组中USF2表达明显增加(P<0.05)。细胞增殖实验结果显示,与Vector组相比,USF2组中细胞吸光度明显降低(P<0.05)。细胞侵袭实验结果显示,与Vector组相比,USF2组中侵袭细胞数明显减少(P<0.05)。与Vector组相比,USF2组中细胞LDH活性明显增加(P<0.05)。Western blot实验结果显示,与Vector组相比,USF2组中Ki67和Bcl-2蛋白表达明显降低(P<0.05),Bax蛋白表达明显增加(P<0.05),见图1。

a:USF2在不同UM细胞中的表达;b:Western blot检测MUM-213和OCM-1A细胞中USF2蛋白表达;c:MUM-213细胞增殖实验;d:OCM-1A细胞增殖实验;e:MUM-213和OCM-1A细胞侵袭实验;f:MUM-213和OCM-1A细胞LDH活性;g:Western blot检测MUM-213和OCM-1A细胞相关凋亡蛋白表达 *:与Vector组相比,P<0.05;#:与APRE-19细胞相比,P<0.05
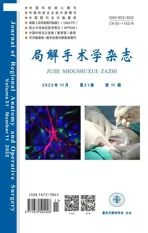
2.2 USF2差异表达与UM恶性程度相关
TCGA数据库分析结果显示,复发患者中USF2表达低于非复发患者(P<0.05);M1期(远处转移)患者USF2表达低于M0期(非远处转移)患者(P<0.05);N1期(淋巴结转移)患者USF2表达低于N0期(非淋巴结转移)患者(P<0.05);USF2低表达患者无病生存期低于USF2高表达患者(P<0.05),见图2。
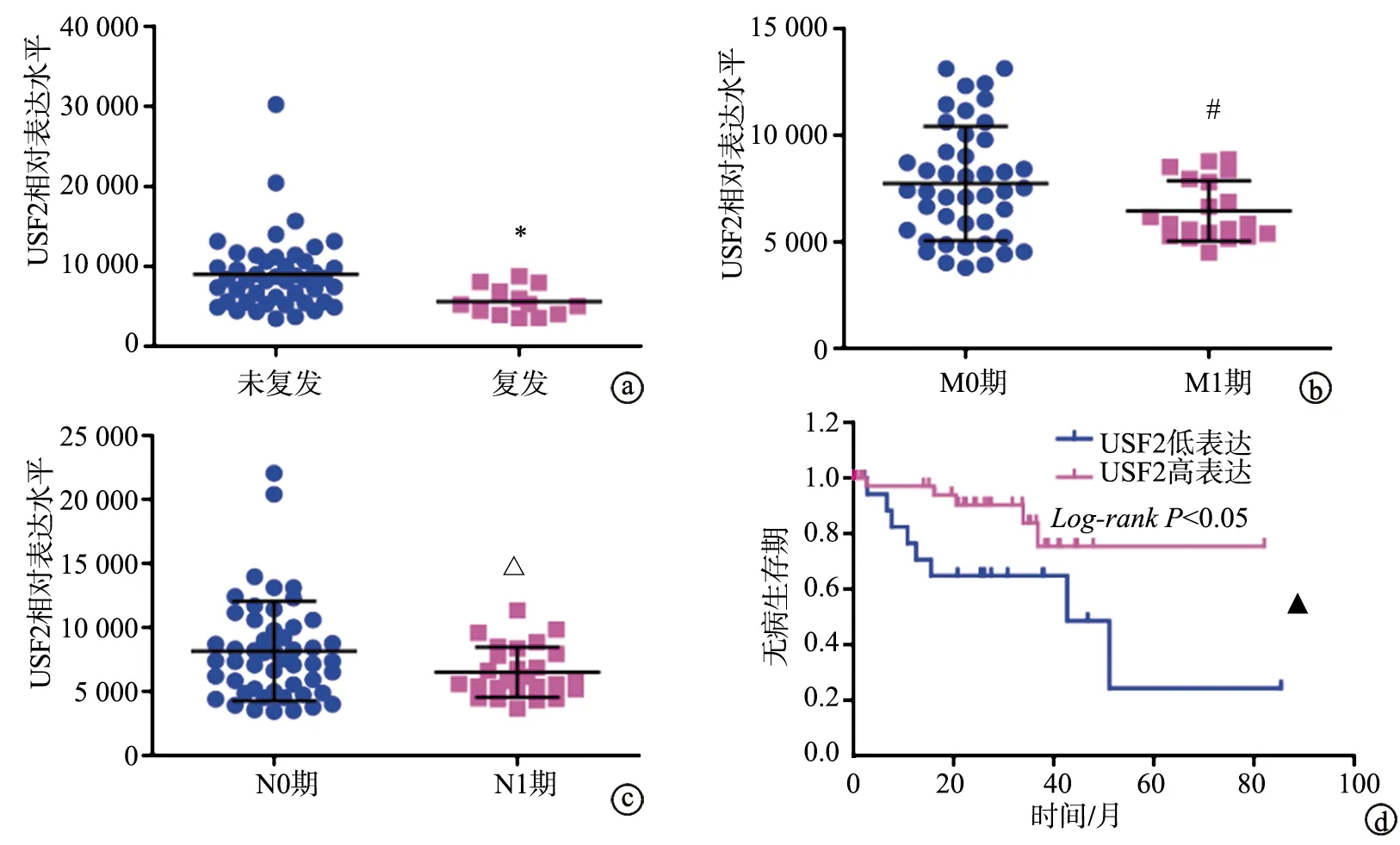
a:USF2在复发和非复发UM患者中的差异表达;b:USF2在M1期(远处转移)与M0期(非远处转移)UM患者中的差异表达;c:USF2在N1期(淋巴结转移)与N0期(非淋巴结转移)UM患者中的差异表达;d:USF2差异表达对UM患者无病生存期的影响*:与非复发患者相比,P<0.05;#:与M0期患者相比,P<0.05;△:与N0期患者相比,P<0.05;▲:与USF2高表达患者相比,P<0.05
2.3 USF2高表达在体内抑制UM细胞增殖
采用裸鼠移植瘤实验进一步验证USF2高表达在UM中的抑制作用,结果显示,USF2组移植瘤体积和质量明显小于Vector组(P<0.05)。随着时间的推移,移植瘤体积不断增大,但USF2组的增长速度明显小于Vector组(P<0.05)。免疫组化染色显示,USF2组中USF2蛋白表达明显高于Vector组(P<0.05),见图3。

a:移植瘤体积随时间的变化;b:移植瘤瘤体体积;c:移植瘤瘤体质量;d:免疫组化染色检测UM组织中USF2表达(×200) *:与Vector组相比,P<0.05
2.4 USF2促进DNA损伤和增强UM细胞对司美替尼化疗的敏感性
GSEA结果显示,USF2差异表达水平与DNA损伤有关。不同浓度H2O2对MUM-213和OCM-1A细胞增殖具有抑制作用,相对细胞活力随着H2O2浓度增加而降低。Western blot实验结果显示,与Vector组相比,USF2组、H2O2组和H2O2+USF2组γH2AX蛋白表达明显增加(P<0.05),H2O2+USF2组γH2AX蛋白表达明显高于H2O2组(P<0.05)。用不同浓度的司美替尼处理细胞后,UM细胞活性逐渐下降,在浓度为0.5 μmol/L、1 μmol/L、2 μmol/L时USF2组细胞活性小于Vector组(P<0.05),见图4。
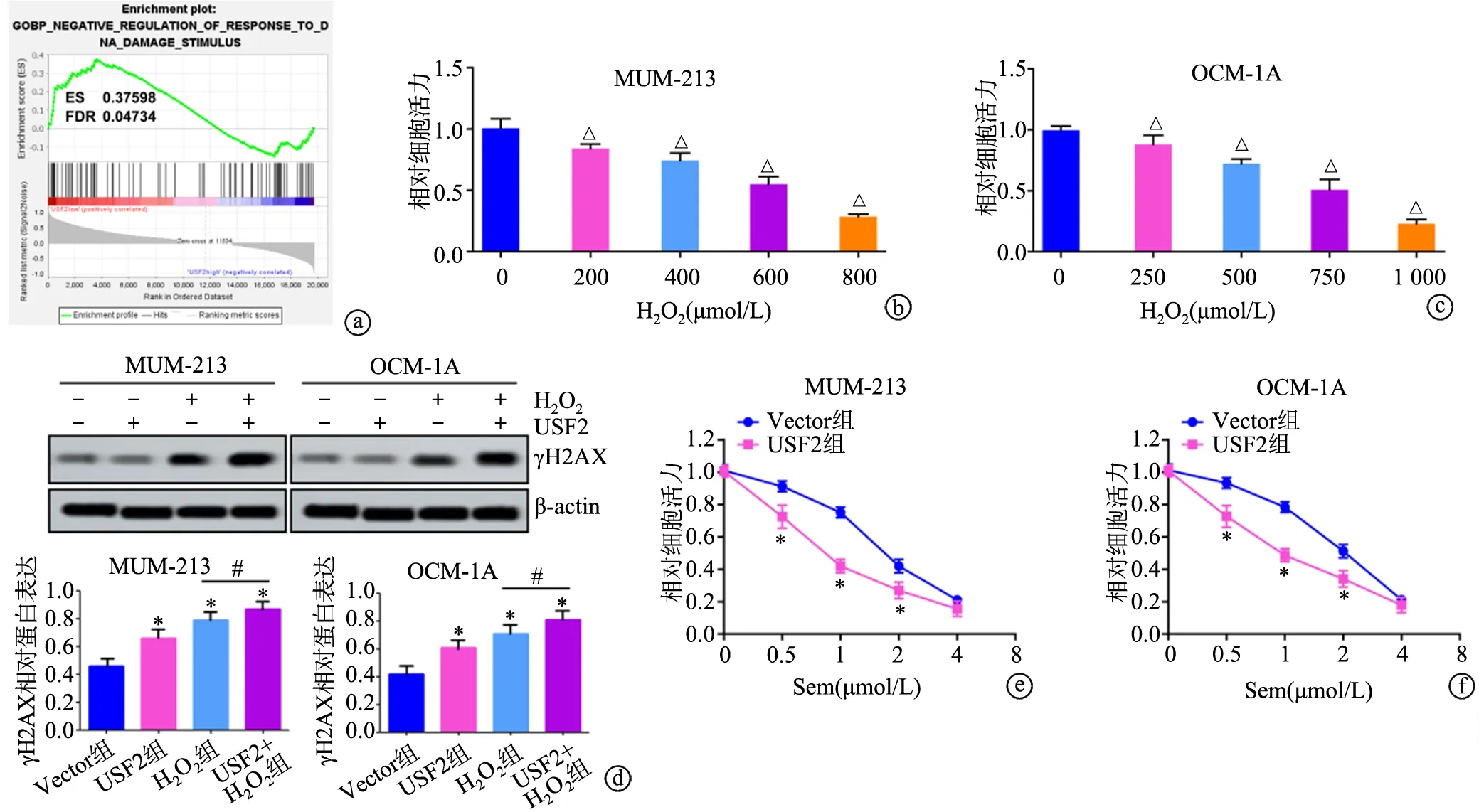
a:USF2差异表达与DNA损伤有关;b:不同浓度H2O2抑制MUM-213细胞活性;c:不同浓度H2O2抑制OCM-1A细胞活性;d:Western blot检测DNA损伤标记物;e:RT-PCR检测不同浓度司美替尼作用后MUM-213细胞活性;f:RT-PCR检测不同浓度司美替尼作用后OCM-1A细胞活性 *:与Vector组相比,P<0.05;#:与H2O2组相比,P<0.05;△:与0 μmol/L H2O2相比,P<0.05
2.5 miR-92b-3p可靶向结合USF2抑制USF2表达
RT-PCR实验结果显示,MUM-213和OCM-1A细胞中miR-92b-3p mRNA表达高于APRE-19细胞(P<0.05)。TCGA数据库分析结果显示,与肿瘤分期Ⅱ期患者相比,肿瘤分期Ⅲ~Ⅳ期患者中miR-92b-3p高表达(P<0.05);与T2~T3期患者相比,T4期患者中miR-92b-3p高表达(P<0.05);与非复发患者相比,复发患者中miR-92b-3p高表达(P<0.05);与miR-92b-3p低表达患者相比,miR-92b-3p高表达患者总生存期明显较短(P<0.05)。生物信息学分析结果表明,miR-92b-3p序列3’-UTR区与USF2存在结合位点。双荧光素酶报告基因实验显示,miR-92b-3p mimic与USF2-WT共转染致荧光素酶活性降低(P<0.05)。在OCM-1A和MUM-213细胞中,RT-PCR实验结果显示,与Vector组相比,USF2组中USF2 mRNA表达明显降低(P<0.05)。Western blot实验结果显示,与Vector组相比,USF2组中USF2蛋白表达水平明显降低(P<0.05),见图5。
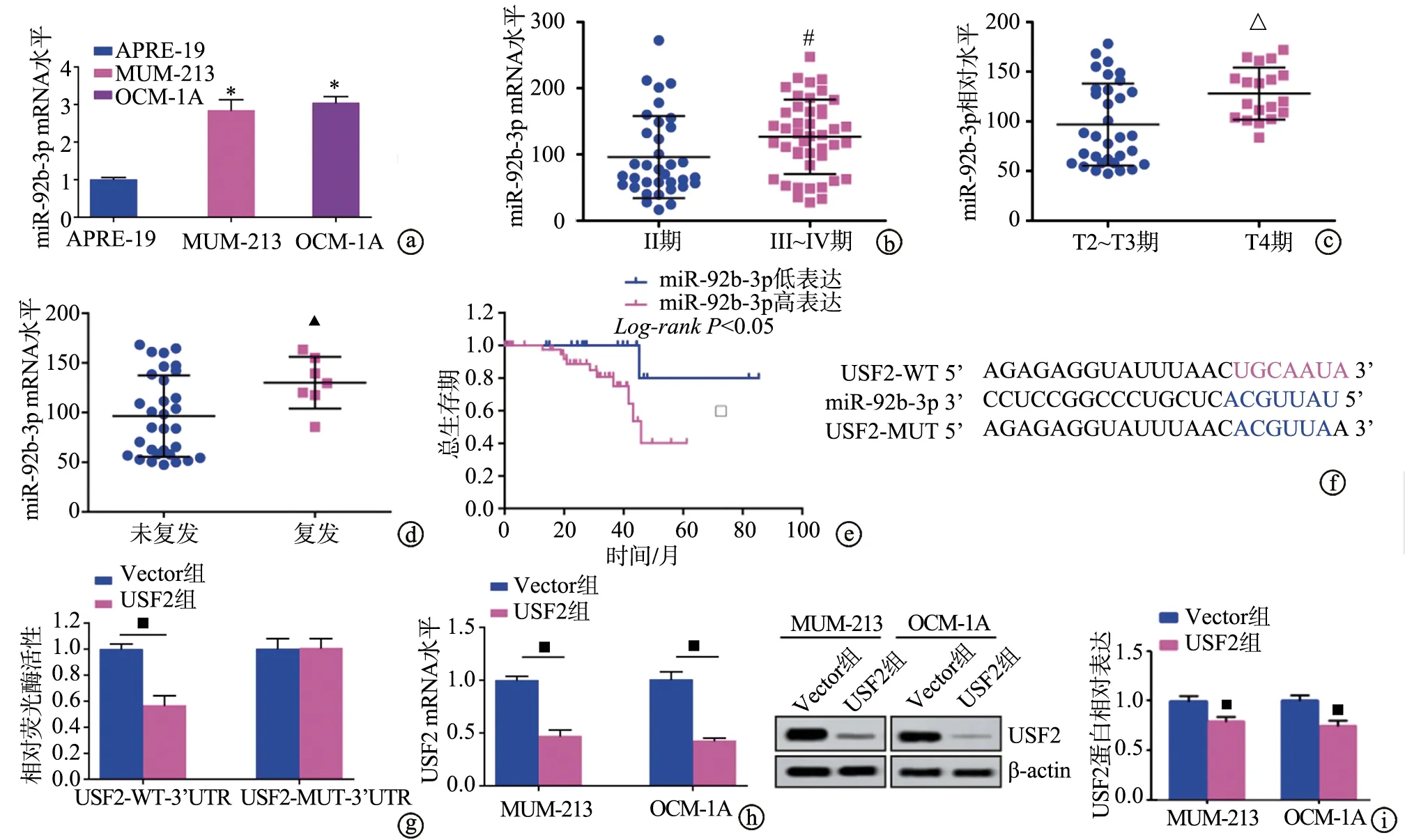
a:miR-92b-3p mRNA在UM细胞中高表达;b:miR-92b-3p mRNA在UM不同分期中的差异表达;c:miR-92b-3p差异表达与UM侵犯其他组织进展;d:miR-92b-3p在复发和非复发患者中差异表达;e:miR-92b-3p差异表达对患者总生存期的影响;f:miR-92b-3p与USF2的靶标关系;g:双荧光素酶报告基因实验验证miR-92b-3p与USF2的靶标关系;h:USF2 mRNA相对表达水平;i:USF2蛋白相对表达水平 *:与APRE-19细胞相比,P<0.05;#:与Ⅱ期患者相比,P<0.05;△:与T2~T3期患者相比,P<0.05;▲:与非复发患者相比,P<0.05;□:与miR-92b-3p低表达患者相比,P<0.05;■:与Vector组相比,P<0.05
2.6 miR-92b-3p靶向结合USF2抑制UM细胞增殖和侵袭
在OCM-1A和MUM-213细胞中,Western blot实验结果显示,与miR-NC组相比,miR-92b-3p组中USF2蛋白表达明显降低(P<0.05),miR-92b-3p+USF2组中USF2蛋白表达无明显差异(P>0.05)。细胞增殖实验结果显示,与miR-NC组相比,miR-92b-3p组中细胞吸光度明显增加(P<0.05),miR-92b-3p+USF2组中细胞吸光度无明显差异(P>0.05)。细胞侵袭实验结果显示,与miR-NC组相比,miR-92b-3p组中侵袭细胞数明显增加(P<0.05),miR-92b-3p+USF2组中侵袭细胞数无明显差异(P>0.05)。细胞LDH活性检测结果显示,与miR-NC组相比,miR-92b-3p组中细胞LDH活性明显降低(P<0.05),miR-92b-3p+USF2组中细胞LDH活性无明显差异(P>0.05),见图6。
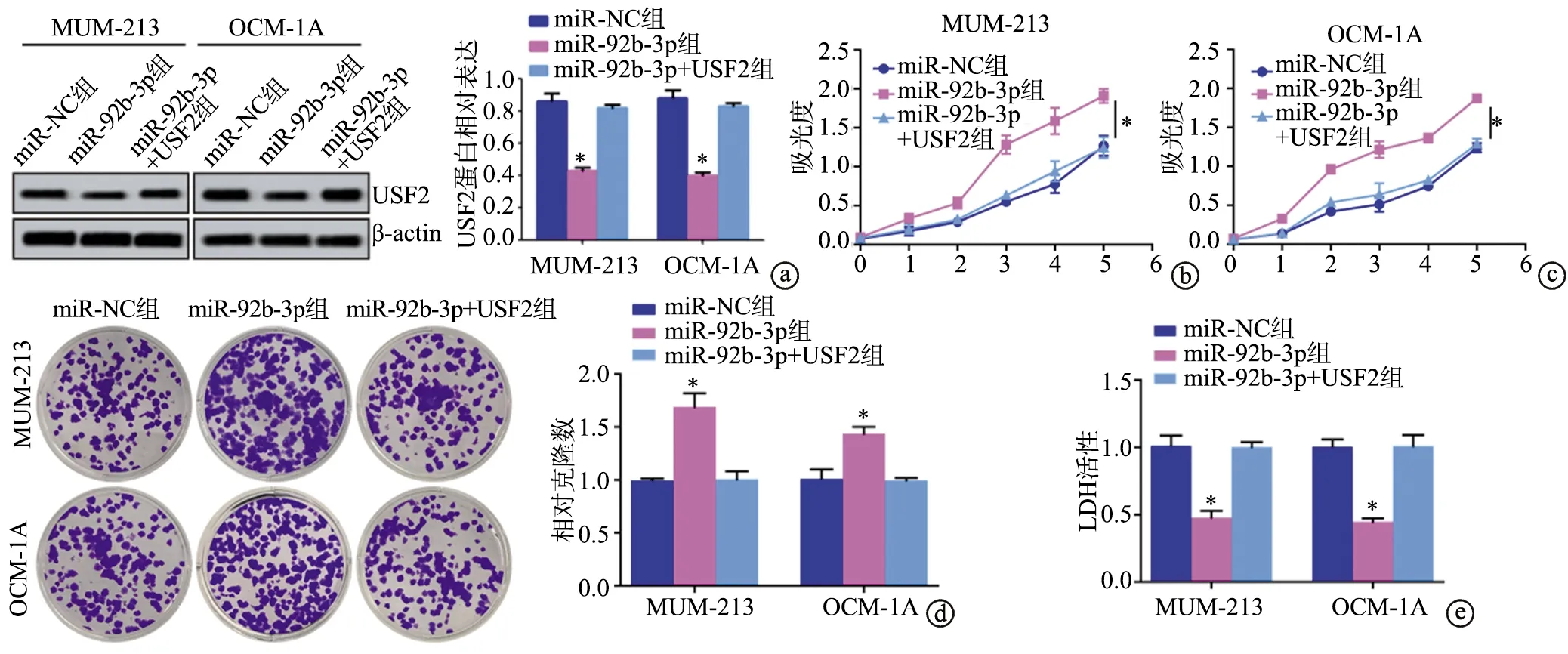
a:USF2蛋白表达;b:MUM-213细胞增殖实验;c:OCM-1A细胞增殖实验;d:OCM-1A和MUM-213细胞侵袭实验;e:OCM-1A和MUM-213细胞LDH活性 *:与miR-NC组相比,P<0.05
3 讨论
UM是发生于眼球的疾病,具有转移速度快、恶性程度高、患病率高以及预后不良等特点,严重影响患者生活和生命健康[9]。目前对于UM转移的风险尚不清楚,且早期转移无明显症状,当患者被发现出现转移时临床干预效果不理想,导致患者病死率高[10]。因此,研究UM的发病机制并寻找有效的生物靶点对临床治疗UM意义重大。
本研究通过生物信息学分析发现,USF2在复发UM患者中的表达低于非复发患者,且USF2差异表达与UM临床恶性程度相关。Western blot实验结果显示,UM细胞(MUM-213和OCM-1A细胞)中USF2表达明显低于APRE-19细胞,表明USF2在UM细胞中低表达。因此,本研究构建USF2过表达细胞模型进行体外试验,分析USF2在UM细胞中的作用。细胞增殖实验显示,USF2过表达抑制细胞增殖;细胞侵袭实验结果显示,USF2过表达抑制细胞侵袭。细胞LDH活性检测结果显示,USF2过表达增加细胞LDH活性;Western blot实验结果显示,USF2过表达下调Ki67和Bcl-2蛋白表达,上调Bax蛋白表达。LDH是含有锌离子的金属蛋白,是一种糖酵解酶,参与机体的糖代谢过程[11]。LDH在体内分布广泛,主要存在于细胞质中,当细胞出现损伤时,胞质中的LDH释放到血液中导致LDH水平异常升高,是临床常用的检测细胞损伤的指标,可作为癌症诊断和预后的重要标志物[12]。既往研究显示,乳腺癌患者治疗后LDH水平与治疗后肿瘤复发转移具有一定相关性[13],提示LDH水平与肿瘤发展进程具有一定相关性。Ki67表达可以反映肿瘤细胞有丝分裂增殖情况,与肿瘤的分化程度、分型以及淋巴结转移均有关,是公认的增殖因子[14]。既往研究显示,Ki67可作为前列腺癌预后的危险因素[15]。抗凋亡蛋白Bcl-2和促凋亡蛋白Bax均为Bcl-2家族成员,二者协同作用调控机体细胞凋亡[16]。既往研究显示,miR-93可能通过调节Bcl-2、Bax表达参与胃癌细胞凋亡过程[17],结合本研究结果推测USF2可能通过调节Bcl-2、Bax表达影响UM发展进程。本研究结果显示,USF2过表达可抑制UM细胞增殖、侵袭,增加LDH活性,通过上调促凋亡蛋白Bax表达,下调抗凋亡蛋白Bcl-2表达,进而诱导UM细胞凋亡。
为进一步验证USF2过表达在UM细胞中发挥的抑制作用,我们进行裸鼠移植瘤实验,结果显示,USF2组移植瘤体积和质量明显小于Vector组,随着时间的推移,移植瘤体积不断增大,在14 d时,USF2组瘤体体积明显小于Vector组;免疫组化结果显示,USF2组中USF2表达明显高于Vector组,提示USF2过表达可在体内抑制UM肿瘤生长。本研究通过生物信息学分析发现,USF2可能促进DNA损伤。本研究发现,在H2O2处理后,UM细胞吸光度随着其浓度增加而降低,说明H2O2浓度越大对UM细胞活力的抑制程度越强;不同浓度的司美替尼处理细胞后,UM细胞活性逐渐下降,USF2组细胞活性下降幅度大于Vector组,说明司美替尼浓度越大UM对化疗药的敏感性越强;此外,USF2过表达UM细胞经H2O2干预后,γH2AX蛋白表达明显增加。H2AX是组蛋白H2A家族成员之一,在DNA双链断裂的早期,H2AX迅速磷酸化生产γH2AX,募集其他DNA修复蛋白至损伤点,可作为检测DNA双链断裂的一个强有力的新标志物[18-19]。既往研究显示,在H2O2导致肺正常上皮细胞的氧化损伤中,γH2AX可作为DNA氧化损伤标志物[20]。此外,本研究还发现miR-92b-3p在UM细胞中高表达,且与细胞临床病理特征有关;双荧光素酶报告基因实验证实miR-92b-3p可与USF2靶向结合,下调USF2蛋白表达。系列功能实验表明恢复USF2表达可以逆转miR-92b-3p促癌作用。提示miR-92b-3p可通过USF2/DNA损伤轴抑制UM的发展进程。
综上所述,本研究发现USF2在UM细胞中低表达,miR-92b-3p在UM细胞中高表达,生物信息学分析发现,miR-92b-3p存在与USF2靶向结合的位点。上调USF2可以抑制UM细胞增殖、侵袭并诱导凋亡,参与DNA损伤过程,裸鼠移植瘤实验证实USF2过表达可以抑制移植瘤的生长,其作用机制可能是通过miR-92b-3p/USF2/DNA损伤轴调节UM的发展进程。