内镜下黏膜剥离术和内镜下黏膜切除术治疗早期Ⅱ型食管胃交界处肿瘤的疗效对比*
2022-11-18蒲文凤张涛张彦孙亮
蒲文凤 张涛 张彦 孙亮
(南充市中心医院·川北医学院第二临床医学院消化内科,四川 南充 637000)
随着社会的发展及饮食习惯的改变,我国消化道肿瘤的发病率日渐升高,而胃肠镜等常规检查手段的临床应用也导致其检出率日益增高[1-3],食管胃交界处肿瘤发生于连接食管远端与胃近端的区域,相比食管及胃部肿瘤,其临床病理类型及生物学行为完全不同,因此其治疗方式一直以来存在争议[4-5]。传统手术方式下的肿瘤切除创伤相对较大且并发症较多,患者术后生活质量普遍不佳[6]。随着微创理念和技术手段的推广与进步,内镜技术已广泛应用于治疗结直肠癌前病变和早期胃癌,其中以内镜下黏膜切除术(Endoscopic mucosal resection,EMR)与内镜下黏膜剥离术(Eendoscopic submucosal dissection,ESD)最为常见[7-8],但是目前临床上探讨ESD和EMR治疗早期食管胃交界处肿瘤的疗效鲜有报道。本研究旨在比较ESD与EMR治疗早期Ⅱ型食管胃交界处肿瘤的疗效及安全性,为临床治疗提供参考。
1 资料与方法
1.1 一般资料 选择2017年4月~2019年8月于我院因早期Ⅱ型食管胃交界处肿瘤行内镜手术治疗的患者120例,根据手术方式不同分为ESD组(n=64)和EMR组(n=56)。纳入标准:①Siewert分型Ⅱ型,即癌肿主体位于齿状线上1 cm至齿状线下2 cm的范围内。②术后病理结果为腺癌或高级别上皮内瘤变。③患者及家属知情并签署知情同意书。④无明显手术禁忌症。⑤均行内镜下黏膜切除术或黏膜剥离术。排除标准:①患者临床资料不完整。②接受其它手术或联合治疗。③CT结果发现已存在肿瘤转移或可疑转移。④合并其它恶性肿瘤。⑤术后病理结果为低级别上皮内瘤变或鳞状细胞癌。本研究获医院伦理委员会批准通过。
1.2 手术方法 所有患者均采用仰卧位,予以静脉全身麻醉。EMR组:麻醉起效后采用黏膜下注射-切除法,将生理盐水注射入基底部后将其抬举,随后采用圈套器切除病变组织。如病变组织面积较大,则行透明帽法切除:将透明帽放置于肠镜前端,待黏膜下注射完全后,给予负压吸引,并收紧圈套器切除病灶。如术中创面较大或出血量较多时,需给予氩离子凝固术处理创缘或行钛夹夹闭止血。ESD组:麻醉起效后采用靛胭脂染色处理病变部位,随后使用氩离子凝固术沿病变边缘外侧0.5 cm进行电凝标记,具体步骤如下:首先配制5.0 mL靛胭脂+5.0 mL玻璃酸钠+1.0 mL肾上腺素与100 mL氯化钠混合液,采用23 G注射针行黏膜下注射。采用Hook刀沿标记点将黏膜完全切开,在保证手术视野清晰下,采用一次性黏膜切开刀剥离病变处下层,直至剥离出病变组织,或是剥离至一定程度时,改用圈套器进行切除。术中采用氩离子凝固术对出血点和裸露小血管进行电凝处理,或行钛夹夹闭止血。
1.3 观察指标 ①比较两组患者的手术时间及住院时间。②根据术后病理检查结果,比较两组肿瘤病灶的完全切除率(R0切除率)和整块切除率,其中整块切除率定义为术中的切除病灶组织可作为单块标本。R0切除率定义为术后染色结果发现病灶完全切除,且横向和纵向切缘病理活检均为阴性。③比较两组患者术后的并发症发生率,如出血、穿孔、消化道狭窄等。④患者出院后每3个月门诊随访一次,随访时予以内窥镜检查及胸腹部CT检查,比较两组患者的局部复发率和远处复发率。远处复发定义为随访期间内镜手术后CT检查肿瘤淋巴结转移或邻近器官转移。局部复发率定义为内镜手术后复查发现手术疤痕部位为腺癌或高级别上皮内瘤变的病变。

2 结果
2.1 两组患者一般资料比较 两组患者年龄、性别等一般资料及病理结果比较差异均无统计学意义(P>0.05),见表1。
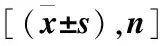
表1 两组患者基线资料及病理结果比较
2.2 两组患者手术时间及住院时间比较 EMR组患者手术时间及住院时间均明显低于ESD组,差异有统计学意义(P<0.05),见表2。

表2 两组患者平均手术时间及住院时间比较
2.3 两组患者术后并发症发生率比较 EMR组术后并发症总发生率明显低于ESD组,差异具有统计学意义(P<0.05),见表3。

表3 两组患者术后并发症发生率比较[n(×10-2)]
2.4 两组患者手术切除效果比较 根据术后病理结果,ESD组的R0切除率及整块切除率分别为92.19%与95.31%,明显高于EMR组的76.29%与80.36%,差异具有统计学意义(均P<0.05),见表4。

表4 两组患者R0切除率及整块切除率比较[n(×10-2) ]
2.5 两组患者术后复发率比较 根据术后随访结果,EMR组的局部复发率及远处复发率分别为12.50%与10.71%,明显高于ESD组的1.56%与0.00%,差异具有统计学意义(均P<0.05),见表5。

表5 两组患者术后肿瘤复发率比较[n(×10-2) ]
3 讨论
ESD与EMR两种手术方式基本原理大致相同,均是黏膜下注射使黏膜下层与黏膜层分离开,随后将病变黏膜切除或剥离[9]。相对于EMR,ESD的手术难度更大,且胃食管连接处主要是远端食管和胃底黏膜之间的连接区域,手术操作空间较小也增大了手术难度[10]。EMR相对手术操作简单,且围手术期不良事件发生率较低,但是EMR通常适用于治疗直径小于2 cm的肿瘤病灶,而直径较大的肿瘤组织若应用EMR治疗通常需要多次逐块切除,这也导致肿瘤组织残留及复发的风险增加[11-13]。由于ESD可将癌变病灶完整切除,病灶切除范围更广,手术适应征且不受肿瘤直径大小的限制,因此ESD的优点是其病灶的整块切除率和完全切除率较高,而病灶的局部复发风险较低[14-15]。本研究结果显示,与EMR患者相比,ESD组患者手术时间及住院时间更长,且并发症的发生率也明显高于EMR组,R0切除率及整块切除率明显高于EMR组,局部复发率及远处复发率明显低于EMR组,与上述研究结果基本一致。ESD 手术治疗的缺点是术后不良事件发生率较高,例如消化道穿孔和出血,因此有研究指出对于年龄较大且身体情况较差的老年肿瘤患者,应考虑选择EMR,保证患者生命安全的前提下也能取得一定的疗效,而对于身体一般情况尚可的年轻患者应首选ESD,其较高的整块切除率和完全切除率及较低的复发风险可显著改善患者的预后[16]。而本研究的研究对象为早期Ⅱ型食管胃交界处肿瘤患者,不仅手术治疗时未出现肿瘤远处转移,且绝大多数患者的肿瘤病灶直径≤2 cm,因此并未对研究对象进一步分层分析。
内镜微创技术、新辅助治疗、靶向治疗等治疗方法在消化道肿瘤的治疗中越来越受到重视,但是食管胃交界处肿瘤治疗方式选择一直存在较大争议[17-20]。本研究根据术后长期随访结果发现,EMR组的局部复发率及远处复发率均明显高于ESD组,这可能是因为EMR的整块切除率和完全切除率较低。国外的一项研究也发现与ESD相比,分段式EMR治疗早期胃癌的局部复发率明显较高,且术后的无病生存率也明显较低[21]。ESD是通过对病灶进行大面积剥离切除来达到治疗的目的,因此其术后的并发症发生率相对较高[22],但是出血及消化道穿孔等并发症均可以在短期内通过对症治疗解决,虽然住院时间相对延长,但是对患者的长期预后无明显影响。也有研究指出消化道穿孔或狭窄均为ESD术后常见的并发症,但是术中小心操作保证黏膜的完整性,便可以有效降低穿孔或狭窄的发生率[23-24],因此ESD不仅手术操作难度较大,对术者操作的熟练程度要求也较高。本研究也存在一定的局限性,样本量相对较小,且为单中心的研究,需要多中心、前瞻性且大样本的研究进一步验证。
4 结论
ESD治疗早期Ⅱ型食管胃交界处肿瘤相对EMR手术时间较长,术后并发症发生率较高,但是手术疗效更好,可根据患者的个体化情况选择最佳的治疗方案。
