miR-138-5p在结直肠癌中的表达及其生物学功能*
2022-11-17张艳吴昊石丽洪畅靖嘉朱剑军
张艳,吴昊,石丽洪,畅靖嘉,朱剑军
471000河南 洛阳,郑州大学附属洛阳中心医院/洛阳市中心医院 病理科(张艳);030001 太原,山西医科大学 基础医学院(吴昊、石丽洪、畅靖嘉、朱剑军)
结直肠癌是一种常见的消化系统肿瘤,其发病率和病死率分别位居所有恶性肿瘤第三位和第二 位[1]。结直肠癌的发生进展是一个多基因参与、多步骤的恶性癌变过程[2]。近年来,越来越多的文献报道微小RNAs(mircroRNAs,miRNAs)与恶性肿瘤的发生与进展密切相关[3]。miRNA是一类最小的非编码RNA,由约23个核苷酸组成[4]。miRNA通过与其靶基因mRNA的3'非翻译区(3' untranslated region,3'UTR)结合,调控靶基因转录表达[5]。截止目前,已发现约60%编码基因受miRNAs调控[3]。来自全球不同类型恶性肿瘤患者 miRNA表达谱数据结果显示,miR-138是一个典型的肿瘤抑癌因子[3]。作为一个抑癌因子,miR-138通过直接结合癌基因的mRNA序列,抑制癌蛋白表达[3]。有研究报道miR-138在多种恶性肿瘤中表达水平均呈显著下调,如肝细胞癌、胃癌、乳腺癌、肾癌等[3,6-7]。例如,miR-138在约70%肝细胞癌患者癌组织中呈低表达,其通过靶向结合SOX9或细胞周期素D3抑制肝癌细胞增殖和侵袭[7]。但是,在小胶质瘤肿瘤干细胞亚群中miR-138呈高表达,发挥促癌功能[8]。截至目前,研究者们尚未完全确定miR-138-5p在结直肠癌生长过程中的功能作用。本研究利用公共数据库分析miR-138-5p在结直肠癌中的表达水平,分别采用miRNA mimics和inhibitors升高或降低miR-138-5p表达水平,CCK-8和EdU检测结直肠癌细胞生长和增殖活性,流式细胞术检测细胞凋亡,PCR结合公共数据预测miR-138-5p靶基因,明确miR-138-5p在结直肠癌细胞恶性生长过程中的功能作用,初步探讨相关作用机制,从而为阐明结直肠癌的发病机制提供理论基础,为结直肠癌诊疗提供潜在作用靶点。
1 材料与方法
1.1 试剂
DMEM高糖培养液、胎牛血清(Hyclone公司,美国),CCK-8(碧云天公司,中国),EdU细胞增殖检测试剂盒(锐博公司,中国),Annexin-V/PI细胞凋亡检测试剂盒(贝博,中国),Lipofectamine 2000、TRIzol Reagent (Invitrogen,美国),PrimeScriptTM第一条链cDNA合成试剂盒、TB Green qPCR Premix(Takara公司,日本),miRNA第一链cDNA合成试剂盒(生工,中国)。
1.2 公共数据获取
下载癌症基因组数据库(The Cancer Genome At- las,TCGA)中结肠癌转录组数据和临床信息数据。通过limma包筛选差异表达基因。筛选差异表达基因的条件为:|logFC| > 1,P<0.01,且具有完整的临床信息及随访信息。GEO官网搜索GSE73487,下载结肠癌数据集。
1.3 细胞培养和转染
常规培养结直肠癌Ls174T细胞。用含10%胎血清的DMEM高糖培养液于37℃、5% CO2细胞培养箱中培养。将细胞接种于6孔板,24 h后,待细胞生长至对数生长期时,进行细胞转染,操作步骤参照脂质体说明书进行。本研究共分4组:mimic对照组、miR-138 mimic组、inhibitor对照组、和miR-138 inhibitor组。miR-138 mimic序列(sense 5'-3':AGCUGGUGUUGUGAAUCAGGCCCG;Antisense 5'- 3':GCCUGAUUCACAACACCAGCUUU);miR-138 inhibitor序列(5'-3':CGGCCUGAUUCACAACACCA- GCU);以上序列由通用生物公司合成。
1.4 实时荧光定量PCR(quantitative real-time PCR, qRT-PCR)
提取RNA,按照miRNA第一链cDNA合成试剂盒步骤合成cDNA,用于后续miRNA表达水平检测;按照PrimeScriptTM第一条链cDNA合成试剂盒步骤合成cDNA后,用于后续mRNA表达水平检测。采用2-△△Ct方法计算目的基因的相对表达量。miR-138-5p上游引物序列(5'-3':AGCTGGTGTTGTAATCAGGCC),下游引物为通用PCR引物,U6为内参照。NEBL、SOX4、EZH2和SOX12引物序列见表1,β-actin为内参照,以上序列由生工合成。

表1 qRT-PCR引物序列Table 1.Primer Sequences for qRT-PCR
1.5 CCK-8实验
常规接种细胞于6孔板。细胞转染6 h后将细胞接种于96孔细胞培养板,待细胞贴壁后记为0 h。分别在0 h、24 h、48 h、72 h这4个时间点检测细胞活力。CCK-8溶液孵育1 h后,于酶标仪450 nm处检测。
1.6 EdU实验
常规接种细胞于24孔板。细胞转染24 h后进行EdU细胞增殖检测实验。加入适量EdU工作液,孵育2 h。后续经多聚甲醛固定、PBS溶液冲洗、EdU反应、Hoechst染色等步骤完成实验,用倒置荧光显微镜拍照。
1.7 流式细胞术检测细胞凋亡
常规接种细胞于6孔板。细胞转染48 h后进行细胞凋亡检测实验。收集细胞,预冷PBS冲洗3次,结合缓冲液重悬、加入Annexin-V避光染色10 min,加入PI避光染色10 min,上机检测。在转染inhibitor的对照组和实验组细胞中,使用的凋亡诱导剂为5-FU(25μmol/L)。
1.8 生物信息学预测miR-138-5p靶基因
利 用TargetScan、miRDB、RNA22和picTar等4 个网站预测,预测miR-138-5p靶基因。通过Venny 2.1获取上述靶基因的交集。
1.9 统计学方法
所有数据使用Graphpad Prism 6.0软件进行统计学分析。实验数据以均数±标准差表示。两组间比较采用t检验,采用Pearson 相关系数进行相关性分析,P < 0.05为差异具有统计学意义。
2 结 果
2.1 miR-138-5p在结直肠癌组织中呈低表达
本研究利用结直肠癌GSE73487数据,分析miR-138-5p在90例结直肠癌组织中的表达水平。结果表明,与正常结直肠组织相比,miR-138-5p在结直肠癌组织中表达水平显著降低[(2.182 ± 0.068) vs (2.053 ± 0.024),P < 0.05;图1]。
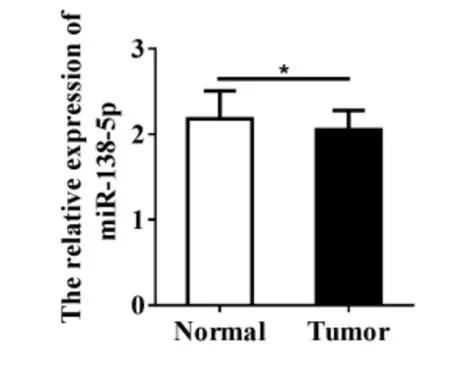
图1 miR-138-5p在结直肠癌中的表达水平Figure 1.Expression of MiR-138-5p in Colorectal Carcinoma
2.2 验证miR-138-5p mimic和miR-138-5p inhibitor效果
为了检测 miR-138-5p mimic和inhibitor升高或降低 miR-138-5p的效果,本研究采用qRT-PCR检测 miR-138-5p 表达水平,结果显示,与mimic对照组相比,miR-138-5p mimic组miR-138-5p表达水平显著升高,升高倍数为36.6 ± 0.40(P < 0.01;图2A)。与inhibitor对照组相比,miR-138-5p inhibitor组miR-138-5p表达水平显著降低,降低85.50% ± 0.32%(P < 0.01;图2B)。以上研究结果表明,miR-138-5p mimic和inhibitor能够有效升高或降低miR-138-5p水平。
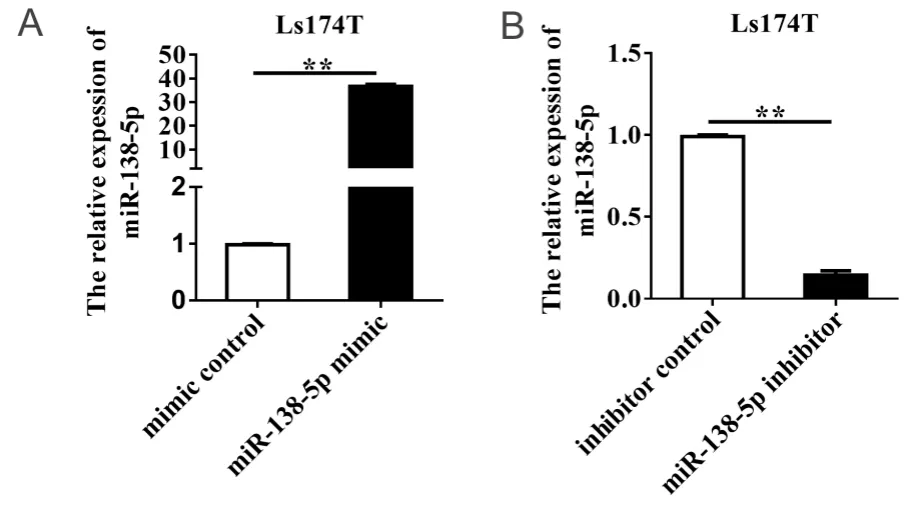
图2 转染 miR-138-5p mimic和miR-138-5p inhibitor后miR-138-5p在结直肠癌细胞中的表达Figure 2.Expression of MiR-138-5p in Colorectal Carcinoma Cells after Transfecting with MiR-138-5p Mimic or MiR-138-5p Inhibitor
2.3 miR-138-5p对结直肠癌细胞生长的影响
为了研究miR-138-5p表达水平对结直肠癌细胞活力的影响,本研究采用CCK-8检测细胞活力。结果显示:与mimic对照组相比,miR-138-5p mimic能够显著抑制细胞生长(P < 0.01;图3A);与inhibitor对照组相比,miR-138-5p inhibitor能够显著促进细胞生长(P < 0.01;图3B)。为进一步验证miR-138-5p对结直肠癌细胞增殖活性的影响,本研究采用EdU检测细胞增殖活性。结果表明:mimic对照组细胞增殖率为24.33% ± 0.64%,miR-138-5p mimic组细胞增殖率为18.90% ± 0.26%,其差异具有统计学意义(P < 0.01;图4A)。inhibitor对照组细胞增殖率为24.83% ± 0.84%,miR-138-5p inhibitor组细胞增殖率为35.13% ± 0.35%,其差异具有统计学意义(P < 0.01;图4B)。以上结果表明,miR-138-5p表达水平与结直肠癌细胞生长密切相关。
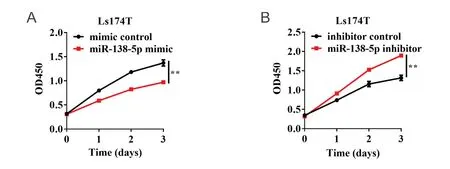
图3 miR-138-5p对结直肠癌细胞活力的影响Figure 3.Effects of MiR-138-5p on the Viability of Colorectal Carcinoma Cells
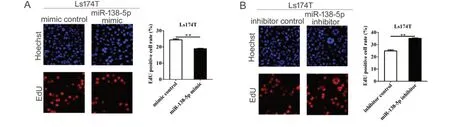
图4 miR-138-5p对结直肠癌细胞增殖的影响Figure 4.Effects of MiR-138-5p on the Proliferation of Colorectal Carcinoma Cells
2.4 miR-138-5p对结直肠癌细胞凋亡的影响
为研究miR-138-5p对结直肠癌细胞凋亡的影响,本研究通过流式细胞术检测miR-138-5p表达水平改变对结直肠癌细胞凋亡的影响。结果显示:mimic对照组细胞凋亡率为4.90% ± 0.13%,miR-138-5p mimic组细胞凋亡率为25.60% ± 1.21%,其差异具有统计学意义(P < 0.01;图5A)。在Ls174T细胞中,转染inhibitor 对照或miR-138-5p inhibitor 24 h后,加入5-FU(25 μmol/L)作用24 h,上机检测细胞凋亡情况。结果发现,inhibitor对照组细胞凋亡率为28.95% ± 0.95%,miR-138-5p inhibitor组细胞凋亡率为14.36% ± 0.54%,其差异具有统计学意义(P < 0.01;图5B)。以上结果表明,miR-138-5p表达水平与结直肠癌细胞凋亡有关。
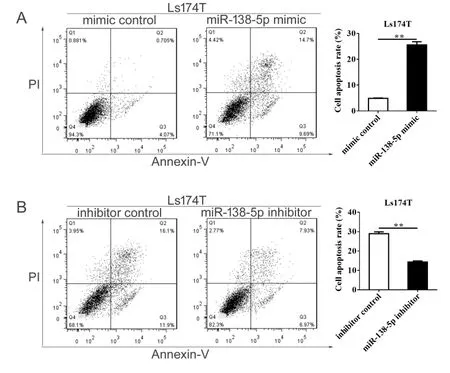
图5 miR-138-5p对结直肠癌细胞凋亡的影响Figure 5. Effects of MiR-138-5p on the Apoptosis of Colorectal Carcinoma Cells
2.5 筛选miR-138-5p下游靶基因
通 过TargetScan、miRDB、RNA22和picTar等4 个网站预测,筛选得到65个miR-138-5p靶基因(图6A)。课题组前期通过利用TCGA公共数据库,筛选获得2 954个在结直肠癌中呈差异表达的基因,与miR-138-5p下游靶基因取交集后,共筛选得到16个在结直肠癌中呈差异表达的miR-138-5p靶基因(图6B),具体信息见表2。根据miRNAs与靶基因相互作用原理,本研究重点关注在结直肠癌中呈显著高表达的靶基因,即星云状小体(nebulette,NEBL)、SRY盒 转 录 因 子4(SRY-box transcription factor 4,SOX4)、zeste2多梳抑制复合体2亚基增强子(enhancer of zeste 2 polycomb repressive complex 2 subunit,EZH2)和SRY盒 转 录 因 子12(SRY-box transcription factor 12,SOX12)。结果显示,与正常结直肠组织相比,NEBL、SOX4、EZH2和SOX12在结直肠癌组织中表达水平均显著升高(6.446± 0.042 vs 4.210±0.096;7.244±0.034 vs 5.702 ±0.078;5.191±0.026 vs 3.935±0.084;4.539± 0.045 vs 3.444±0.092;均P < 0.01)(图7A)。相关性结果显示:miR-138-5p与NEBL呈显著负相关(r = - 0.166,P < 0.01),miR-138-5p与EZH2呈显著负相关(r = - 0.162,P < 0.01);miR-138-5p与SOX4和SOX12相关性无统计学意义(P = 0.06;P = 0.32)(图7B)。
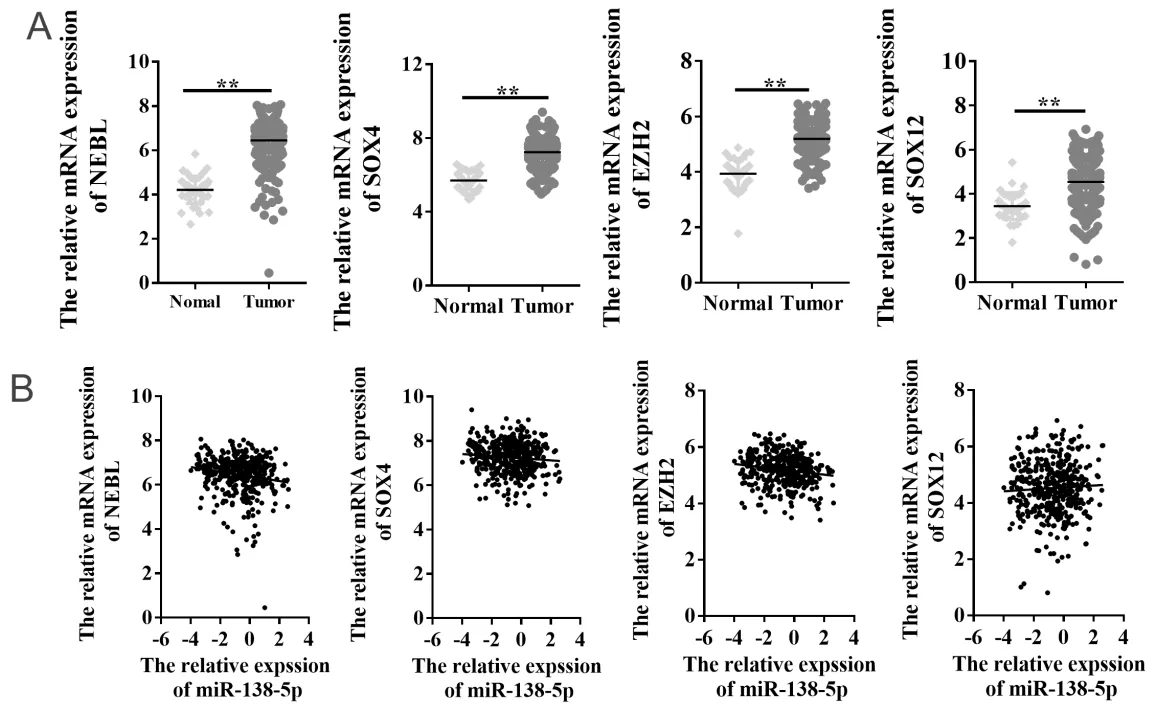
图7 miR-138-5p靶基因的表达水平及相关性分析 Figure 7.Expression of Targets Genes of MiR-138-5 and Its Correlation Analysis
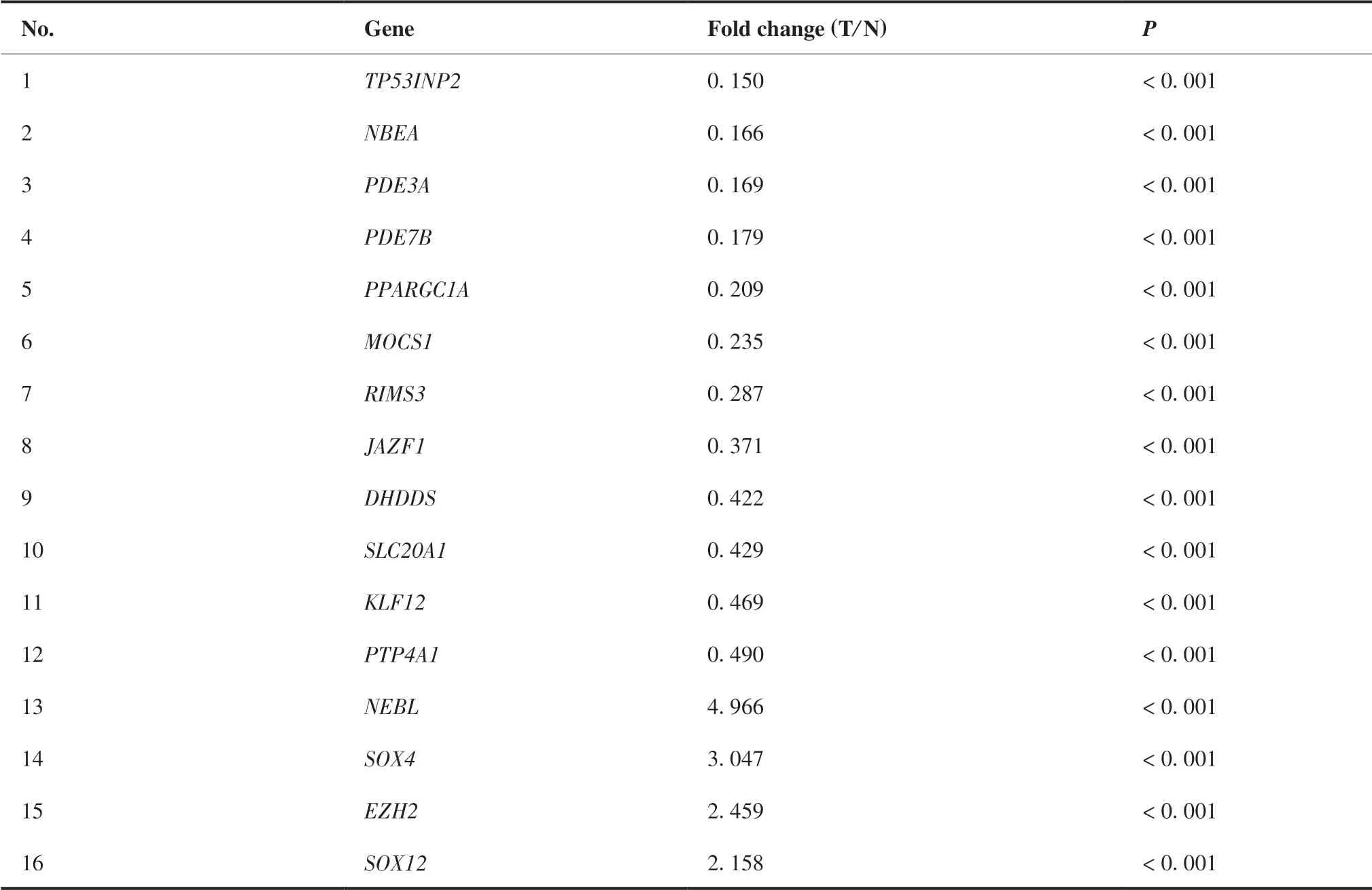
表2 结直肠癌中miR-138-5p靶基因的表达水平 Table 2.Expression of Targets Genes of MiR-138-5p in Colorectal Carcinoma
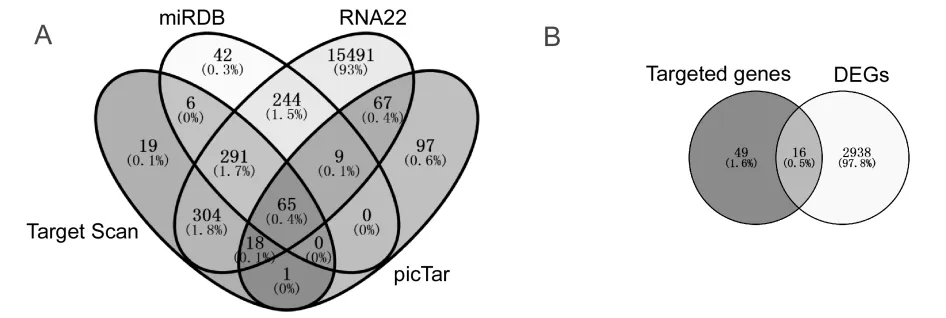
图6 筛选miR-138-5p靶基因 Figure 6. Screening of Target Genes of MiR-138-5p
2.6 miR-138-5p靶向调控NEBL和EZH2
为进一步验证miR-138-5对靶基因的调控作用,本研究通过qRT-PCR验证靶基因表达水平是否随miR-138-5表达水平改变而改变。结果显示,在Ls174T细胞中,与mimic对照组相比,miR-138-5p mimic组NEBL和EZH2表达水平显著降低,降低率分别为62.00% ± 0.60%、57.50%±0.65%,其差异均具有统计学意义(均P < 0.05;图8A)。与inhibitor对 照 组 相 比,miR-138-5p inhibitor组NEBL和EZH2表达水平升高,升高倍数分别为3.10±0.22、2.21±0.22,差异均具有统计学意义(均P < 0.05;图8B)。上述研究结果表明,NEBL和EZH2可能是miR-138-5p的下游靶基因。
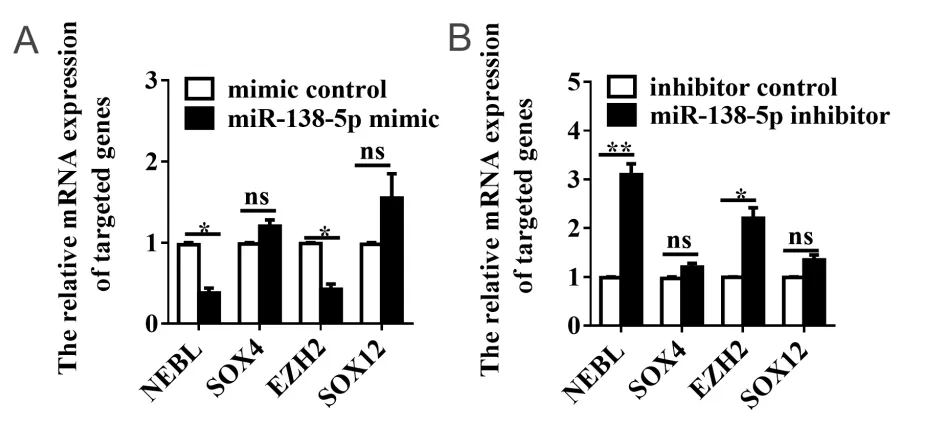
图8 miR-138-5p调控NEBL和EZH2表达水平 Figure 8. MiR-138-5p Regulates the Expression of NEBL and EZH2
3 讨 论
结直肠癌是一种常见的消化系统肿瘤,2020年全球新增结直肠癌190万余例,新增死亡93万余例,其发病率和死亡率分别居所有恶性肿瘤第三位和第二位[1]。miRNAs通过靶向调控目的基因促进肿瘤发生进展[3]。已有研究证实,miR-138-5p在胃癌、卵巢癌、食管鳞癌、胰腺癌和结直肠癌等多种恶性肿瘤中呈低表达。例如,miR-138在胃癌组织和胃癌细胞系中呈低表达,且miR-138表达水平与TNM分期和淋巴结转移等相关[6]。Ding等[9]报道,miR-138-5p在卵巢癌中呈低表达。在食管鳞状细胞癌患者癌组织和血浆中均发现miR-138水平显著降低,且miR-138表达水平与T分期、淋巴结转移和TNM分期等临床病理特征有关[10]。低表达miR-138食管鳞癌患者5年总生存期显著缩短,高度提示miR-138表达水平降低是食管鳞癌一个独立预后危险因素[10]。miR-138-5p在胰腺癌中表达水平显著降低[11]。已有研究报道,miR-138-5p 在结直肠癌中表达水平降低[12-14]。miR-138表达水平与肿瘤分化程度、淋巴结转移、远处转移和TNM分期有关[13]。与低表达miR-138组患者相比,高表达miR-138组结直肠癌患者生存期显著延 长[13]。与上述研究结果一致,本研究发现miR-138-5p在结直肠癌中表达水平显著降低,提示miR-138可能参与结直肠癌发生与进展。
miR-138参与调控肿瘤细胞生长、凋亡、迁移、侵袭和血管形成等生物学过程。例如,过表达miR-138后,胃癌细胞增殖活性、克隆形成能力,迁移和侵袭活性均显著降低。体内实验进一步证实过表达miR-138抑制肿瘤生长[6]。在卵巢癌中发现,抑制miR-138能够显著促进卵巢癌细胞生长、克隆形成能力、和迁移[9]。过表达miR-138能够显著抑制肾癌细胞增殖和迁移[15]。Xu等[16]研究结果也表明,过表达miR-138抑制结直肠癌细胞增殖和转移。miR-138-5p抑制结直肠癌细胞迁移,负向调控结直肠癌细胞化疗耐药性[12]。本研究发现,miR-138-5p抑制结直肠癌细胞增殖、促进细胞凋亡,最终抑制结直肠癌细胞生长;抑制miR-138-5p能够显著促进结直肠癌细胞生长。此外,抑制miR-138-5p能够显著抑制结直肠癌化疗药物5-FU诱导的细胞凋亡,提示miR-138-5p下调可能是结直肠癌化疗耐药的潜在影响因素。
与其他miRNA类似,miR-138-5p亦通过与靶基因结合,导致靶基因降解,参与恶性肿瘤细胞发生与进展。Wang等[6]报道,miR-138通过靶向调控表皮生长因子受体表达水平,抑制胃癌细胞增殖和迁移。有文献报道,转录因子NFIB是miR-138-5p的靶基因,miR-138-5p通过特异性靶向结合NFIB,调节Snail转录表达,调控结直肠癌细胞迁移[12]。在结直肠癌细胞中,PODXL是miR-138的靶基因,过表达PODXL能够显著逆转miR-138介导的抑癌作 用[16]。本研究通过利用TargetScan、miRDB、RNA22和picTar等4个网站,结合课题组前期筛选的结直肠癌差异表达基因和实验验证,预测NEBL和EZH2可能是miR-138-5p的下游靶基因,但这一结论有待进一步实验证实。
综上所述,miR-138-5p在结直肠癌中呈低表达。过表达miR-138-5p后,结直肠癌细胞增殖活性减弱,细胞凋亡增多;抑制miR-138-5p后,结直肠癌细胞增殖活性增强。机制研究表明,miR-138-5p可能通过靶向NEBL和EZH2,调控结直肠癌恶性生长。但是miR-138-5p是否特异性靶向调控NEBL和EZH2,NEBL和EZH2等信号分子在miR-138-5p介导的结直肠癌细胞生长过程中发挥怎样的作用,这些问题有待进一步探讨。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
