添加IGF-1 对体外培养不同直径猪卵泡中卵母细胞成熟率的影响
2022-11-17刘子嶷李凯扬李文韬周祖阳孙小勇刘玉芳
刘子嶷,李凯扬,王 鹏,李文韬,周祖阳,孙小勇,刘玉芳*
(1.河北工程大学生命科学与食品工程学院,河北邯郸 056001;2.北京市畜牧总站,北京 100107;3.北京大学医学部实验动物科学部,北京 100191)
猪作为常见实验动物模型,具有高繁殖潜力和维护成本低的特点[1]。卵母细胞体外成熟培养(IVM)作为产生猪胚胎的方式之一在生物医学和农业应用中越来越重要[2-4]。IVM 通过判断第一极体排出作为筛选成熟卵母细胞的主要标志[5]。此外,卵母细胞的发育离不开卵丘细胞,卵丘细胞在卵母细胞生长和成熟过程不断提供营养,并介导激素对卵丘-卵母细胞复合体(COCs)产生影响[6-7]。卵丘扩张在卵母细胞成熟过程中也起着重要作用,卵丘越扩张说明卵母细胞发育潜力越大[8]。卵母细胞成熟过程中胞核和胞质的变化是显示卵母细胞发育能力的关键,卵母细胞内谷胱甘肽(GSH)含量也被用作细胞质成熟的指标,较高的GSH 水平与原核形成呈正相关[9-10]。以往研究者进行了大量试验来提高猪卵母细胞体外成熟率,如在成熟培养液中添加不同成分以促进其发育成熟[4,11-13]。
研究发现,胰岛素和胰岛素样生长因子(IGFs)等多肽生长因子参与卵巢的生理功能,发挥积极作用[14-15]。胰岛素样生长因子-1(IGF-1)是一种结构和功能上与胰岛素密切相关的单链血清肽[16],可促进细胞增殖、芳香化酶活性和孕酮生物合成[17]。研究发现IGF-1 可由猪卵泡和颗粒细胞释放,培养基中添加IGF-1 可刺激猪卵母细胞的减数分裂和体外成熟[18]。研究证明,在猪卵母细胞体外成熟培养液中添加不同浓度IGF-1(10~80 ng/mL)均可以促进细胞核成熟[19]。另有研究报道,较大直径卵泡内的卵母细胞体外成熟率较高,且能提供较好的体外胚胎[20]。为深入了解IGF-1 对猪卵母细胞体外培养成熟率的影响,本研究评估了IGF-1对猪不同直径卵泡中卵母细胞IVM 的影响,并检测了卵母细胞中谷胱甘肽(GSH)和活性氧(ROS)含量,以期探究添加外源IGF-1 对3 种直径卵泡卵母细胞成熟的影响。
1 材料与方法
1.1 主要试剂及培养液的配置
1.1.1 主要试剂 氯化钠(NaCl)、牛血清白蛋白(BSA)、4-羟乙基哌嗪乙磺酸(Hepes)、碳酸氢钠(NaHCO3)、葡萄糖(D-Glucose)、聚乙烯醇(PVA)、卵泡刺激素(FSH)、促黄体生成素(LH)、丙酮酸钠(Na-Pyruvate)青霉素、链霉素均购自Sigma 公司(美国),表皮细胞生长因子(EGF)、IGF-1 均购自Novoprotein 公司(上海),透明质酸酶、石蜡油、多聚甲醛均购自Solarbio公司(北京),Medium 199 购自Gibco 公司(美国),Hochest 33342 购自Invitrogen 公司(美国)。
1.1.2 培养液的配置 洗卵液:3.3315 g NaCl+1.5 g BSA+1.1915 g Hepes+0.084 g NaHCO3,彻底溶解于灭菌纯化水。
成熟培养基础液:0.015 g NaHCO3+0.0275 gDGlucose+0.005 g Na-Pyruvate+0.05 g PVA+0.033 g 青霉素+0.025g 链霉素,彻底溶解于50 mL Medium199。
成熟培养工作液:基础液+4.4 μL FSH+4.4 μL LH+4 μL EGF+400 μL 猪卵泡液。
将配好的成熟培养工作液过滤后加入到四孔板中,每孔700 μL,覆盖石蜡油。置于39℃,5% CO2,饱和湿度的培养箱平衡2 h。100 μL 成熟培养工作液制作洗滴并用石蜡油覆盖,放培养箱平衡2 h。每个滴20~30个COCs,每个孔50 个COCs。
1.2 卵巢采集及处理 于屠宰场收集猪卵巢置于保温桶中,浸泡于30~38℃含双抗(青、链霉素)的灭菌生理盐水中,4 h 内送回实验室。用加入双抗的37℃生理盐水冲洗卵巢3~5 次,剪去卵巢上多余的结缔组织。
1.3 卵母细胞收集 按照卵泡直径分别收集2~3、3~5 mm和5~8 mm 3 组COCs,用注射器分别抽取卵泡液置于灭菌离心管中,37℃静置15 min 至细胞沉淀,用抽卵针在显微镜下按照分组分别挑出胞质完整均匀且卵丘在3~5 层的COCs,用洗卵液洗3 遍。
1.4 卵母细胞成熟培养 挑选符合要求的COCs 在预热的洗滴中洗3 遍,最后转入四孔板中。在39℃,5%CO2,饱和湿度下体外培养卵母细胞成熟,48 h 后统计卵丘扩散率。再将细胞移至0.2%透明质酸酶中脱去卵丘细胞,裸卵用4%多聚甲醛固定1 h 后PBS 洗3 遍,用Hochest 33342 避光染色5 min,再用PBS 洗3 次后,显微镜下观察统计第一极体的排出率。
1.5 实验设计
1.5.1 IGF-1 对卵母细胞成熟的影响 在成熟培养工作液的基础上+30 ng/mL IGF-1 进行体外培养,设置对照组,统计其卵丘扩展率和第一极体排出率,判定添加IGF-1 能否影响猪卵母细胞成熟率。
1.5.2 IGF-1 对不同直径卵母细胞成熟的影响 根据不同直径卵泡(2~3、3~5 mm 和5~8 mm)进行分组,分别添加IGF-1 的成熟培养工作液进行体外培养,统计其卵丘扩展率和第一极体排出率,判定IGF-1 是否影响不同直径卵泡卵母细胞的成熟。
1.6 卵母细胞中GSH 的检测 在成熟培养的44 h 取COCs,用0.2% 透明质酸酶去除卵丘细胞,采用碧云天试剂盒S0052(碧云天生物技术有限公司,北京)对卵母细胞中GSH 的含量进行检测。每组30 枚卵母细胞移入新鲜配制的10 μL 蛋白去除试剂M 中,在液氮和37℃水浴锅中反复冻融3 次,使用酶标仪进行标准品与样品吸光值的检测。采用动力学测定法绘制标准曲线:取某一浓度GSH 的标准样品与GSH 检测工作液混合,测定405 nm 处样品吸光值。以不同GSH 标准浓度为横坐标x,以与其对应浓度下OD412 吸光值为纵坐标y,绘制标准曲线,据曲线方程计算卵母细胞中GSH 含量。所有实验重复3 次,显示的数值为平均值±标准误。
1.7 卵母细胞中ROS 的检测 在成熟培养的44 h 后取COCs,用0.2%透明质酸酶去除卵丘细胞,根据碧云天S0033 试剂盒(碧云天生物技术有限公司,北京)说明,按照1:1000 用无血清培养液稀释DCFH-DA,使终浓度为10 mol/L。将卵母细胞悬浮于稀释好的DCFH-DA 中,置于37℃细胞培养箱内孵育20 min。每隔5 min 颠倒混匀一下,使探针和细胞充分接触。用无血清细胞培养液洗涤细胞3 次,以充分去除未进入细胞内的DCFH-DA。直接用ROS 阳性对照刺激细胞30 min。使用488 nm激发波长,525 nm 发射波长,检测刺激前后荧光的强弱,用Image J 进行分析。所有实验重复3 次,显示的数值为平均值±标准误
1.8 统计分析 所得数据用SPSS 软件通过卡方检验进行差异显著性检验,使用LSD 法和Duncan's 法进行多重比较。结果以平均值± 标准误表示,P>0.05 为差异不显著,P<0.05 为差异显著。
2 结果与分析
2.1 卵母细胞体外成熟培养 经过44 h 体外成熟培养,大部分COCs 扩展面积明显增大(图1)。在IVM 前形态较好的卵母细胞,其周围卵丘细胞排列紧密,整个卵母细胞被卵丘细胞完全包裹。IVM 过程中COCs 逐步伸展,卵丘细胞之间的间隙变大,卵母细胞中央生发泡发生破裂,IVM 后44 h COCs 变得更加舒展,用0.2%透明质酸酶处理后得到卵母细胞,用显微镜观察到卵母细胞卵周间隙中第一极体(PbI)的排出(图2)。

图1 3~5 层卵丘的COC(左)与培养44 h 卵丘扩展的COC(右)

图2 卵母细胞第一极体排出
2.2 IGF-1 对卵母细胞体外成熟的影响 COC 体外成熟培养44 h 后,观察到卵丘层大部分扩展且面积变为初始5 倍左右大小,可说明该COC 整体扩展效果较好[21]。结果发现,添加IGF-1 组COC 扩展数为356 个,扩展率为92.0%;对照组有295 个扩展,扩展率为87.5%,添加组的扩展率高于对照组(P<0.05)。从第一极体排出情况来看,添加组排出数为152,对照组排出数为108,添加IGF-1 和对照组的第一极体排出率分别为39.3%和32.0%(P<0.05)(表1)。
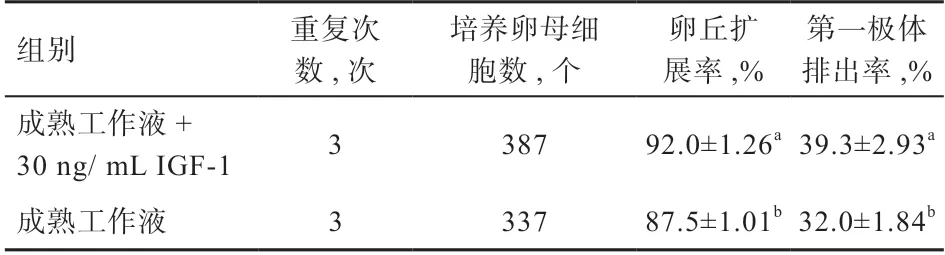
表1 添加IGF-1 进行卵母细胞体外培养的卵丘扩展数和第一极体排出数
2.3 IGF-1 对猪不同直径卵泡中卵母细胞成熟的影响添加IGF-1 成熟培养组中卵丘细胞扩展率为3~5 mm 组>5~8 mm 组>2~3 mm 组(P>0.05),第一极体排出率为3~5mm 组>5~8 mm 组>2~3 mm 组(P<0.05)(表2)。
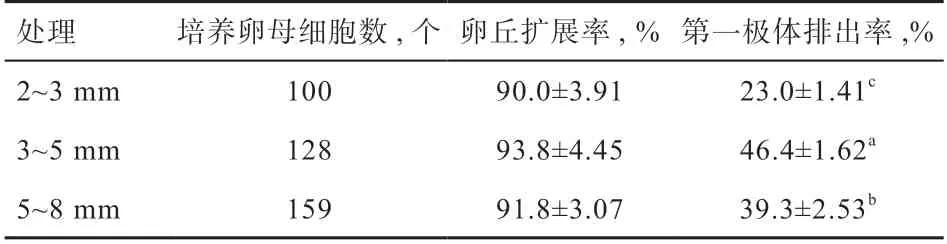
表2 猪不同直径卵泡卵母细胞体外培养中添加IGF-1卵丘扩展率和第一极体排出率
将337 个未添加外源IGF-1 的COC 也分别按照3种卵泡直径进行体外成熟培养,设置为对照组,结果如表3 所示,5~8 mm 组卵丘扩展率最高(89.9%),其次是3~5 mm 组(89.3%),2~3 mm 组最低(82.1%)且与上述2 组间差异显著,但3~5 mm 和5~8 mm 差异不显著。5~8 mm 组第一极体排出率最高(40.8%),其次是3~5 mm 组(34.5%),最低是2~3 mm 组(18.9%),3 组间差异显著。添加组3~5 mm 的卵丘扩展率和第一极体排出率为最高。
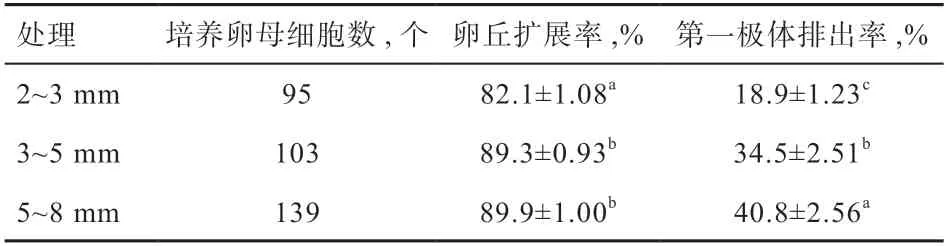
表3 猪不同直径卵泡卵母细胞体外培养中未添加IGF-1卵丘扩展率和第一极体排出率
2.4 GSH 含量检测 按照总谷胱甘肽试剂盒说明书操作,先用GSH 标准品绘制标准曲线(图3),以总谷胱甘肽标准品含量为横坐标x,405 nm 吸光值为纵坐标y,绘制标准曲线,得出方程y=0.1354x+0.1195,其中R2=0.998 7~0.990 0,吻合程度较高。

图3 GSH 标准曲线
如表4 所示,与对照组相比,添加IGF-1 组GSH含量较高(P<0.05)。由表5 可知,添加IGF-1 组中各直径卵母细胞GSH 含量为5~8 mm 组与3~5 mm 组显著高于2~3 mm 组,前2 组间无显著差异。
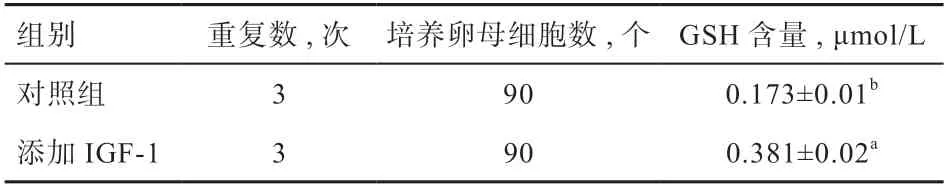
表4 添加IGF-1 和对照组卵母细胞体外成熟培养44 h 测定GSH 含量

表5 猪不同直径卵泡卵母细胞体外成熟培养液添加IGF-1 的GSH 含量
由表6 可知,未添加IGF-1 组中,3 种直径卵泡来源卵母细胞在培养44 h 后GSH 含量差异不显著。

表6 猪不同直径卵泡卵母细胞体外成熟培养液未添加IGF-1 的GSH 含量
2.5 卵母细胞ROS 的检测 如表7 所示,在添加IGF-1组中,5~8 mm 卵泡卵母细胞体外培养,其ROS 平均荧光强度为0.201,而2~3 mm 的荧光强度最高为0.376。3~5 mm 和5~8 mm 组间差异不显著,但与2~3 mm 组差异显著。如表8 所示,3 种直径卵泡来源卵母细胞在培养44 h 后ROS 荧光强度差异不显著。

表7 猪不同直径卵泡中卵母细胞体外成熟培养液添加IGF-1 的ROS 荧光强度

表8 猪不同直径卵泡中卵母细胞体外成熟培养液未添加IGF-1 的ROS 荧光强度
3 讨 论
生长因子在卵母细胞成熟和卵泡发育过程中起重要作用,它们可能是促进卵泡内卵母细胞成熟的决定性因素[22]。IGF-1 在体内协同促性腺激素,类固醇激素和其他的分子调节卵泡发育,同时IGF-1 也能促进卵母细胞体外核成熟,这一结果有助于诠释调节卵母细胞体外成熟的因子的作用机制[23]。Sato 等[24]证实了添加IGF-1对犬卵母细胞成熟率和卵丘扩张有积极的影响,但是需要较高水平的IGF-1(50 μg/mL)。在牛卵母细胞发育相关研究中发现,IGF-1(100 ng/mL)已被证明能刺激牛卵母细胞的卵丘扩张和核成熟[25]。卵丘扩张是反映卵母细胞成熟以及随后的发育能力的一个指标[26]。本研究通过对第一极体排出、GSH 含量测定分析,发现添加IGF-1 后对猪卵母细胞体外成熟率显著优于未添加组,表明添加IGF-1 可以促进猪卵母细胞体外成熟。
在哺乳动物的研究中,卵泡大小对卵母细胞成熟、排卵及人工授精具有重要意义[27]。目前,用于体外胚胎研究的卵母细胞通常取自直径3~6 mm 卵泡,但卵巢中存在大量直径小于3 mm 的卵泡[28]。为获得小于3 mm 卵泡卵母细胞体外成熟情况,Yoon 等[29]研究发现直径小于3 mm 的猪卵泡卵母细胞体外发育能力明显弱于直径大于3 mm 的卵泡。本研究统计了添加IGF-1 体外成熟44 h 后不同直径的成熟率,发现直径为3~5 mm的COCs 卵丘扩展率显著比2~3 mm 和5~8 mm 高,第一极体排出率最高为3~5 mm(46.9%),证明添加外源IGF-1 后3~5 mm 卵泡卵母细胞成熟率较高。
卵母细胞生长发育过程中活性氧的产生会导致DNA损伤和线粒体功能障碍,影响卵母细胞的发育[30-31]。而在IVM 过程中,ROS 产生量比体内成熟的产生量多,过多的ROS 会使卵母细胞退化,影响成熟效率,而GSH 可保护细胞免受ROS 损害[32]。GSH 在卵母细胞体外成熟过程中协助卵母细胞抵抗氧压力,参与氨基酸转运,为蛋白合成提供原料,保障DNA 和蛋白合成所需的能量、协助微管合成,影响纺锤体的形态,在卵母细胞中起到重要作用[33]。因此,卵母细胞内GSH 含量也是衡量卵母细胞成熟质量的关键指标[34]。本研究中添加组5~8mm 卵泡COCs 中GSH 含量最高,但仅与2~3 mm 组差异显著,而未添加组的3 种直径间差异不显著。检测ROS 结果可知,添加组5~8 mm 平均荧光强度最低,而2~3 mm 的荧光强度最高,5~8 mm 与2~3 mm 组差异显著,但与3~5 mm 差异不显著。未添加组中三种直径间ROS 差异不显著。
4 小 结
综上所述,经过对猪不同直径卵泡中COCs 44 h 体外成熟培养,比较卵丘扩展、第一极体、GSH 和ROS含量来看,添加IGF-1 使3~5 mm 卵泡卵丘扩展率和第一极体排出率增高。同时添加组3~5 mm 和5~8 mm 中GSH 显著降低了卵母细胞ROS 水平,改善卵母细胞氧化还原状态。
