葡萄籽原花青素对多浪羊精液常温保存效果的研究
2022-11-17吴启辉王惠娥
郝 文,晏 航,吴启辉,王惠娥,2*
(1.塔里木大学动物科学与技术学院,新疆阿拉尔 843300;2.新疆生产建设兵团塔里木畜牧科技重点实验室,新疆阿拉尔 843300)
近年来,人工授精技术在生产中广泛应用。由于绵羊精子自身结构的原因,低温、冷冻保存可能会影响绵羊精子获能、代谢及精子顶体蛋白酶活性等,同时,绵羊子宫颈形态特征的特殊性以及冻精输精条件等在野外的不可行[1-2]使得绵羊精液常温保存备受畜牧工作者的喜爱。
精液在处理和保存过程中会进行代谢,由于体内外环境的改变,精子作为一个需氧系统会产生活性氧(ROS),适量的ROS 对调节精子正常生理功能、结合透明带能力的提升等是必要的[3]。过多的ROS 会损害精子质膜和顶体,甚至会导致精子DNA 受损,进而影响精子在体外的存活时间和受精能力[4]。葡萄籽原花青素(GSPs)是一种生物类黄酮,具有超强的抗氧化剂活性,具有清除自由基和延缓衰老的效果。李春阳等[5]研究发现,随着提取纯度提高,GSPs 抗氧化和清除自由基的能力相应提升。胡亚美等[6]研究发现,GSPs可延长猪精液常温保存时间。孙艳青等[7]研究发现,GSPs 可显著提高猪精液冷冻解冻后精子的品质和抗氧化能力。本实验在多浪羊精液常温保存稀释液中添加不同浓度GSPs,在保存过程中检测总抗氧化能力(T-AOC)和丙二醛(MDA),旨在筛选出适宜的GSPs 添加浓度,为多浪羊精液常温保存稀释液的研究提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 精液来源 本实验用精液采自塔里木大学动物科学学院实验基地3 头健康的18 月龄多浪羊。
1.1.2 试剂 葡萄籽原花青素,纯度≥95%(上海源叶生物科技有限公司[2])、三羟甲基氨基甲烷(Tris,天津市瑞金特化学品有限公司)、乳糖(百瑞金生物科技有限公司)、柠檬酸(西安灞桥区化学试剂厂)、T-AOC和MDA 测定试剂盒(南京建成生物工程研究所)。
1.1.3 精液稀释液的配制 基础稀释液:称取Tris 2.42 g,柠檬酸1.68 g,乳糖0.5 g,用电子天平准确称量后溶解于100 mL 灭菌超纯水中,充分混匀,配置成基础稀释液。每100 mL 基础稀释液中分别添加0、1、3、5、7、9、12、14 mg GSPs,充分溶解后得到GSPs 质量浓度分别为0、0.01、0.03、0.05、0.07、0.09、0.12、0.14 g/L的多浪羊精液稀释液,置于4℃冰箱中保存待用。
1.2 试验方法
1.2.1 精液采集及处理 用电刺激法采集多浪羊公羊精液,装入37℃保温桶,快速带回实验室。选取采精量大于0.5 mL,色泽和气味正常的精液,在400×显微镜下对精液样品进行观察,选择精子活力在0.8 以上的精液用于后续试验。将3 份合格的精液混匀,使用2.5 mL离心管每管分装200 µL 精液,后将精液按照二次稀释法进行等温稀释,即先加入1 mL 不同浓度的GSPs 稀释液,平衡10 min 后再添加剩余体积的稀释液(总稀释比为1:10)。测定稀释后精液的活力,活力达到0.7以上的置于18℃恒温箱中保存,为防止精液发生沉淀和发生精子凝集现象,每隔8 h 翻动离心管1 次。
1.2.2 精子活率和活力的检测 精子活力评定采用主观评定法进行测定,分10 级制表示。即按精子直线运动占视野中精子的估计百分比来表示(如:100%前进者为1.0,90% 即为0.9,以此类推)。每隔24 h 从离心管中吸取20 µL 精液,用预热的18℃的0.9%生理盐水再次稀释5 倍,置于37℃水浴锅孵育2 min 后,然后吸取10 μL 精液滴于37℃预热的载玻片上,于400×光学显微镜下对精子进行观察,运动精子占总精子数的比例即为精子的活力[8]。精子死亡率评定采用苯胺黑-伊红双染的方法[9],活率=(总精子数-染红色精子数)/总精子数。
1.2.3 精子顶体完整率、质膜破损率和畸形率检测 采用吉姆萨染色法进行畸形率检测[10];采用精子尾部低渗试验进行质膜完整率检测;利用花生凝集素荧光染色法检测精子顶体完整性[6]。
1.2.4 精子生理参数检测 精液中T-AOC 和MDA 指标测定按照南京建成公司提供的试剂盒检测,检测方法严格按照试剂盒说明书操作。
1.3 统计分析 试验数据均使用GraphPad Prism 5.0 软件进行方差分析(One-way ANOVA)、LSD 和Duncan's多重比较,分析组间差异显著性。每个处理重复3 次,数据用平均值± 标准差表示。P<0.05 表示差异显著,P>0.05 表示差异不显著。
2 结果与分析
2.1 不同浓度GSPs 对多浪羊精子活率的影响 由表1可知,在常温保存下多浪羊精子活率随着GSPs 添加浓度的增大,呈现逐渐递增后递减的趋势。在保存24 h内各组间差异不显著;保存48~240 h,添加浓度为0.09、0.12 和0.14 g/L 组的精子活率较其他添加组和对照组均显著提高;168~ 240 h,GSPs 添加质量浓度为0.09 g/L组精子活率差异显著于其他各组,0.01 g/L 和0.03 g/L组间无差异,0.05 g/L 和0.07 g/L 组间无差异,0.12 g/L和0.14 g/L 组间无差异,但相对于对照组精子活率均不同程度的提高。

表1 常温保存(18℃)下不同质量浓度GSPs 对多浪羊精子活率的影响 %
2.2 不同浓度GSPs 对多浪羊精子活力的影响 由表2 可知,常温保存24~168 h,与对照组相比,添加GSPs 组的精子活力均提高,随着添加浓度的增加,呈先递增后递减的趋势。不同处理组的保存时间不同(以精子活力保持在60%以上计算),0.09 g/L GSPs 组维持时间为144 h,0.12、0.14 g/L GSPs 组为120 h,0.03、0.05 g/L GSPs 组为96 h,对照组和0.01 g/L GSPs 组为72 h,说明添加GSPs 可延长精子保存时间。保存时间在24~96 h,0.09、0.12 g/L GSPs 组多浪羊精子活力高于其他添加组和对照组(P<0.05);保存时间192~ 240 h,对照组和0.01、0.03 g/L GSPs 组的精子活力差异不显著。

表2 常温保存(18℃)下不同质量浓度GSPs 对多浪羊精子活力的影响 %
2.3 不同浓度GSPs 对多浪羊精子畸形率的影响 由表3 可知,多浪羊精子常温保存时间24 h,除0.01 g/L GSPs 组外,其他添加组精子畸形率显著低于对照组;常温保存时间120 h,0.09 g/L GSPs 组精子畸形率相对较低,保持在20%以内。
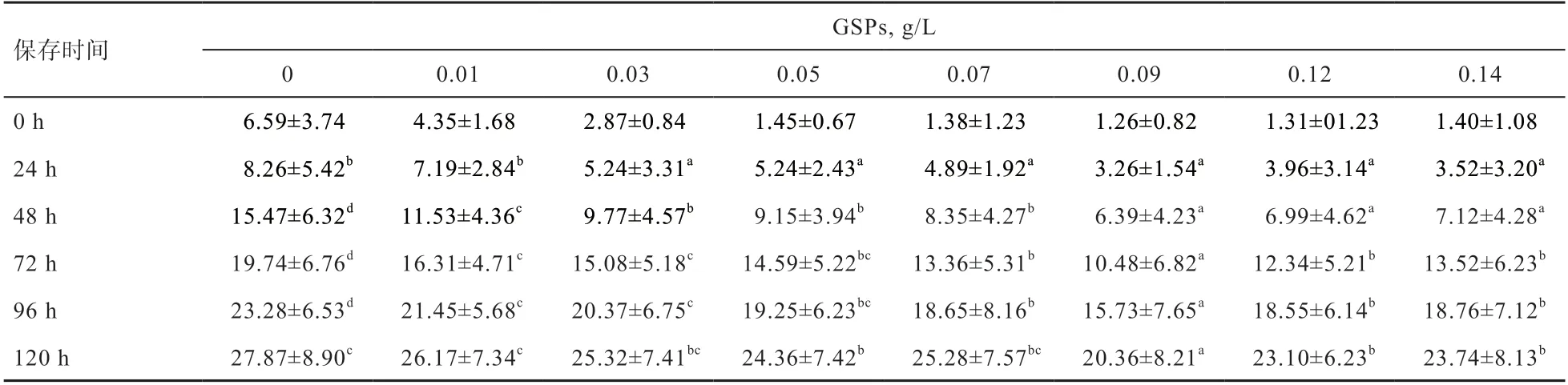
表3 常温保存(18℃)下不同浓度GSPs 对多浪羊精子畸形率的影响 %
2.4 不同浓度GSPs 对多浪羊精子质膜破损率的影响由表4 可知,多浪羊精子在常温保存下添加GSPs 对精子质膜有明显保护作用,随着GSPs 质量浓度增大,各试验组多浪羊精子质膜破损率呈先递减后递增的趋势。当保存120 h 时,0.09 g/L GSPs 组的精子质膜破损率最小(P<0.05),为30.75%。

表4 常温保存(18℃)下不同浓度GSPs 对多浪羊精子质膜破损率的影响 %
2.5 不同浓度GSPs 对多浪羊精子顶体完整性的影响由表5 可知,常温保存24 h,添加GSPs 对多浪羊精子顶体完整性试验组与对照组比较差异不显著,但在常温保存48~120 h,各试验组与对照组的精子顶体完整性差异明显,GSPs 质量浓度为0.09 g/L 多浪羊精子顶体完整性为67.4%,显著高于其他各试验组和对照组(P<0.05)。

表5 常温保存(18℃)下不同浓度GSPs 对多浪羊精子顶体完整性的影响 %
2.6 不同浓度GSPs 对多浪羊精液T-AOC 及MDA 活性的影响 由表6 可知,随着GSPs 质量浓度的增加,常温保存多浪羊精液中T-AOC 活性先增后减的趋势,而多浪羊精液中MDA 含量与T-AOC 的变化趋势相反;随着保存时间的延长,添加GSPs 组T-AOC 呈下降趋势,而MDA 呈上升趋势。在保存120 h 时,0.09、0.12 g/L GSPs 组T-AOC 活性为2.12、2.11 U/mL,显著高于其他组,而MDA 为1.90、1.92 nmol/mL,显著低于其他组。
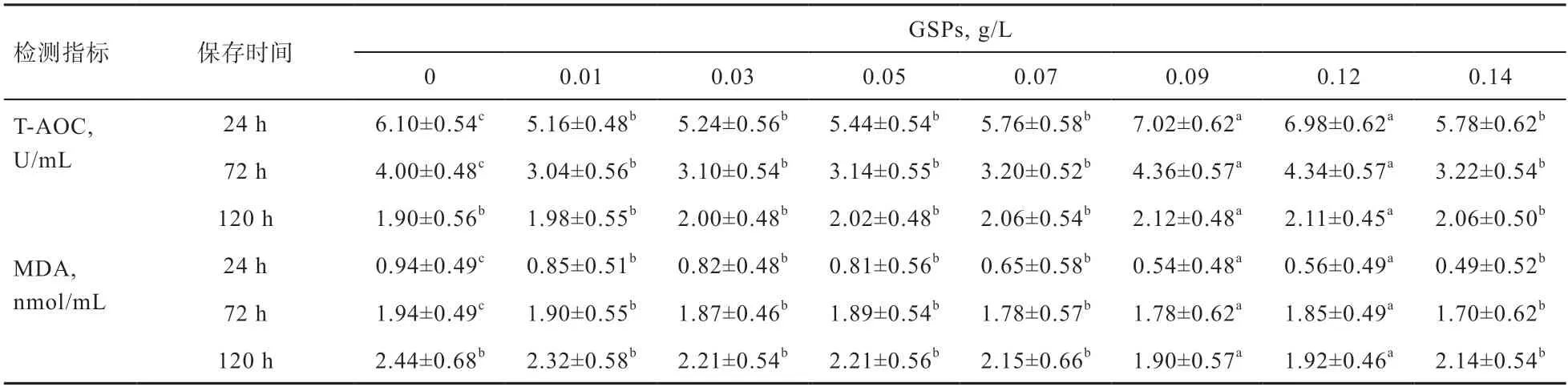
表6 不同质量浓度GSPs 对常温保存(18℃)多浪羊精液中T-AOC 活性和MDA 含量的影响 %
3 讨 论
GSPs 是葡萄多酚类化合物的重要组成部分,其抗氧化和自由基清除能力可能与所处的溶剂环境有关[11]。孙芸等[12]研究发现,水相体系中的原花青素分子中单位酚羟基的活性随着聚合度的增加而下降。当多浪羊精液稀释液在18℃恒温条件下保存时,精子的耗能和代谢活动仍在缓慢发生,并且随着保存时间的逐渐增长活性氧自由基含量也不断增加,其一旦过量则会发生氧化应激,从而损伤精子细胞膜脂质结构,加速精子死亡[13]。同时,活性氧(ROS)也会攻击顶体膜,使顶体酶提前释放而不能进行顶体反应,降低受精率,严重影响精子保存质量[14-16]。生物膜中脂质部分包含大量不饱和脂肪酸,ROS 攻击不饱和脂肪酸,促进氧化或过氧化,生成脂质过氧化物,并降解成MDA[14-16]。
3.1 不同浓度GSPs 对精液的影响 李方舟等[17]在山羊精液低温保存中添加葡萄籽花青素的浓度为30 mg/L 最佳。张柳明等[18]发现,在湖羊精液常温保存基础稀释液中添加花青素0.01 g/L 对精液的保存效果较好。相关研究资料表明,添加抗氧化剂均能改善羊精液品质,提高繁殖效率[2,19-20]。但是在上述研究中所需添加GSPs浓度各有不同,第一,基础稀释液成分不同,孙芸等[12]研究发现,原花青素的抗氧化和自由基清除能力可能与所处的溶剂环境有关。本试验中,精液稀释液主要为Tris+柠檬酸+果糖组合,张柳明等[18]所用基础稀释液为Tris+柠檬酸+果糖组合,李方舟等[17]所用基础稀释液为葡萄糖+D-果糖+PVA+EDTA+柠檬酸钠+碳酸氢钠+青霉素+链霉素+卵黄;第二,研究对象及品种不同,不同品种羊精液性状的遗传参数和精清中低分子量成分不同,因此导致最适添加量有差异和保存时间的差异。Fang 等[21]研究发现,绵羊精清中含有锌、酸性磷酸酶或果糖、葡萄糖苷酶等物质。Fraser 等[22]发现,去除猪精清中的低分子组分对提高猪精子解冻后的精子质量是有效的,对改进精子常温保存方案也具有重要的现实意义。Pelayo 等[23]发现绵羊精液性状遗传参数与动物自身所处环境、管理、遗传因素和生理状况均有关。
3.2 精液品质提高的原因 有研究GSPs 可以通过清除自由基、螯合金属离子、抑制氧化酶活性等途径提高动物机体的抗氧化能力[11]。牟春堂等[24]发现,GSPs 可提高绵羊睾丸和附睾组织抗氧化能力,改善精液品质。孙艳青等[7]发现,GSPs 可有效降低MDA 含量,能有效提高猪精液冷冻保存后精子品质和抗氧化能力。
本实验结果显示,精子T-AOC 随GSPs 添加浓度升高而先递增后递减,MDA 含量随着添加质量升高而先降低后升高,这与胡亚美等[6]在猪精液常温保存中所得结果类似。脂质过氧化物代谢产生MDA 类有害物质越多,精子抗氧化能力越低,受损越严重。细胞内抗氧化酶活性提高可有效抑制过量ROS 的产生,从而降低细胞的脂质过氧化损伤,提高精液品质。综合分析其原因一方面添加GSPs 天然抗氧化剂到稀释液中,其结构中的酚性羟基能在液体环境中产生H+,H+作为无电子不稳定的离子,会抢夺自由基上的电子以达到稳定结构,从而使自由基失活,降低精子线粒体膜和脂质膜的脂质过氧化反应,保证了精子功能发挥的完整性[16];另一方面,在本实验中,添加GSPs 会使精子T-AOC活性增强,且添加量为0.09 g/L 时活性最高,在保存120 h 时可达2.12 U/mL。也可能是由于添加GSPs 激活了精液中抗氧化酶的活性[4],从而增强了精子T-AOC活性来保护精子免受氧化应激的损伤。
4 结 论
本试验结果表明,在常温保存基础精液稀释液Tris+柠檬酸+果糖中添加GSPs 对多浪羊精液具有保护作用,可延长保存时间,同时可提高T-AOC 浓度降低MDA 含量,其最适添加浓度为0.09 g/L。
