两种同期发情方法对河流型水牛血液生殖激素的影响
2022-11-17覃广胜刘新勇谭正准曾令湖程隽如于农淇王晓丽
覃广胜,刘新勇,李 辉,谭正准,黄 健,曾令湖,程隽如,于农淇,罗 华,王晓丽
(1.中国农业科学院广西壮族自治区水牛研究所,广西 南宁 530001;2.广西大学动物科学技术学院,广西 南宁 530004)
水牛具有适应力强,抗病力强,耐粗饲料等优点,但同时也具有短日照季节性繁殖、发情周期不规则、受孕率低等繁殖缺点[1]。特别是在炎热的夏季,水牛处于发情淡季[2],发情症状不明显或不发情,使水牛夏季的繁殖管理难度加大。同期发情技术可以通过利用某些外源激素人为控制空怀母畜在同一时期内发情、排卵,从而提高母畜的受胎率和繁殖效率。国内外对水牛同期发情方案进行了大量的研究[3],但国内对河流型水牛同期发情处理时血液生殖激素的变化研究罕见报道。本试验在夏季用Ovsynch法和CIDR-Ovsynch法对摩拉和尼里-拉菲水牛进行同期发情处理,利用B型超声波诊断技术(简称B超)监测卵泡发育以及排卵情况,同时采集试验水牛血液通过酶联免疫分析法(ELISA)进行生殖激素的测定,探讨同期发情处理后排卵和不排卵水牛生殖激素的变化规律,以期为水牛同期发情、人工授精等繁殖技术的研究和应用提供理论依据。
1 材料与方法
1.1 试验动物 试验水牛选自广西水牛研究所水牛种畜场。选择临床健康,年龄4~5岁,体重550~600 kg,膘情中等以上,空怀的成年摩拉和尼里-拉菲水牛各11头。试验水牛随机分成2个组,其中Ovsynch法组为摩拉和尼里-拉菲水牛各6头,CIDR-Ovsynch法组为摩拉和尼里-拉菲水牛各5头。试验时间为2020年6—7月,试验期间试验水牛均在同一牛栏饲养且自由采食充足的饲料和饮水。
1.2 药品和仪器 戈那瑞林(GnRH)(宁波第二激素厂,100 μg×10瓶/盒);氯前列醇注射液(PGF)(上海计胜生物科技有限公司,2 mL∶0.2 mg×10支/盒);孕酮栓(CIDR)(美国进口,含孕酮1.56 g/支)。HS-1600V型兽用超声波诊断仪、5.0 MHz阴道探头(日本宏达)。
1.3 试验方法
1.3.1 同期发情处理 Ovsynch法[4]:GnRH+PGF+GnRH,选择水牛生理周期的任意一天定义为第0天并在上午肌内注射GnRH 100 μg/头,第7天上午肌内注射PGF 0.4 mg/头,第9天上午肌内注射GnRH 100 μg/头。CIDR-Ovsynch法[5]:CIDR+GnRH+PGF+GnRH,第0天上午肌内注射GnRH 100 μg/头,同时在母牛生殖道内放置CIDR,第7天上午肌内注射PGF 0.4 mg/头,并从生殖道内撤出CIDR,第9天上午肌内注射GnRH 100 μg/头。
1.3.2 发情和排卵监测 全部试验水牛从第10天开始每天进行B超监测,使用兽用B超仪逐头经直肠扫描水牛卵巢,记录卵巢上直径≥9 mm卵泡数目。以第1次B超监测时卵巢上存在卵泡直径≥9 mm的优势卵泡为发情判断标准,监测的优势卵泡消失且直肠检查发现有排卵凹为排卵判断标准[6]。排卵的水牛排卵当天记录后停止监测并记为排卵水牛,第12天仍不排卵的水牛停止监测并记为不排卵水牛。
1.3.3 血样采集 试验水牛同期发情处理时的第0、7、9天以及之后直至排卵的每天都采集血样,不排卵水牛采集血样至第12天。于采血当天早上9点试验水牛未采食前通过颈静脉采集全血10 mL,室温静置2 h待血液凝固后3 000 r/min离心10 min,分离血清分装到EP管中,标记好号码后置于-80 ℃冰箱保存待测。
1.3.4 血液生殖激素测定 血清样品送江苏晶美生物科技有限公司采用ELISA进行测定,测定指标包括:促卵泡素(FSH)、黄体生成素(LH)、雌二醇(E2)、孕酮(P4)、抑制素(INH)和胰岛素样生长因子1(IGF-1)。各指标测定样品线性回归与预期浓度相关系数R值均为0.95以上,批内变异系数和批间变异系数均分别小于10%和15%。
1.3.5 数据统计 试验数据经Excel 2016初步整理后采用SPSS 26.0软件进行独立样本t检验,P<0.05表示差异显著。数据均以平均值±标准误表示。
2 结果
2.1 水牛发情、排卵情况 由表1可知,Ovsynch法中有1头试验水牛未发情,发情率为91.67%,CIDR法全部的试验水牛都发情,发情率为100%。但2种同期发情方法的排卵率均有所下降,Ovsynch法的排卵率为75.00%,而CIDR法仅有40.00%的试验水牛排卵。由表2可知,摩拉水牛的发情率和排卵率均高于尼里-拉菲水牛,摩拉水牛的发情率和排卵率分别为100%和81.82%,而尼里-拉菲水牛的发情率和排卵率为90.91%和36.36%。
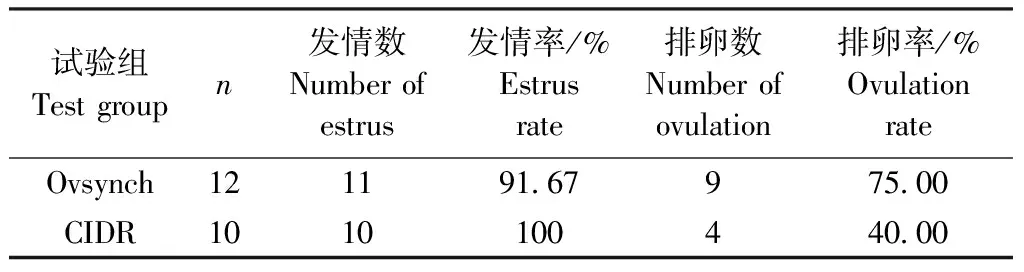
表1 不同处理方法的发情和排卵情况
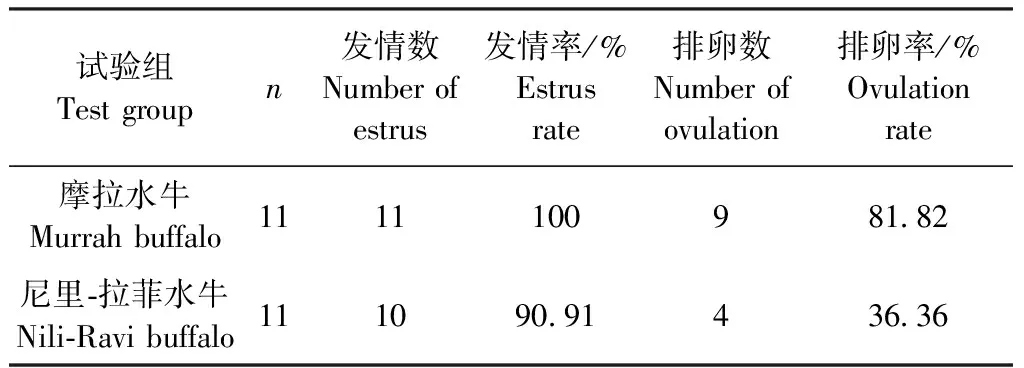
表2 摩拉和尼里-拉菲水牛的发情和排卵情况
2.2 水牛FSH测定 由表3可知,第0天用Ovsynch法测得的排卵水牛FSH浓度显著高于用CIDR法测得的浓度(P<0.05);第10天用Ovsynch法测得的排卵牛FSH浓度显著低于用CIDR法以及Ovsynch法测得的不排卵水牛浓度(P<0.05);第11天用Ovsynch法测得的排卵水牛浓度FSH显著低于不排卵水牛浓度(P<0.05)。由图1A可知,2种方法处理的不排卵水牛FSH浓度在第9~12天呈小幅度波动变化,而排卵水牛在9~11 d呈逐渐下降趋势,且第11天浓度小于不排卵水牛。
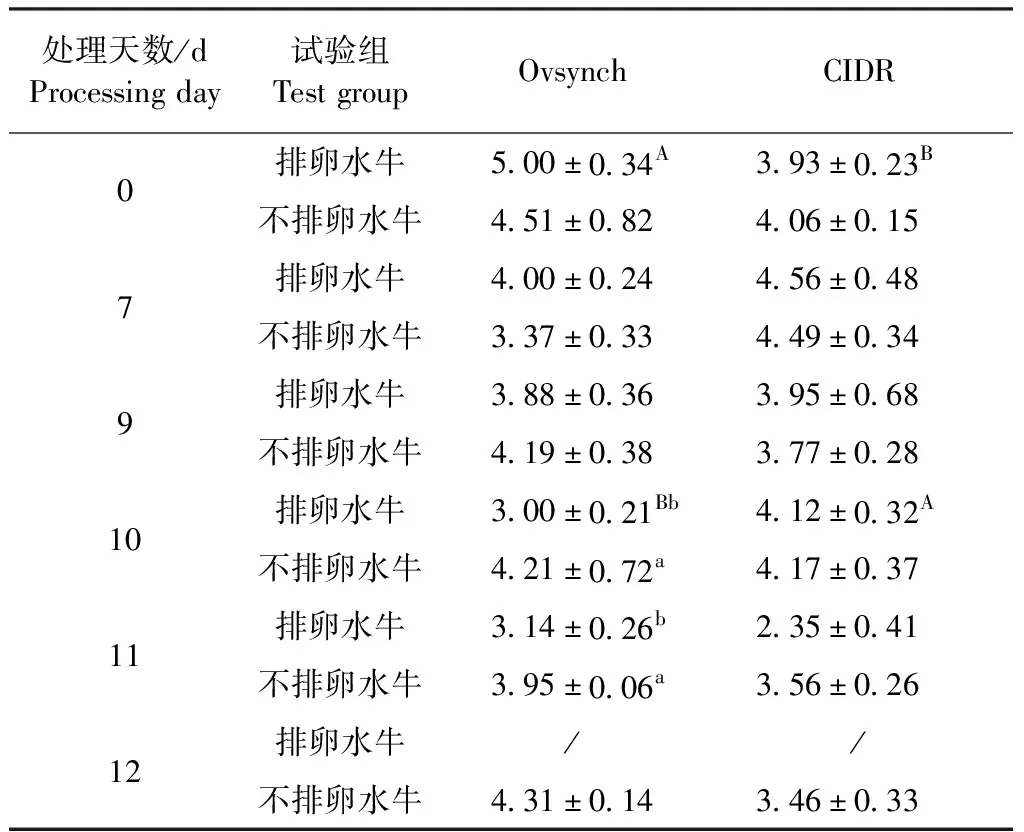
表3 排卵水牛和不排卵水牛血清FSH水平在同期发情处理中不同时间段的比较
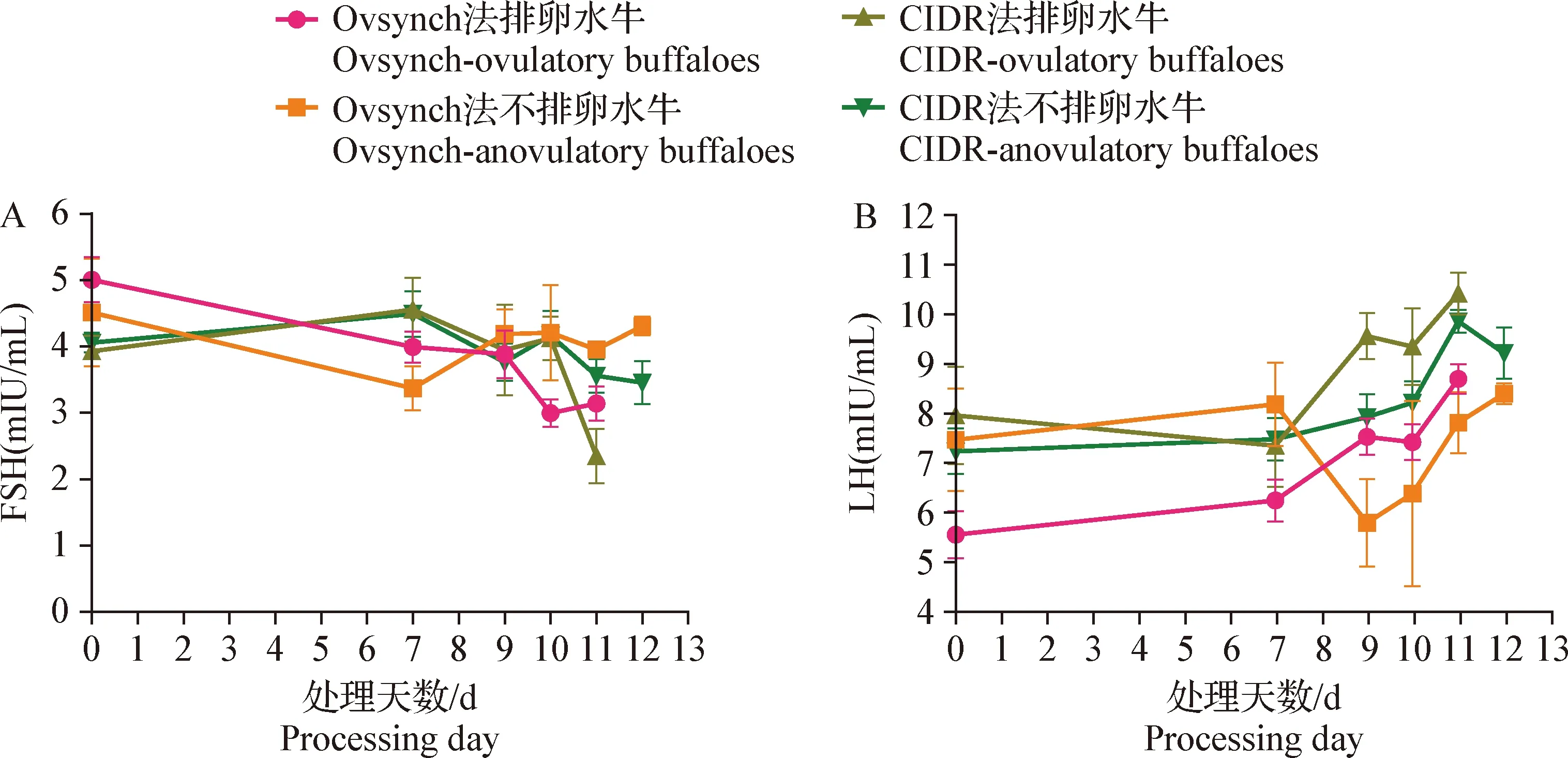
图1 排卵水牛和不排卵水牛血清FSH(A)和LH(B)变化规律
2.3 水牛LH测定 由表4可知,第0天用Ovsynch法测得的排卵水牛LH浓度显著低于用CIDR法测得的浓度(P<0.05);第9天用Ovsynch法测得的排卵水牛和不排卵水牛LH浓度均显著低于用CIDR法测得的浓度(P<0.05),且用CIDR法测得的排卵水牛LH浓度显著高于不排卵水牛(P<0.05);第10天用Ovsynch法测得的排卵水牛LH浓度显著低于用CIDR法测得的浓度(P<0.05);第11天用Ovsynch法测得的排卵水牛和不排卵水牛LH浓度均显著低于用CIDR法测得的浓度(P<0.05)。由图1B可知,2种方法处理的排卵水牛和不排卵水牛LH变化总体均呈逐渐上升的趋势,且9~12 d CIDR法测得的浓度高于Ovsynch法。
2.4 水牛E2测定 由表5可知,第7天用Ovsynch法测得的排卵水牛和不排卵水牛E2浓度显著高于用CIDR法测得的浓度(P<0.05);第9天用Ovsynch法测得的排卵水牛E2浓度显著高于用CIDR法测得的浓度(P<0.05);第11天用Ovsynch法测得的排卵水牛E2浓度显著高于不排卵水牛(P<0.05)。由图2A可知,CIDR法处理的排卵水牛和不排卵水牛在第0天和第7天E2浓度均低于Ovsynch法;2种方法处理的排卵水牛和不排卵水牛E2浓度在7~12 d总体呈逐渐上升的趋势,其中在10~11 d排卵水牛浓度呈大幅上升且高于不排卵水牛,在10~12 d不排卵水牛浓度呈小幅度波动变化。
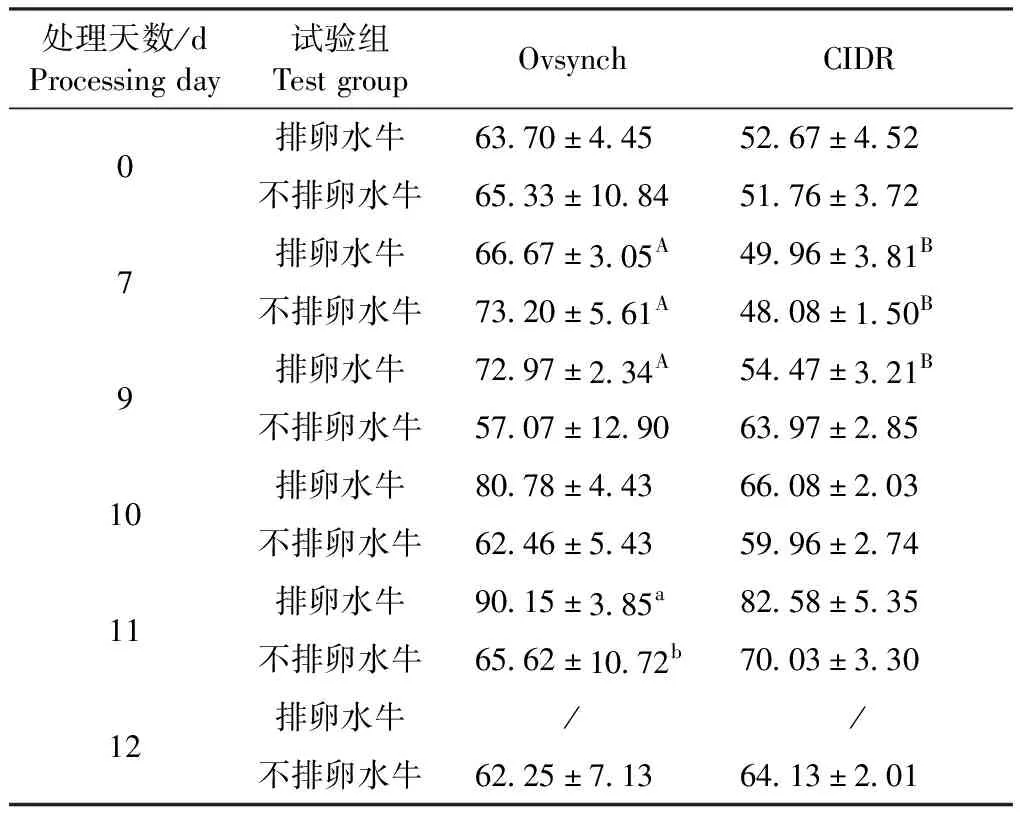
表5 排卵水牛和不排卵水牛血清E2水平在同期发情处理中不同时间段的比较
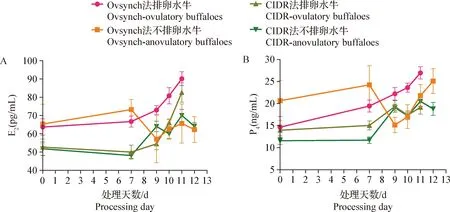
图2 排卵水牛和不排卵水牛血清E2(A)和P4(B)变化规律
2.5 水牛P4测定 由表6可知,第7天用CIDR法测得的排卵水牛P4浓度显著高于不排卵水牛(P<0.05);第9天用Ovsynch法测得的不排卵水牛P4浓度显著低于Ovsynch法排卵水牛以及CIDR法不排卵水牛浓度(P<0.05);第10天Ovsynch法测得的排卵水牛P4浓度显著高于Ovsynch法不排卵水牛以及CIDR法排卵水牛浓度(P<0.05);第11天用Ovsynch法测得的排卵水牛P4浓度显著高于用CIDR法测得的浓度(P<0.05)。由图2B可知,Ovsynch法处理的排卵水牛和不排卵水牛P4浓度在0~7 d和9~12 d均呈上升趋势,CIDR法处理的排卵水牛和不排卵水牛P4浓度在0~7 d基本不变,7~12 d呈逐渐上升趋势,且10~12 d的浓度低于Ovsynch法。
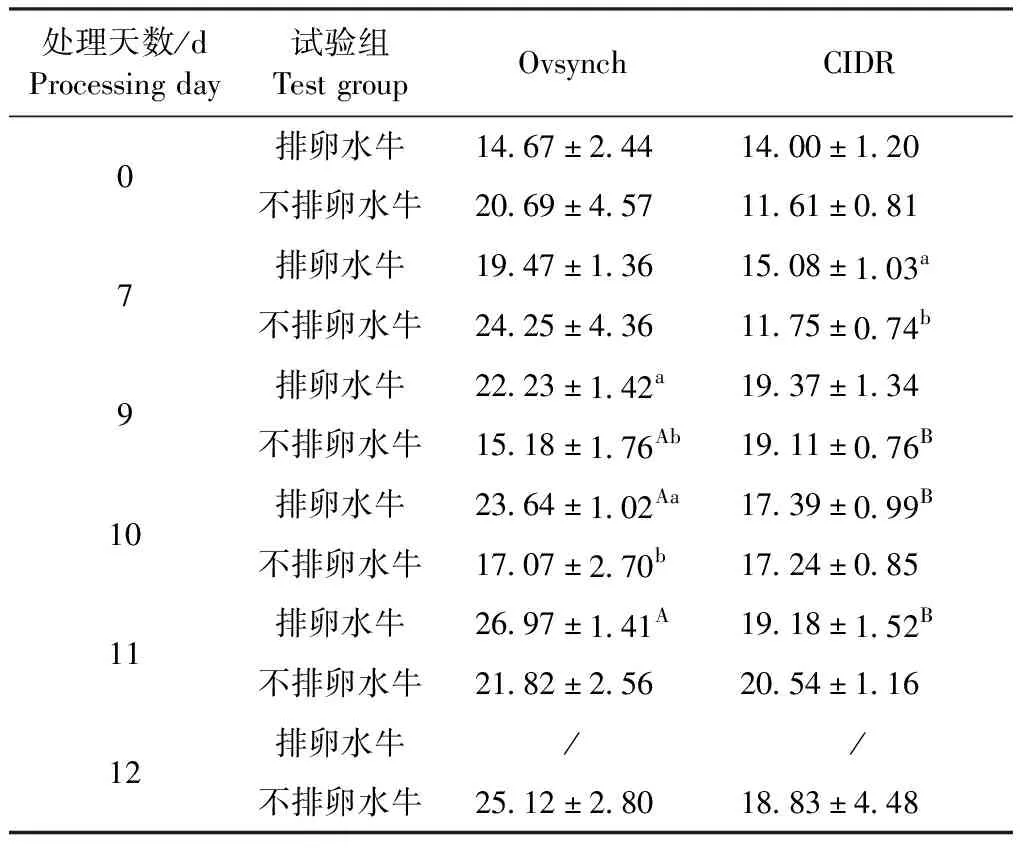
表6 排卵水牛和不排卵水牛血清P4水平在同期发情处理中不同时间段的比较
2.6 水牛INH测定 由表7可知,第7天用Ovsynch法测得的不排卵水牛INH浓度显著高于CIDR法不排卵水牛(P<0.05);第10天用Ovsynch法测得的不排卵水牛INH浓度显著低于Ovsynch法排卵水牛以及CIDR不排卵水牛浓度(P<0.05)。由图3A可知,2种方法处理的排卵水牛和不排卵水牛INH浓度变化总体均呈波动上升的趋势。
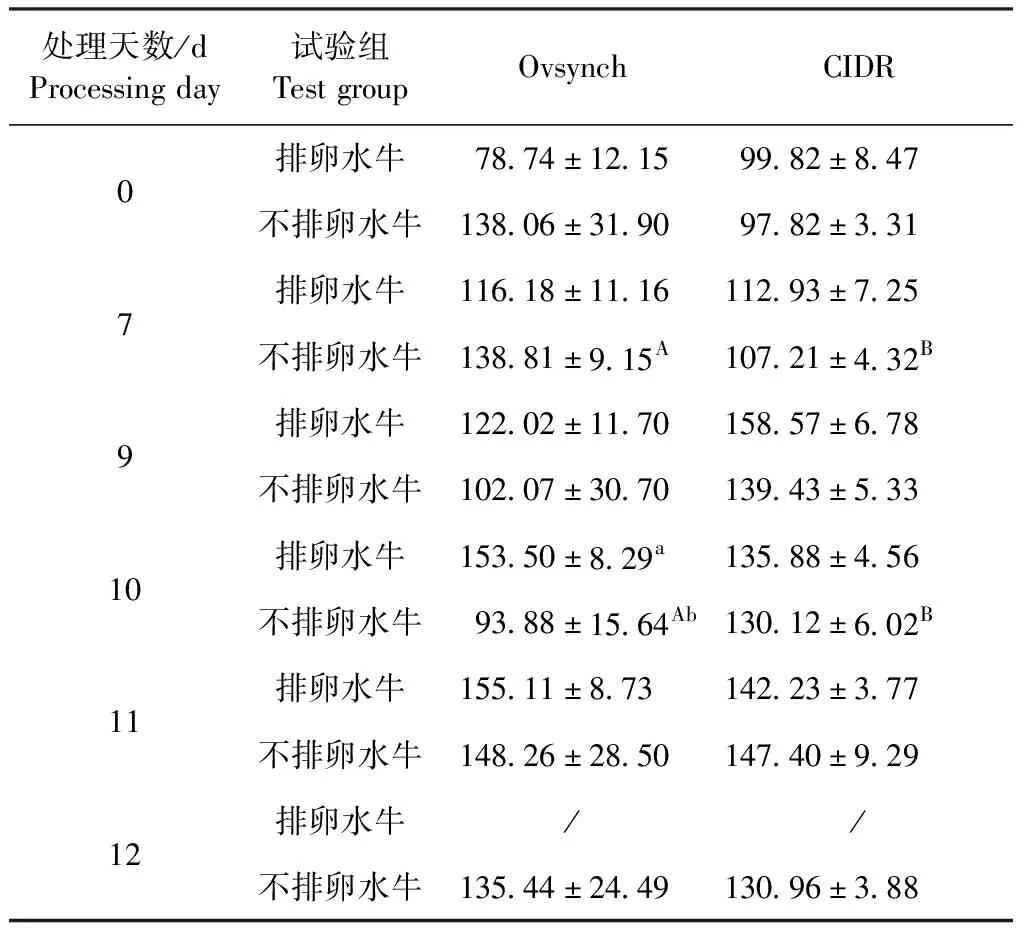
表7 排卵水牛和不排卵水牛血清INH水平在同期发情处理中不同时间段的比较
2.7 水牛IGF-1测定 由表8可知,第10天用Ovsynch法测得的排卵水牛IGF-1浓度显著高于Ovsynch法不排卵水牛浓度(P<0.05)。由图3B可知,2种方法处理的排卵水牛IGF-1浓度变化总体均呈逐渐上升的趋势,而2种方法处理的不排卵水牛IGF-1浓度在7~12 d呈波动上升趋势,且10~12 d的浓度低于排卵水牛。

图3 排卵水牛和不排卵水牛血清INH(A)和IGF-1(B)变化规律
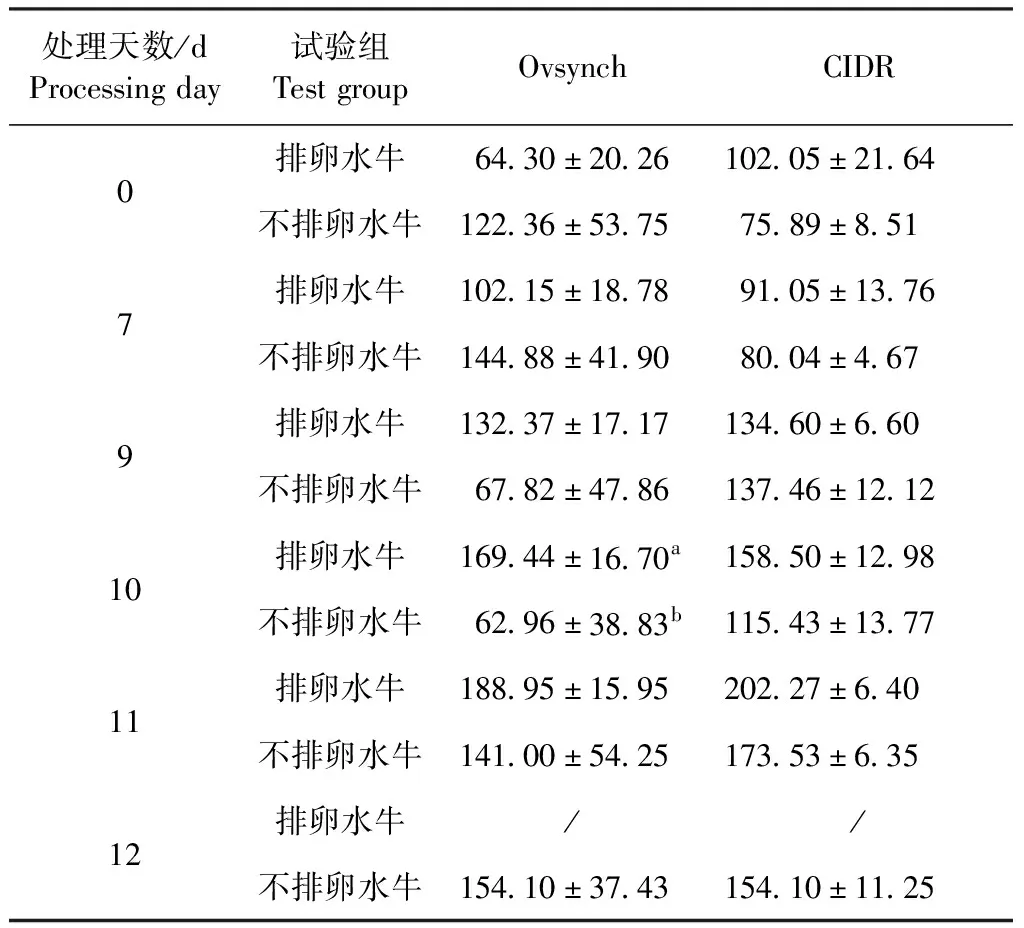
表8 排卵水牛和不排卵水牛血清IGF-1水平在同期发情处理中不同时间段的比较
3 讨论
国内外对水牛的同期发情方案进行了大量的研究,开发出以Ovsynch法和CIDR-Ovsynch法为代表的多种基础以及改良方案[3,7]。Mirmahmoudi等[8]使用Ovsynch法在水牛发情淡季进行同期发情处理后得到的发情率为49%(230/414),而Neglia等[5]使用CIDR-Ovsynch法得到的发情率为30%(6/20)。本试验发现,在水牛发情淡季使用Ovsynch法的发情排卵效果优于使用CIDR法,此结果与已有报道一致,且摩拉水牛的发情排卵效果优于尼里-拉菲水牛。陈明棠等[6]使用Ovsynch法的研究结果则显示,摩拉水牛的发情率(67.09%)和排卵率(77.36%)均低于尼里-拉菲水牛的发情率(87.18%)和排卵率(89.66%),考虑到陈明棠等的研究是收集了不同牛场、不同季节、不同年龄段的大量数据得出的结果,而本试验中试验水牛数量较少,摩拉水牛和尼里-拉菲水牛的发情排卵情况还需进一步研究。
FSH在雌性哺乳动物中能刺激有腔卵泡的生长和成熟,以及颗粒细胞的增殖和E2的产生,在排卵前FSH浓度随着排卵前卵泡分泌E2的增加而迅速下降。Kaker等[9]研究发现,水牛FSH在排卵前达到峰值后逐渐下降。王慧英等[10]也观察到水牛血清FSH在排卵前4天开始缓慢上升至峰值15.62 ng/mL,在排卵后又明显下降。本试验发现,排卵水牛在排卵当天的FSH浓度迅速下降并低于不排卵水牛,不排卵水牛在此阶段FSH浓度变化平缓未呈下降趋势,与已有报道相符。LH具有诱导排卵以及刺激卵巢产生P4的作用,LH在排卵前激增并出现峰值,从而触发排卵。Rahe等[11]研究发现,水牛与牛一样,LH在排卵前和发情日激增。Rhodes等[12]发现,产后母牛和乏情母牛进行P4处理会促进LH脉冲性释放。而Barile等[13]则发现,同期发情处理与自然发情的LH峰值结果一致。本试验结果表明,无论水牛是否排卵,LH均呈逐渐上升的趋势,但CIDR法处理的水牛在9~12 d的LH浓度高于Ovsynch法,说明外源P4处理的确会促进LH脉冲性释放。
雌激素负责雌性生殖系统的生长和调节以及继发性特征,E2是雌激素4种类型之一,由发育中的卵泡颗粒细胞产生并具有与卵巢卵泡发育情况一致的周期性。排卵前由于黄体逐渐消失,P4的含量降低,此时可岀现E2的排卵前高峰。贾银海等[14]发现,母水牛在发情第15~17天出现E2最高峰值244.70 pg/mL。王慧英等[10]也观察到水牛血清E2含量在发情周期的第19天开始发情时升高达到最高峰值。本试验发现,排卵水牛E2浓度在10~11 d时大幅上升,而不排卵水牛在10~12 d时呈先小幅上升后又下降的趋势,说明排卵水牛具有排卵前E2高峰,而不排卵水牛则没有。P4具有刺激子宫内膜的血管生长和营养分泌以支持胚胎植入的功能。因为黄体是循环P4的来源,P4水平的上升和下降与黄体的生长和衰退一致。王慧英等[10]观察到水牛P4含量由发情周期的第5天缓慢上升,到第13天达到峰值,在第19天发情开始时有一个明显下降的过程且保持相对平稳的水平。本试验发现,Ovsynch法处理的水牛P4水平在0~12 d呈逐渐上升的趋势,而CIDR法处理的水牛P4水平在第0天和第7天基本保持不变,7~12 d呈小幅度波动上升且部分天数浓度小于Ovsynch法。考虑到CIDR法中CIDR在母牛阴道内逐渐释放P4,可能是外源P4影响了水牛内源P4的释放,导致CIDR处理的水牛P4水平总体较低,具体还需进一步的研究。
FSH、LH、E2、P4这4种生殖激素在生殖周期的变化规律已有大量研究,也有研究表明INH和IGF-1与卵泡发育有关[15-16]。INH对FSH的合成和分泌具有选择性的抑制作用,还可通过自分泌和旁分泌作用调节E2的生成。Singh等[17]研究发现,水牛血浆FSH水平与同期相对较低的INH水平以及较高的E2水平相对应,即INH和E2对水牛FSH分泌均有反馈调节作用。本试验结果显示,2种方法处理的水牛无论是否排卵,INH水平总体均呈波动上升的趋势,与前人的研究结果一致。IGF-I可由卵巢颗粒细胞和卵泡膜细胞合成和分泌,具有刺激颗粒细胞和颗粒黄体细胞分泌E2和P4的作用[18]。本试验发现,2种方法处理的排卵水牛IGF-1水平呈平缓上升趋势,且在第9~11天的浓度高于不排卵水牛,而不排卵水牛则呈波动上升的趋势。排卵水牛在第9~11天时IGF-1和E2浓度都呈大幅上升的变化规律,说明IGF-1的确具有刺激E2分泌的作用,与前人的研究结果相符。
综上所述,河流型水牛用Ovsynch法比CIDR法的发情排卵效果好,摩拉水牛的同期发情排卵效果优于尼里-拉菲水牛;同期发情处理后正常排卵的河流型水牛在排卵前具有明显的FSH浓度下降以及E2、IGF-1浓度上升规律。
