洗精液鼠胚及囊胚细胞染色和计数试验研究
2022-11-17袁丽欣刘泓江王书晗关又芳臧德跃林柏佑王尔一
袁丽欣,刘泓江,王书晗,关又芳,臧德跃,林柏佑,王尔一
(深圳市医疗器械检测中心,广东 深圳 518000)
优化精子是在人工授精过程中非常重要的一个环节,能有效提升男性精子活力和质量,提高受精成功率,降低畸形胚胎的形成,从而达到优生优育的目的[1,2]。而人工授精中使用的洗精液是《医疗器械分类目录》中风险程度最高的第三类医疗器械[3,4],本研究对该产品进行体外鼠胚试验及囊胚细胞染色和计数良好囊胚数。常用的体外鼠胚试验的基本指标是囊胚形成率,然而这一指标已不能完全符合辅助生殖技术质量的要求[5-7]。大量研究发现[8-10],胚胎细胞数及囊胚细胞系分类计数是一种简单实用的试验方法,该方法是在原有的鼠胚试验的基础上增加了两个检测指标,分别为胚胎的细胞总数和囊胚期胚胎中内细胞团细胞和滋养层细胞的总数。本研究通过试验对该洗精液进行评价,以期为该产品的发展及其在生物临床应用中提供安全可靠的依据。
1 材料与方法
1.1 试验样品 洗精液:主要由氨基酸、葡萄糖、丙酮酸盐、人血清白蛋白等组成。
1.2 试验体系 6~8周龄B6D2F1雌鼠及性成熟B6D2F1雄鼠各10只,动物来源:北京维通利华实验动物技术有限公司,实验动物生产许可证:SCXK(京)2021-0006。动物管理:饲养:按照ISO 10993-2的规定进行;食物:使用由北京科澳协力饲料有限公司提供的饲料;饮水:供给经灭菌的城市生活用水;环境:每日监测室温及环境湿度,将温度范围控制在20 ℃~26 ℃,相对湿度控制在40%~70%。
1.3 主要仪器 荧光倒置显微镜(Leica,型号:DMi8 automated)、体视显微镜(Leica,型号:S8APO)、蜂巢式CO2培养箱(Thermo Fisher Scientific,型号:FORMA STERI-CYCLE i250)、生物安全柜(Thermo,型号:MSC Advantage 1.8)、显微镜透明热台(Tokai Hit,型号:MAST-SZ2)。
1.4 主要试剂 孕马血清促性腺激素(PMSG)(宁波第二激素厂,批号:2 1 0 7 2 7)、人绒毛膜促性腺激素(hCG)(宁波第二激素厂,批号:210804)、M2操作液(Sigma,批号:SLCH1397)、Triton X-100(Sigma,批号:SLCF5969)、透明质酸酶(Sigma,批号:SLBS2130V)、矿物油(Sigma,批号:MKCM5905)、PBS缓冲液(Gibco,批号:2412439)、PI染色液(Sigma,批号:WXBD3718V)、Anti-UTF1(一抗)(Abcam,批号:GR3212508-2)、AF488(二抗)(全式金,批号:P20610)、30%山羊血清(Scientific Phygene,批号:20211203)、多聚甲醛(PFA)(Biosharp,批号:71050405)、牛血清白蛋白(Sigma,批号:WXBD4426V)。
1.5 试验方法
1.5.1 体外鼠胚试验 超数排卵:选择6~8周龄B6D2F1雌鼠,经腹腔注射PMSG 10 IU/只;48 h后经腹腔注射 hCG 10 IU/只,注射hCG当天雌鼠与同品系雄鼠合笼过夜。准备培养皿:取胚前1 d下午,在35 mm培养皿中用KSOM培养液制做数滴30 μl的培养微滴,表面覆盖培养油,按需制备,在37 ℃、5% CO2及饱和湿度的培养箱过夜平衡,时间约16 h。鼠胚采集:于合笼第2天早上检查小鼠交配情况,选择见栓小鼠备用。1-细胞胚胎收集:注射hCG 18 h后处死见栓雌鼠,将输卵管壶腹部划破,将收集到的絮状受精卵团放置到提前预热至37 ℃的透明质酸酶液滴中,当胚胎周围的卵丘和颗粒细胞被消化分离后,立即转移到M2操作液中清洗,挑选出形态正常的胚胎,转移到培养微滴中,用于1-细胞鼠胚检测试验。体外培养:采用微滴法培养,将鼠胚随机分为样品组、阴性对照组和阳性对照组,每组不少于50枚。阴性对照组胚胎在培养液滴中清洗2~3次后,直接转移到提前平衡好的微滴中培养。阳性对照组胚胎在培养液滴中清洗2~3次后,转移到提前平衡好的阳性对照液滴中(含0.005% Triton X-100的KSOM)。样品组胚胎在样品液滴中清洗2~3次后,转移到提前预热至37 ℃的样品液滴接触20 min,接触后的胚胎在培养液滴中清洗2~3次,转移到提前平衡好的培养液滴中培养。培养条件:每组鼠胚采集自3~5只小鼠,每个微滴中培养胚胎数不超过20枚。在37 ℃、5% CO2及饱和湿度的培养箱中培养96 h,检查囊胚发育情况并计算囊胚形成率。囊胚形成率=囊胚数/(1-细胞胚胎数)×100%。可接受准则:阴性对照组囊胚形成率应≥80%;阳性对照组囊胚形成率应低于阴性对照组[11]。
1.5.2 囊胚染色和计数 囊胚收集:收集体外鼠胚试验中样品组和阴性对照组所有发育良好的囊胚备用。囊胚染色:于室温下,用PBS对囊胚进行3次漂洗,10 min/次,漂洗完将囊胚放入2%的PFA中固定30 min;室温下将囊胚转移至透膜液中30 min,用PBS对囊胚进行3次漂洗,10 min/次;将囊胚置于30%的山羊血清中3 h,以封闭非特异性的抗体结合位点;PBS漂洗囊胚1次;4 ℃下与一抗结合12 h;PBS漂洗囊胚3次,10 min/次;室温、避光条件下与二抗结合1 h;PBS漂洗囊胚3次,10 min/次;将胚胎移至PI染色液中,置于室温避光条件下30 min;用PBS在玻片上做一个含囊胚的小液滴,在盖玻片4个角分别滴一小滴甘油滴,用盖玻片轻轻覆盖囊胚样品,轻压盖玻片使囊胚细胞延展平铺;置于室温避光条件下20 min;在荧光显微镜下直接计数。囊胚细胞染色和计数为荧光显微镜下计数囊胚细胞总数和内细胞团细胞数。总细胞数≥50个,内细胞团细胞数≥12个为良好囊胚数[12]。
1.6 统计学方法 采用SPSS 21.0统计学软件进行数据分析,计数资料以[n(%)]表示,行χ2检验;P<0.05表示差异有统计学意义。
2 结果
2.1 体外鼠胚试验结果 阴性对照组囊胚形成率97.00%,阳性对照组囊胚形成率为0,试验条件成立,样品组的囊胚形成率为99.05%,见表1。

表1 各组体外鼠胚试验结果(n,%)
2.2 囊胚染色和计数结果 每组计数32个囊胚,阴性对照组良好囊胚数占比为96.88%(31/32),样品组良好囊胚数占比为93.75%(30/32),组间比较差异无统计学意义(χ2=0.350,P>0.05),见表2、表3。

表2 阴性对照组囊胚细胞总数和内细胞团细胞总数(n)
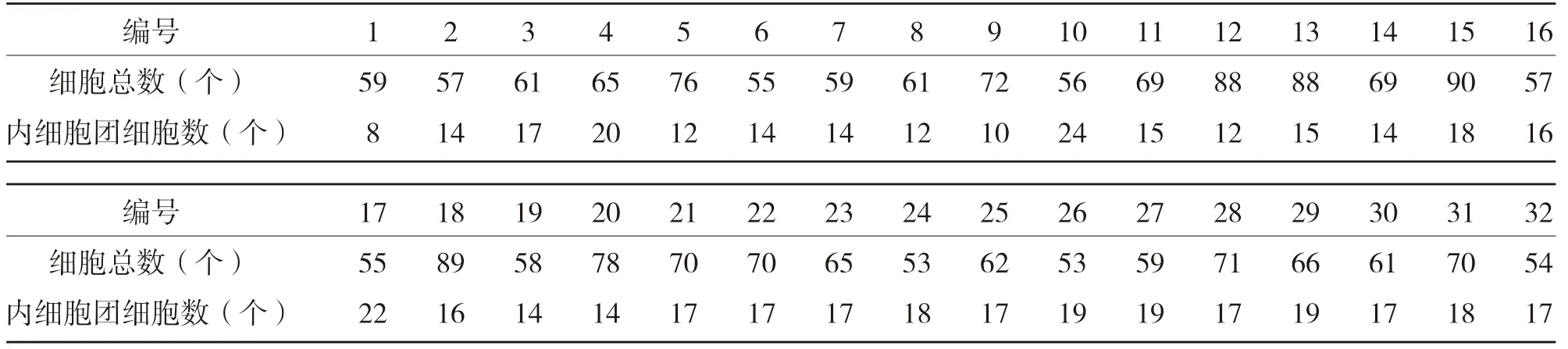
表3 样品组囊胚细胞总数和内细胞团细胞总数(n)
3 讨论
人类辅助生殖技术起源于20世纪70年代,是目前公认治疗不孕症的最有效方法[13]。近年来,在社会需求的刺激下,人类辅助生殖技术和产业迅速发展并不断完善,辅助生殖技术用医疗器械产品也愈加丰富[14,15]。而这类医疗器械的安全性和有效性直接影响着患者以及子代的安全与健康,因此要对其质量和安全性给予高度重视并严格监管,其中的生物相容性评价也是监管重点,主要的评价项目除了要包含GB/T 16886系列中涉及的如致敏、急性全身毒性等常规检验项目之外,对于可能接触配子和/或胚胎的产品,需要进行体外鼠胚试验,体外鼠胚试验分为1-细胞和2-细胞两种方法,由于1-细胞胚胎方法更为敏感,因此标准推荐使用1-细胞胚胎法[16,17]。鼠胚试验结果是观察囊胚发育情况并计算囊胚形成率,但是仅凭这两点无法完整地说明囊胚质量的优劣。因此,可兼用囊胚染色和计数法,通过对囊胚细胞染色和计数良好囊胚数对发育期的胚胎进行分析[18]。
本研究结果显示,阴性对照组囊胚形成率97.00%,阳性对照组囊胚形成率为0,试验条件成立,样品组的囊胚形成率为99.05%;阴性对照组良好囊胚数占比为96.88%(31/32),样品组良好囊胚数占比为93.75%(30/32),组间比较差异无统计学意义(P>0.05)。由此可见,我国辅助生殖技术用医疗器械和国内产业已初具雏形,标准化工作和监督技术也日益完善,这些都将成为辅助生殖用医疗器械后续发展的重要动力和保障,也为该类产品检测及监管提供技术参考。
综上所述,该种洗精液体外鼠胚试验囊胚形成率及囊胚细胞染色和计数符合标准要求,可进一步用于临床研究。
