BAIAP2L2在肝癌中的表达及临床意义
2022-11-16屈才浩马腾达李晓梅李玉民
屈才浩,马腾达,王 瑞,李晓梅,李玉民*
(1.兰州大学第二医院普外科,中国甘肃 兰州 730030;2.甘肃省消化系肿瘤重点实验室,中国甘肃 兰州 730030)
2020年全球癌症报告显示,肝癌是最常见的恶性肿瘤之一,其在全球肿瘤中发病率位居第6位,死亡率位居第4位[1]。目前,中国的肝癌患者5年生存率约14.1%[2]。虽然手术切除被认为是早期肝癌患者最佳的治疗手段,但是术后高复发率,使得肝癌患者的总体预后仍然欠佳[3~4]。因此,寻找对肝癌诊断、治疗及预后有效的新型生物标志物至关重要。
脑特异性血管生成抑制剂1相关蛋白2样2(brain-specific angiogenesis inhibitor 1-associated protein 2-like 2,BAIAP2L2)属于 I-BAR(inverse Bin-Amphiphysin-Rvs)结构蛋白家族,是一种上皮特异性BAR结构域蛋白,在调节和诱导肌动蛋白膜突起的形成、细胞迁移和膜丝状体的生成中起重要作用[5~8]。BAIAP2L2 也被称为 Pinkbar,位于染色体22q13.1[6,9]。越来越多的研究表明,BAIAP2L2在肺癌、胃癌、前列腺癌等肿瘤中表达上调[9~11]。Xu 等[9]研究表明,BAIAP2L2 在肺癌中高表达,它不仅可通过雌激素介导的S期途径促进癌细胞增殖和集落形成,而且还可减少癌细胞凋亡。Liu等[10]指出,BAIAP2L2在胃癌中高表达,并通过AKT/mTOR和Wnt3a/β-catenin信号通路调节癌细胞的增殖和转移。在前列腺癌中,BAIAP2L2通过血管内皮生长因子和细胞凋亡信号通路促进癌细胞的增殖和迁移,并且增加了癌细胞的侵袭和恶性程度[11]。然而,BAIAP2L2在肝癌中的相关研究尚未见报道。本研究通过生物信息学方法,分析了BAIAP2L2在肝癌中的表达水平、诊断和临床预后价值以及其中潜在的作用机制,旨在为BAIAP2L2作为肝癌诊断指标、治疗靶点及预后标志物提供理论支持。
1 材料与方法
1.1 数据来源
从TCGA数据库[12](https://portal.gdc.cancer.gov/)下载肝癌mRNA-seq数据(肝癌样本:n=374;癌旁样本:n=50)、miRNA-seq 数据(肝癌样本:n=375;癌旁样本:n=50)、DNA甲基化数据(430例)及肝癌患者临床资料(438例),下载时间为2021年4月。从ICGC数据库[13](https://dcc.icgc.org/)下载肝癌mR-NA-seq数据(肝癌样本:n=232;癌旁样本:n=199)和临床资料(431例),用于表达和生存分析的验证,下载时间为2021年4月。
1.2 BAIAP2L2在肿瘤中的表达差异分析
运用TIMER数据库[14](https://cistrome.shinyapps.io/timer/)分析BAIAP2L2在不同肿瘤中的表达水平。采用Wilcoxon秩和检验比较TCGA数据库中肝癌及癌旁样本之间BAIAP2L2的表达差异,并分析其在50例配对肝癌及其癌旁样本中的表达水平。采用受试者工作特征(receiver operating characteristic,ROC)曲线判断BAIAP2L2对肝癌的诊断价值,并计算曲线下面积(area under the curve,AUC)。使用ICGC数据库中相关肝癌数据验证以上结果。通过HPA数据库[15](https://www.proteinatlas.org/)中抗体染色细胞比例和染色强度的综合评估,分析BAIAP2L2蛋白在肝癌组织及癌旁组织中的表达。
1.3 BAIAP2L2表达量与临床病理特征的相关性分析
使用Wilcoxon秩和检验或Kruskal-Wallis检验比较不同临床病理特征组间BAIAP2L2表达水平的差异,临床病理特征包括年龄、性别、肿瘤组织学分级、TNM分期、甲胎蛋白(alpha fetoprotein,AFP)及存活状态等。
1.4 BAIAP2L2表达水平与肝癌患者的生存分析
使用R软件(版本4.0.3)提取肝癌患者临床数据,移除生存状态信息不完整的样本并与BAIAP2L2表达数据合并。以肝癌患者肿瘤组织中BAIAP2L2表达的中位数为截断值,将患者分为高、低表达两组,用Kaplan-Meier法绘制生存曲线,采用log-rank检验比较两组之间的生存差异。同时,利用Kaplan-Meier Plotter数据库[16](https://kmplot.com/analysis/)和GEPIA数据库[17](http://gepia.cancer-pku.cn/)进一步验证BAIAP2L2表达与肝癌患者生存的关系。此外,使用单因素Cox回归计算所研究变量的风险比(hazard ratio,HR),采用多因素Cox回归探索BAIAP2L2作为预后因素的独立性,纳入的变量包括患者年龄、性别、TNM分期和组织学分级。
1.5 BAIAP2L2表达与其拷贝数变异、甲基化及miRNAs的相关性分析
通过cBioPortal数据库[18](http://www.cbioportal.org/)分析BAIAP2L2表达与其拷贝数变异(copy number variation,CNV)的相关性。使用Pearson相关性分析肝癌DNA甲基化数据中BAIAP2L2甲基化水平与BAIAP2L2表达水平的关系。以肝癌患者中BAIAP2L2甲基化水平的中位数为截点,将肝癌患者分为高、低甲基化组,绘制生存曲线,并采用log-rank检验比较两组间的生存差异。运用miRWalk数据库[19](http://mirwalk.umm.uni-heidelberg.de/)预测调控BAIAP2L2表达的miRNAs,并与TCGA数据库中筛选得到的下调miRNAs取交集,获得共同的miRNAs,采用Pearson相关性分析它们与BAIAP2L2在肝癌中的关系。
1.6 BAIAP2L2表达水平与肝癌组织中免疫细胞浸润水平的相关性分析
运用TIMER数据库分析BAIAP2L2表达与肝癌组织中浸润免疫细胞的相关性,免疫细胞包括CD4+T细胞、CD8+T细胞、B细胞、巨噬细胞、树突状细胞和中性粒细胞,并分析各种免疫细胞的浸润水平与肝癌患者预后的关系。
1.7 基因富集分析
利用基因集富集分析(gene set enrichment analysis,GSEA)软件[20](4.1.0版)预测 BAIAP2L2在肝癌中涉及的相关通路。基于BAIAP2L2表达的中位数将肝癌样本分为高、低表达组,运用GSEA软件进行KEGG(kyoto encyclopedia of genes and genomes)通路富集分析。选择带注释的基因集(c2.cp.kegg.v7.2.symbols.gmt)作为参考基因集,每个分析运行1 000次基因组排列。以P<0.05和错误发现率(false discovery rate,FDR)<0.25为显著富集[20],用R软件plyr包、ggplot2包、grid包和gridExtra包绘图。
1.8 统计学处理
采用R软件进行统计学分析和图形可视化。假设检验采用双边检验,P<0.05为差异具有统计学意义。
2 结果
2.1 BAIAP2L2在癌及癌旁组织中的表达差异
通过TIMER数据库分析了BAIAP2L2在常见肿瘤中的表达水平,结果显示,与正常组织相比,BAIAP2L2在肺癌、胃癌和肝癌等肿瘤中高表达(图1A)。在TCGA数据库中,与正常肝组织相比,BAIAP2L2在肝癌组织中的表达显著上调(P<0.001)(图1B),且在50例配对样本的肝癌组织中的表达也显著上调(P<0.001)(图1C)。同样地,ICGC数据库的验证结果显示,BAIAP2L2在肝癌组织中的表达显著上调(P<0.001)(图1D)。此外,我们进一步从HPA数据库中获取了BAIAP2L2蛋白的表达数据,结果显示:BAIAP2L2在甲状腺癌、乳腺癌、肝癌等癌组织中的蛋白质表达阳性率均较高(图2A);在3个肝脏正常样本中,BAIAP2L2的表达均为中等阳性(图2B),而在12个肝癌样本中,有8个样本的表达为强阳性,4个为中等阳性(图2C),且都主要在细胞质中表达。

图1 不同数据库分析BAIAP2L2在肝癌组织及癌旁组织中的表达水平(A)TIMER数据库中BAIAP2L2在不同肿瘤组织和癌旁组织中的表达(**:P<0.01,***:P<0.001);(B)TCGA数据库中BAIAP2L2在肝癌组织及癌旁组织中的表达水平;(C)TCGA数据库中BAIAP2L2在配对肝癌及癌旁组织中的表达水平;(D)ICGC数据库中BAIAP2L2在肝癌组织及癌旁组织中的表达水平。Fig.1 The expression levels of BAIAP2L2 in liver cancer and adjacent tissues analyzed by different databases(A)Overview of BAIAP2L2 expression in different tumor and adjacent normal tissues via the TIMER database(**:P<0.01,***:P<0.001);(B)The expression levels of BAIAP2L2 in liver cancer and adjacent normal tissues in TCGA database;(C)The expression levels of BAIAP2L2 in paired liver cancer and adjacent normal tissues in TCGA database;(D)The expression levels of BAIAP2L2 in liver cancer and adjacent normal tissues in ICGC database.
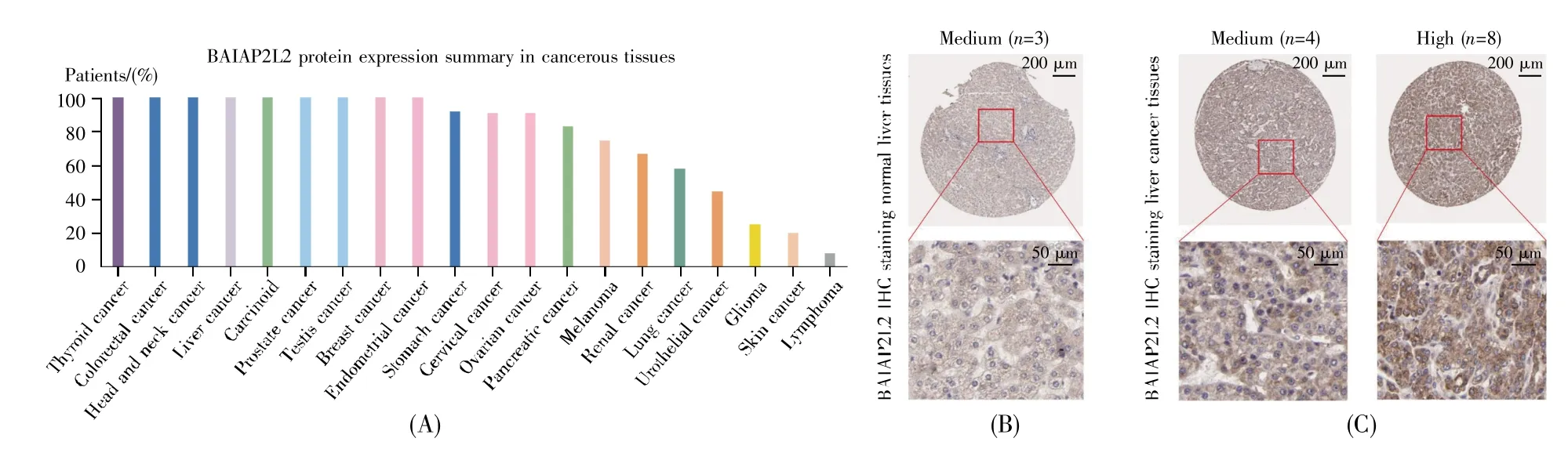
图2 BAIAP2L2蛋白在肝癌组织及癌旁组织中的表达水平(A)BAIAP2L2蛋白在不同肿瘤中的表达水平;(B)BAIAP2L2蛋白在正常肝组织中的免疫组化染色;(C)BAIAP2L2蛋白在肝癌组织中的免疫组化染色。Fig.2 The expression levels of BAIAP2L2 protein in liver cancer and adjacent normal tissues(A)The expression levels of BAIAP2L2 protein in various tumor tissues;(B)Immunohistochemical staining of BAIAP2L2 protein in normal liver tissues;(C)Immunohistochemical staining of BAIAP2L2 protein in liver cancer tissues.
2.2 BAIAP2L2表达量与肝癌患者临床病理特征的关系
进一步分析BAIAP2L2表达与肝癌患者临床病理资料的关系,结果显示:BAIAP2L2表达水平与患者临床病理特征的性别(P=0.004)、T分期(P=0.015)、TNM 分期(P=0.041)、AFP(P<0.001)及存活状态(P=0.018)显著相关,而与年龄(P=0.081)、组织学分级(P=0.108)、N分期(P=0.092)和M分期(P=0.972)无显著相关性(图3)。另外,通过ROC曲线分析可得,BAIAP2L2对肝癌具有显著的诊断价值(AUC=0.891,P<0.001)(图4A),且相关性分析表明,BAIAP2L2与AFP具有显著正相关(r=0.21,P<0.001)(图 4B)。

图3 BAIAP2L2表达与肝癌患者临床病理资料的相关性Fig.3 The association between BAIAP2L2 expression and clinicopathological characteristics in patients with liver cancer
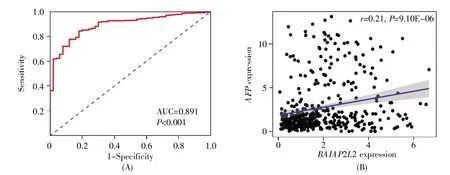
图4 BAIAP2L2在肝癌中的诊断价值及与AFP的相关性(A)BAIAP2L2诊断肝癌的ROC曲线;(B)BAIAP2L2与AFP的相关性。Fig.4 The diagnostic value of BAIAP2L2 and its correlation with AFP in liver cancer(A)The ROC curve for diagnosis of liver cancer with BAIAP2L2;(B)The association between BAIAP2L2 and AFP.
2.3 BAIAP2L2表达水平与肝癌患者预后的关系
比较TCGA数据库中BAIAP2L2高、低表达组患者的生存差异,发现BAIAP2L2高表达组患者比低表达组患者的总生存率更差(P=0.028)(图5A);ICGC数据库中的验证结果同样显示,BAIAP2L2高表达患者预后不良(P<0.001)(图5B)。此外,GEPIA和Kaplan-Meier Plotter在线数据库的分析也获得了相同的结果(图5C、5D)。进一步的单因素和多因素Cox回归分析显示,BAIAP2L2是影响肝癌患者预后的独立危险因素(HR=1.522,95%CI=1.044~2.219,P<0.05)(表 1)。
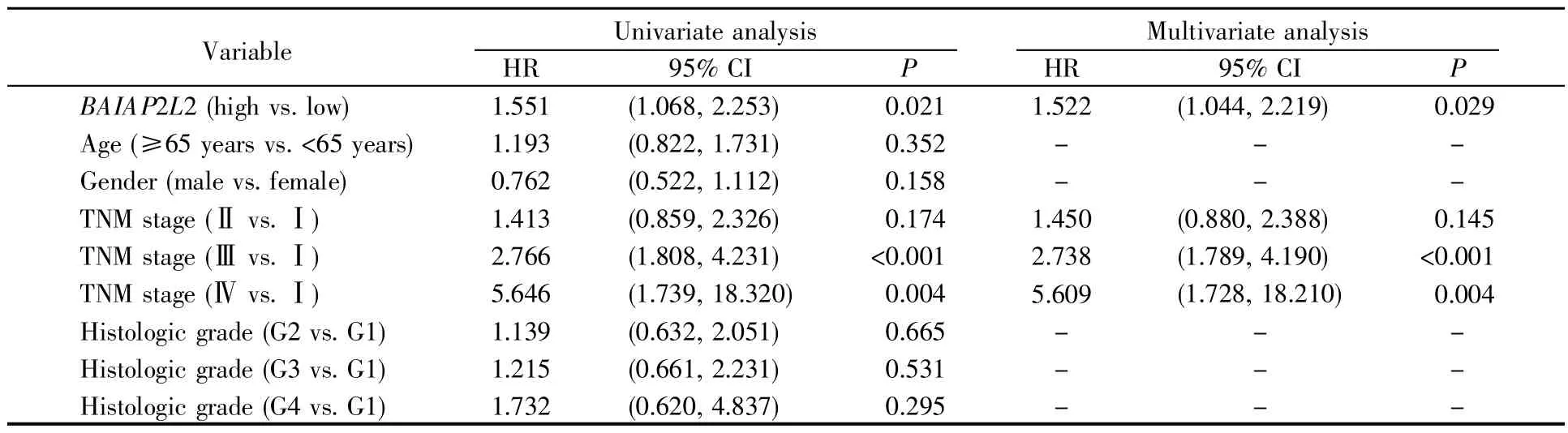
表1 肝癌患者临床病理特征与总生存率关联的单因素及多因素相关性分析Table 1 Univariate and multivariate analysis of clinicopathological characteristics for overall survival in patients with liver cancer
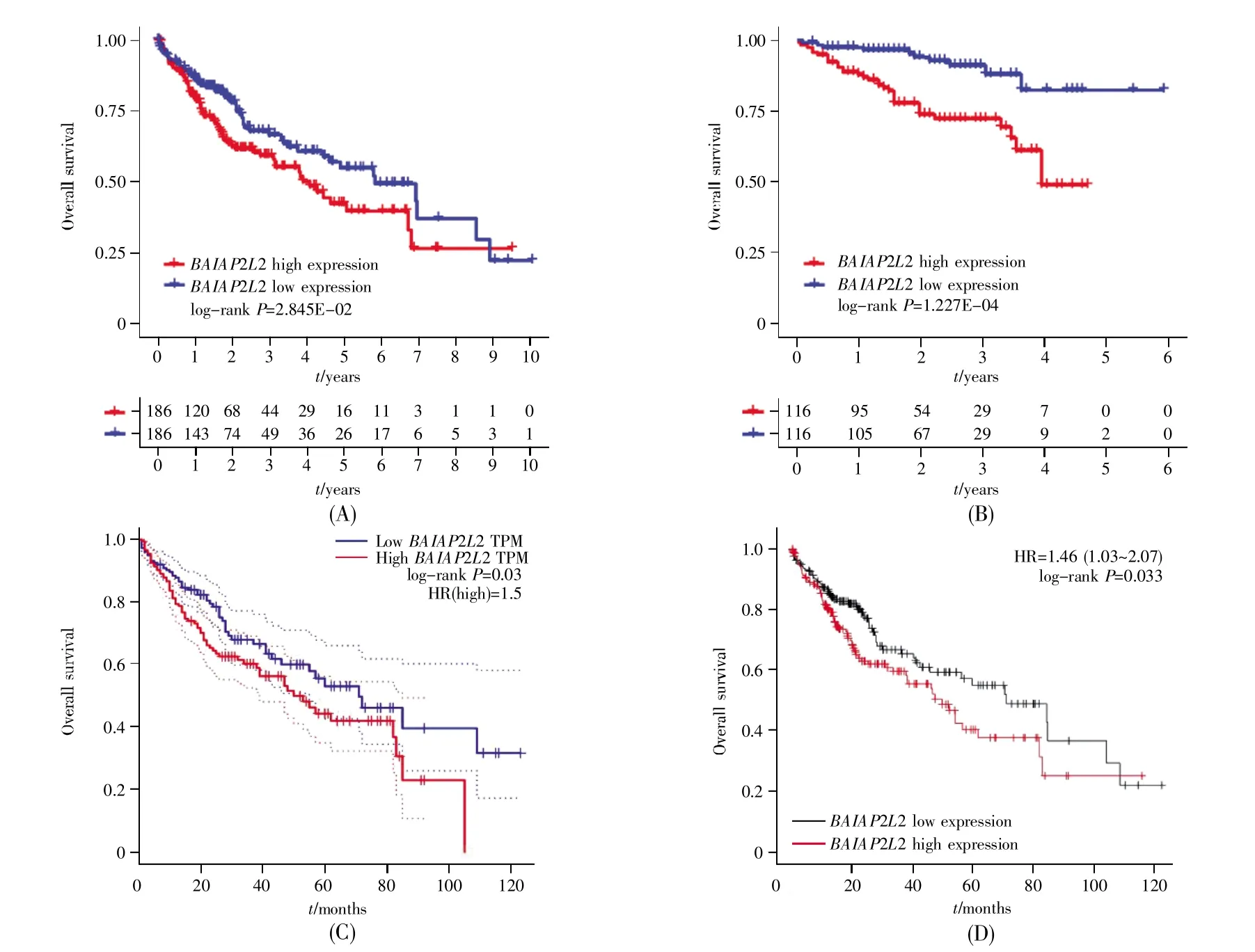
图5 BAIAP2L2表达与肝癌患者生存之间的关系(A)TCGA数据库中不同BAIAP2L2表达组肝癌患者的生存曲线;(B)ICGC数据库中不同BAIAP2L2表达组肝癌患者的生存曲线;(C)GEPIA在线数据库中不同BAIAP2L2表达组肝癌患者的生存曲线;(D)Kaplan Meier-Plotter在线数据库中不同BAIAP2L2表达组肝癌患者的生存曲线。Fig.5 The association between BAIAP2L2 expression and survival in patients with liver cancer(A)The survival curves of liver cancer patients with different BAIAP2L2 expression in TCGA database;(B)The survival curves of liver cancer patients with different BAIAP2L2 expression in ICGC database;(C)The survival curves of liver cancer patients with different BAIAP2L2 expression in GEPIA online database;(D)The survival curves of liver cancer patients with different BAIAP2L2 expression in Kaplan Meier-Plotter online database.
2.4 BAIAP2L2表达与其拷贝数变异、甲基化及miRNAs的关系
通过分析cBioPortal数据库中BAIAP2L2表达与其CNV的关系,我们发现,有5名患者的BAIAP2L2拷贝数发生高水平扩增,53名患者的BAIAP2L2拷贝数增益(低水平扩增),且拷贝数增加组(Gain,n=53)与拷贝数正常组(Diploid,n=237)之间BAIAP2L2的表达有显著差异(P<0.05)(图6A)。与此同时,我们分析了TCGA数据库中肝癌样本的DNA甲基化数据,结果显示:BAIAP2L2甲基化水平与BAIAP2L2表达水平呈负相关(r=-0.41,P<0.001)(图6B);BAIAP2L2低甲基化患者的预后更差(P=0.030)(图6C),且BAIAP2L2低甲基化及高表达的患者预后不良(P=0.012)(图6D)。此外,调控因子预测发现,hsa-miR-99a-3p是调控BAIAP2L2表达的一个潜在miRNA,它与BAIAP2L2表达呈负相关(r=-0.37,P<0.001)(图7A)。与正常肝组织相比,hsa-miR-99a-3p在肝癌组织中的表达显著下调(P<0.001)(图7B),且在49例配对样本的肝癌组织中的表达也显著下调(P<0.001)(图7C)。
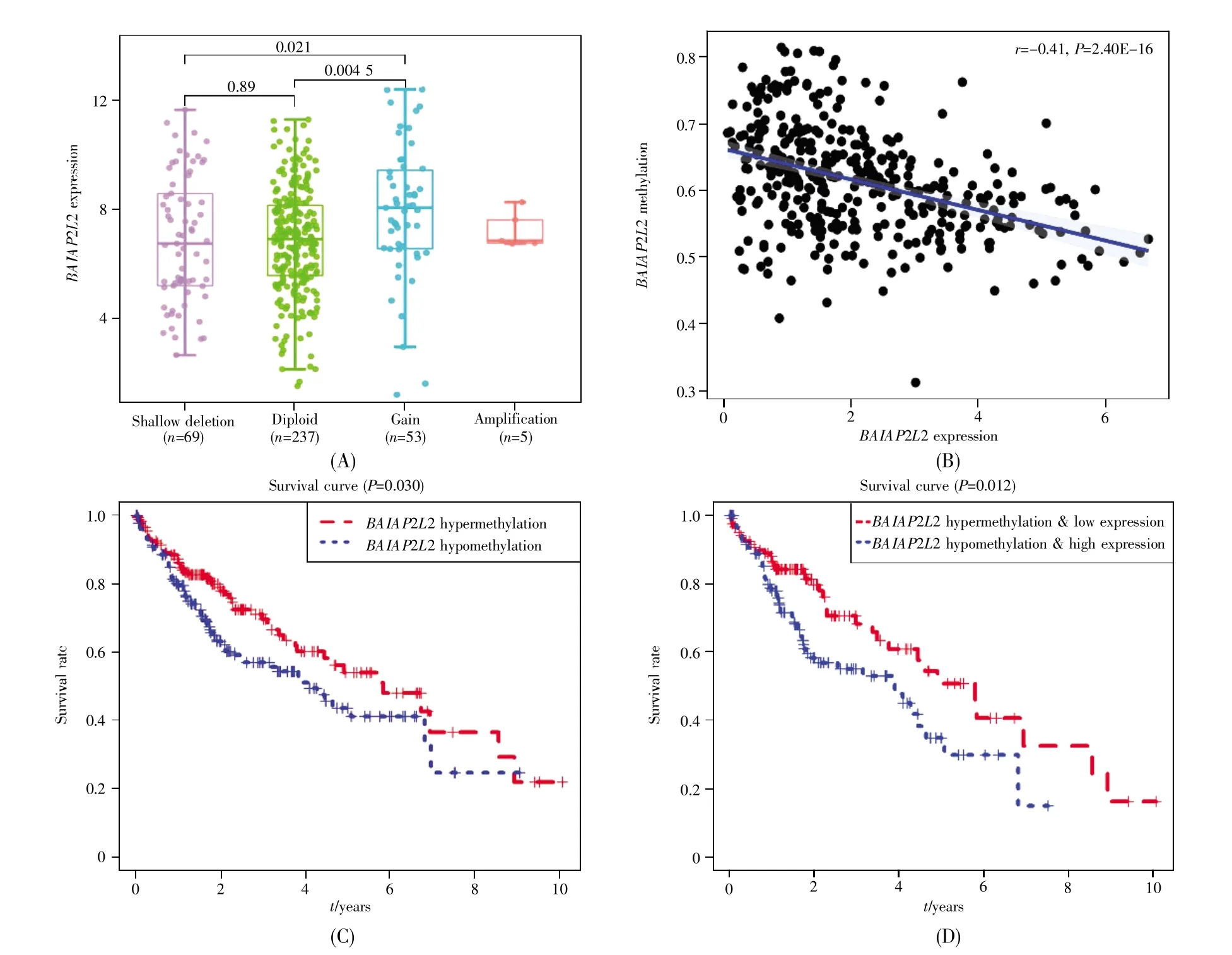
图6 BAIAP2L2表达与BAIAP2L2 CNV和甲基化的关系(A)BAIAP2L2在不同CNV组的表达水平;(B)BAIAP2L2甲基化与BAIAP2L2表达的相关性;(C)基于BAIAP2L2甲基化的生存分析;(D)基于BAIAP2L2甲基化联合表达的生存分析。Fig.6 The association between BAIAP2L2 expression and its CNV and methylation(A)The expression levels of BAIAP2L2 in different CNV groups;(B)The correlation between BAIAP2L2 methylation and its expression;(C)Survival analysis based on BAIAP2L2 methylation;(D)Survival analysis based on both methylation and expression of BAIAP2L2.
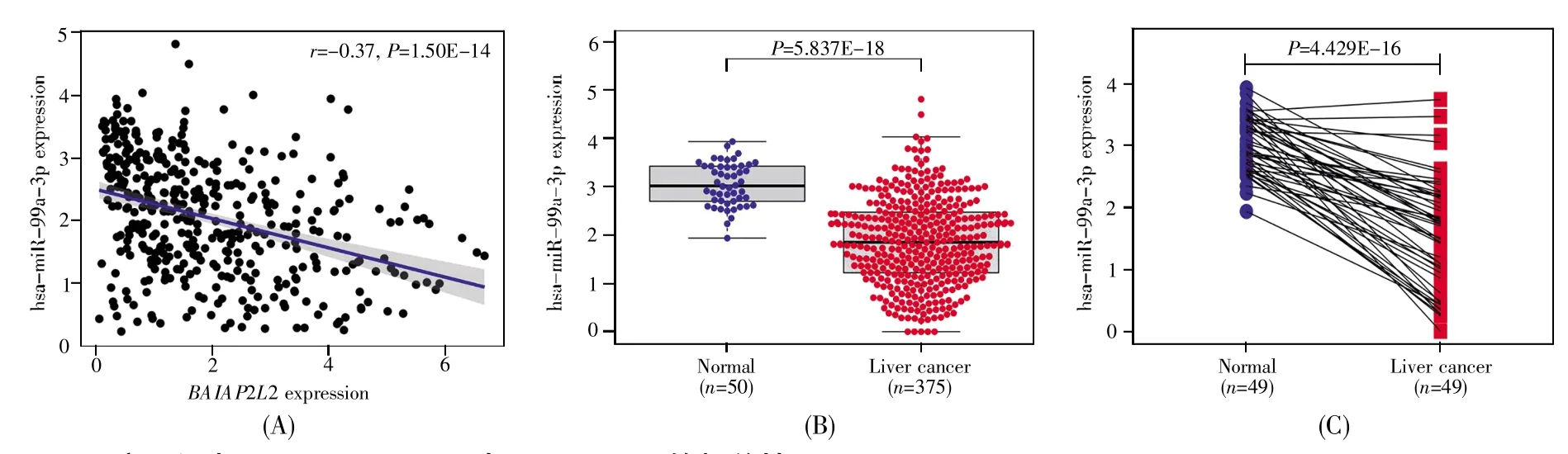
图7 肝癌组织中hsa-miR-99a-3p与BAIAP2L2的相关性(A)hsa-miR-99a-3p与BAIAP2L2表达之间的相关性;(B)hsa-miR-99a-3p在肝癌组织及癌旁组织中的表达水平;(C)hsamiR-99a-3p在配对肝癌组织及癌旁组织中的表达水平。Fig.7 The correlation between hsa-miR-99a-3p and BAIAP2L2 in liver cancer tissues(A)Correlation analysis of hsa-miR-99a-3p and BAIAP2L2 expression;(B)The hsa-miR-99a-3p expression levels in liver cancer and adjacent tissues;(C)The hsa-miR-99a-3p expression levels in paired liver cancer and adjacent tissues.
2.5 BAIAP2L2表达水平与肝癌组织中免疫细胞浸润水平的关系
通过TIMER数据库分析发现,BAIAP2L2表达水平与肝癌组织中B细胞、CD8+T细胞、CD4+T细胞、巨噬细胞、中性粒细胞和树突细胞的浸润水平均呈正相关(P<0.05)(图8A),相关系数分别为 0.181、0.115、0.246、0.288、0.215、0.143。另外,巨噬细胞和中性粒细胞高浸润性的肝癌患者预后不良(P<0.05)(图 8B)。
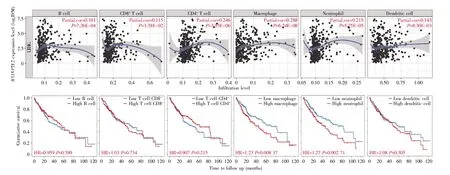
图8 BAIAP2L2与肝癌组织中免疫细胞的关系(A)肝癌组织中免疫细胞浸润水平与BAIAP2L2表达的相关性;(B)肿瘤浸润免疫细胞在肝癌中的预后价值。Fig.8 The association between BAIAP2L2 expression and infiltrated immune cells in liver cancer tissues(A)The correlation between the abundance of infiltrated immune cells and BAIAP2L2 expression;(B)The prognostic value of the infiltrated immune cells in liver cancer.
2.6 BAIAP2L2的GSEA富集结果
通过GSEA预测BAIAP2L2在肝癌中参与调节的通路,发现BAIAP2L2高表达显著富集于细胞周期、p53信号通路、DNA复制、碱基切除修复及同源重组等通路,而BAIAP2L2低表达显著富集于补体和凝血级联、过氧化物酶体增殖物激活受体信号通路、色氨酸代谢、脂肪酸代谢及初级胆汁酸生物合成等通路(表2,图9)。

表2 BAIAP2L2在肝癌中的基因富集分析Table 2 Gene set enrichment analysis based on BAIAP2L2 in liver cancer

图9 GSEA预测BAIAP2L2在肝癌中参与调节的信号通路富集分数正值为BAIAP2L2高表达富集通路;富集分数负值为BAIAP2L2低表达富集通路。Fig.9 Prediction of BAIAP2L2 involved signaling pathways based on GSEA in liver cancerThe positive enrichment scores refer to the pathways enriched in the high expression of BAIAP2L2,and the negative enrichment scores refer to the pathways enriched in the low expression of BAIAP2L2.
3 讨论
肝癌是一种常见且高死亡率的恶性肿瘤。尽管医学发展迅速,但是肝癌的复发和转移仍然无法解决,早期诊断和有效的治疗可以延长患者的生存期[21]。因此,寻找可靠的生物标志物用于肝癌诊断、治疗及预后评价至关重要。目前,已有研究报道BAIAP2L2在肺癌、胃癌、前列腺癌等肿瘤中高表达,且与患者预后不良有关[9~11],但是在肝癌中的相关研究尚不清楚。在本研究中,我们分析得出BAIAP2L2在肝癌中高表达(图1),且对肝癌具有一定的诊断价值(图4A),这预示着BAIAP2L2可作为肝癌分子和病理诊断的一种生物标志物。同时,BAIAP2L2是肝癌独立预后的危险因素,其高表达患者的预后更差(图5,表1),提示BAIAP-2L2可作为肝癌潜在的预后标志物。Liu等[10]研究表明,BAIAP2L2表达与胃癌患者的肿瘤直径、TNM分期和淋巴结转移相关。本研究得出了类似的结果,发现BAIAP2L2表达与肝癌患者性别、TNM分期、AFP及存活状态显著相关(图3)。同时,AFP阳性患者中BAIAP2L2的表达水平显著高于AFP阴性患者,且BAIAP2L2表达水平随着肿瘤病理分期程度的增加而递增,这提示BAIAP2L2可能与肝癌发生发展密切相关。目前,现有的肝癌血清生物标志物的诊断灵敏性和特异性相对不足[22]。虽然AFP是一种广泛用于肝癌诊断的生物标志物,但是由于在早期肿瘤的诊断中假阴性率高,其诊断准确性受到限制[23]。Hou等[24]利用高尔基体蛋白73(Golgi protein 73,GP73)联合AFP显著提高了肝癌患者的诊断效率。本文发现,BAIAP2L2在肝癌中具有较好的诊断价值,且与AFP具有显著正相关(图4B)。因此,将BAIAP2L2独立或联合AFP用于肝癌早期无创筛查和早期诊断也许是未来的一种新策略。
本研究从DNA层面探讨了肝癌中BAIAP2L2表达上调的潜在机制。首先,CNV会影响基因的转录或翻译,进而在肿瘤发生发展过程起重要作用[25]。我们分析发现,在BAIAP2L2的CNV中共有58例(15.93%,n=364)肝癌患者发生低或高水平DNA扩增(图6A),这与BAIAP2L2表达上调显著相关。其次,DNA甲基化是一种常见表观遗传学修饰过程,DNA低甲基化导致染色体不稳定性和基因表达上调,进而在促进癌细胞增殖和转移等方面发挥作用[26~27]。本研究发现,肝癌中BAIAP2L2表达与其DNA甲基化水平之间存在显著的负相关(图6B),这提示BAIAP2L2低甲基化也许是BAIAP2L2表达上调的原因之一。最后,miRNA能促进mRNA降解、改变或抑制基因表达,它的表达失调会引起肿瘤发生一系列病理过程[28~29]。有研究报道,miR-99a-3p在头颈部癌和子宫内膜癌中的表达显著下调[30~31]。本研究发现,miR-99a-3p在肝癌中表达下调,且与BAIAP2L2表达呈负相关(图7),这可能是导致BAIAP2L2表达上调的另一种潜在机制。上述结果表明,在肝癌中BAIAP2L2的拷贝数增加、低甲基化以及调控因子miR-99a-3p的改变或许是BAIAP2L2表达上调的潜在机制。
另外,本研究发现,BAIAP2L2表达与肝癌组织中B细胞、CD8+T细胞、CD4+T细胞、巨噬细胞、中性粒细胞和树突细胞的浸润水平呈正相关关系(图8A),且巨噬细胞和中性粒细胞高水平浸润的肝癌患者预后更差(图8B)。大量研究证实,肿瘤微环境中浸润免疫细胞与患者的预后密切相关[32~33]。肿瘤相关巨噬细胞(tumor associated macrophage,TAM)是肿瘤微环境的组成部分,它通过调节肝癌细胞免疫应答和分泌多种细胞因子,参与肿瘤的进展和转移[34]。巨噬细胞大量浸润肝癌微环境,常与肝癌患者预后不良有关[35],这与本研究结果一致。同时,我们发现,BAIAP2L2在肝癌中参与调节细胞周期、p53信号通路、同源重组等通路(图9,表2)。其中,已有研究证实,BAIAP2L2在肺癌中参与调节细胞周期通路[9]。由此可见,BAIAP2L2可能通过多种机制参与肿瘤的发生发展并影响患者的预后。
综上所述,BAIAP2L2在肝癌组织中的表达显著上调,这可能与BAIAP2L2的CNV增加、低甲基化以及miR-99a-3p表达下调有关,且BAIAP2L2表达与肝癌患者生存显著相关,因此其可作为肝癌诊断和预后的潜在标志物。然而,本文仅停留在生物信息学分析层面,后续仍需要进一步在基础实验上验证BAIAP2L2在体内和体外的致癌作用机制,以及在动物实验上验证和评价BAIAP2L2作为肝癌靶点的免疫治疗疗效。